以物质的量为中心的计算共26页文档
高中化学 以物质的量为中心的化学计算

专题2以物质的量为中心的化学计算考点一阿伏加德罗常数及其应用【考必备·清单】1.明确以物质的量为核心的各个化学计量之间的关系2.突破阿伏加德罗常数命题的“五大陷阱”陷阱一:注意“标准状况”“常温常压”等外界条件(1)在标准状况下非气态物质如H2O、SO3、戊烷、CHCl3、HF、NO2、苯等;(2)物质的质量、摩尔质量、微粒个数不受外界条件的影响。
陷阱二:注意物质的组成和结构(1)特殊物质中所含微粒(分子、原子、电子、质子、中子等)的数目,如Ne、D2O、18O2、H37Cl;(2)物质中所含化学键的数目,如CO2、C n H2n+2等;(3)最简式相同的物质中的微粒数目,如NO2和N2O4、乙烯和丙烯、O2和O3等;(4)摩尔质量相同的物质中的微粒数目,如N2、CO、C2H4等。
陷阱三:注意氧化还原反应中电子转移数目的判断(1)同一种物质在不同反应中氧化剂、还原剂的判断;如Cl2和Fe、Cu等反应,Cl2只作氧化剂,而Cl2和NaOH反应,Cl2既作氧化剂,又作还原剂。
Na2O2与CO2或H2O反应,Na2O2既作氧化剂,又作还原剂,而Na2O2与SO2或NO等反应,Na2O2只作氧化剂。
(2)量不同,所表现的化合价不同。
如Fe和HNO3反应,Fe不足,生成Fe3+,Fe过量,生成Fe2+。
(3)氧化剂或还原剂不同,所表现的化合价不同。
如Cu和Cl2反应生成CuCl2,而Cu和S反应生成Cu2S。
(4)注意氧化还原的顺序。
如向FeI 2溶液中通入Cl 2,Cl 2首先氧化I -,再氧化Fe 2+。
陷阱四:注意电解质溶液中粒子数目的判断(1)是否存在弱电解质的电离或盐类的水解。
(2)已知浓度,是否指明体积,用好公式n =cV 。
(3)在判断溶液中微粒总数时,是否忽视溶剂水。
陷阱五:注意一些可逆反应、特殊反应(1)2SO 2+O 2催化剂△2SO 3,2NO 2N 2O 4,N 2+3H 2高温、高压催化剂2NH 3。
有关物质的量计算
【例题2】在25OC时,硫酸铜的溶解度为 g,把S g无水硫 例题 】 时 硫酸铜的溶解度为S 把 无水硫 硫酸铜的溶解度为
酸铜加入到(100+S)g饱和硫酸铜溶液中 得到一定量的蓝色 饱和硫酸铜溶液中,得到一定量的蓝色 酸铜加入到 饱和硫酸铜溶液中 晶体.若将这些蓝色晶体溶于水制成饱和溶液 需要加水的 晶体 若将这些蓝色晶体溶于水制成饱和溶液,需要加水的 若将这些蓝色晶体溶于水制成饱和溶液 质量是 A. (100-9/25S)g B. (100-16/25S)g C. (100+S) g D. 100 g
问题阶梯
问题1:浓度为25%的1g氨水 (ρ=0.91g·cm-1 )与1g纯水混合后,所 得溶液的质量分数为 A.等于12.5% B.大于 12.5% C.小于 12.5% D.无法确定 问题3:把 70% HNO3(密度为 1.40 g·cm-3)加到等质量的水中,稀释后 HNO3溶液的质量分数是 A.0.35 B.<0.35 C.>0.35 D.≤0.35
的稀硫酸慢慢加入一定量的BaCl2溶 【例题3】 将PH=1的稀硫酸慢慢加入一定量的 例题 】 的稀硫酸慢慢加入一定量的
的饱和溶液VmL,密度为 g/cm-3, 密度为d 【例题4】物质 2SO4的饱和溶液 例题 】物质A 密度为
C(A+)=Pmol/L,溶液的溶质质量分数为 溶液的溶质质量分数为a%,溶质的式量为 溶液的溶质质量分数为 溶质的式量为 M,溶解度为 g,下列表示式正确的是 溶解度为S 下列表示式正确的是 溶解度为 A. P=2000da/M B. d/(100+S)=PM/2000 C. d×a%=PM/1000 D. a%=PM/2000d ×
【例题2】三个容器中分别盛有 2、CH4、O2,已知三 例题 】三个容器中分别盛有H
2013-2014学年高中化学《第二节 化学计量在实验中的应用》 以物质的量为中心的计算知识总结 新人教版必修1
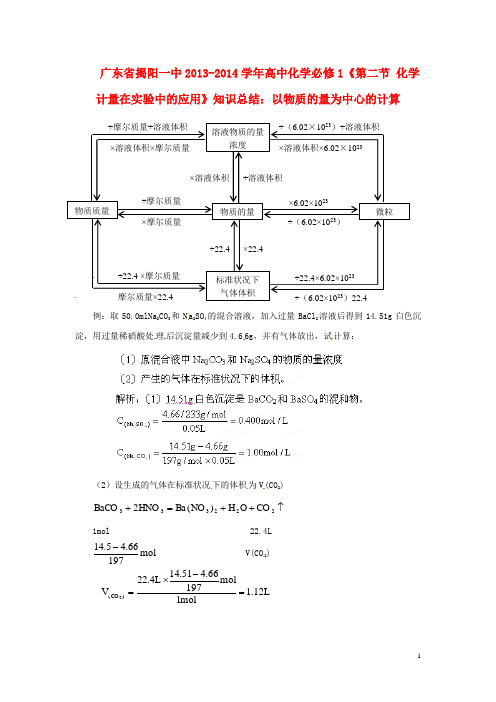
(2)设生成的气体在标准状况 下的体积 为 V (CO2)
BaCO3 2HNO3 Ba(NO3 ) 2 H 2 O CO 2
1mol 22.4L V(CO 2)
14 .5 4.66 mol 197
V( CO 2 )
22.4L
14.51 4.66 mol 197 1.12L 1mol
1
答案: ( 1)原混合液中 Na2CO3、Na2CO3 的物质的量浓度为 0. 400mo l/L,1.00mol/L; (2) 产生气体为 1.12L。
2
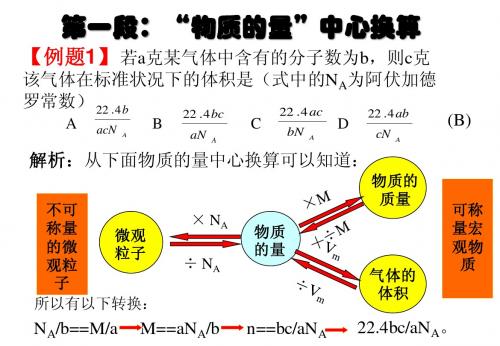
物质质量
物质的量 × 摩尔质量 ÷ 22.4 ÷ 22.4 × 摩尔质量 摩尔质量× 22.4 × 22.4
微粒
标准状况下 气体体积
÷ 22.4× 6.02× 1023 ÷ (6.02× 1023)22.4
例:取 50.0mlNa2CO3 和 N a2SO4 的混合溶液,加入过量 BaCl2 溶液后得到 14.51g 白色沉 淀,用过量稀硝酸处 理 后沉淀量减少到 4.6 6g,并有气体放出,试 计算:
广东省揭阳一中 2013-2014 学年高中化学必修 1《第二节 化学 计量在实验中的应用》知识总结:以物质的量为中心的计算
÷ 摩尔质量÷ 溶液体积 × 溶液体积× 摩尔质量 溶液物质的量 浓度 ÷ (6.02×1023)÷ 溶液体积 × 溶液体积× 6.02×1023
× 溶液体积 ÷ 摩尔质量 Nhomakorabea÷ 溶液体积 × 6.02× 1023 ÷ (6.02× 1023)
微题型10 以物质的量为中心的计算(解析版)

微题型10 以物质的量为中心的计算时间:30分钟 1.下列各组物质中含氧原子的物质的量相同的是A .9.6 g O 2和5.4 g H 2OB .0.1 mol H 2SO 4和3.6 g H 2OC .0.1 mol MgSO 4·7H 2O 和0.1 mol C 12H 22O 11(蔗糖)D .6.02×1023个CO 2与0.1 mol KMnO 4【答案】C【详解】A .n(O)分别为0.6 mol 和0.3 mol ,错误;B .0.1 mol H 2SO 4中,n(O)=0.4 mol ,3.6 g H 2O 中n(O)= 3.6g 18g/mol×1=0.2 mol ,错误; C .0.1 mol MgSO 4·7H 2O 中,n(O)为1.1 mol ,0.1 mol C 12H 22O 11中,n(O)也为1.1 mol ,正确;D .6.02×1023个CO 2中,n(O)=23A 6.0210N ×2=2 mol , 0.1 mol KMnO 4中n(O)=0.4 mol ,D 错误。
故选C 。
2.下列说法正确的是A .同温同压下,N 2和CO 2的密度相同B .质量相同的H 2O 和CO 2所含的原子数相同C .物质的量相同的CH 3CH 2OH 和CH 3CHO 所含共价键数相同D .室温下,pH 相同的盐酸和硝酸中,溶质的物质的量浓度相同【答案】D【详解】A .同温同压下,N 2和CO 2的体积相同时,物质的量相同,其质量之比为28∶44,则密度之比为28∶44,不相同,A 说法错误;B .质量相同的H 2O 和CO 2的物质的量之比为44∶18,分子中均含有3个原子,则所含的原子数之比为44∶18,不相同,B 说法错误;C .CH 3CH 2OH 分子中含共价键数为8条,CH 3CHO 分子中含共价键数为7条,则物质的量相同的CH 3CH 2OH 和CH 3CHO 所含共价键数不相同,C 说法错误;D .室温下,pH 相同的盐酸和硝酸中,氢离子的浓度相等,硝酸和盐酸均是一元强酸,能完全电离出一个H +,故pH 相同的盐酸和硝酸的物质的量浓度相同,D 说法正确; 故答案选D 。
专题4 以物质的量为中心的化学计算的解题方法(专题突破)化学高一上学期人教版(2019)必修第一册

专题4 以物质的量为中心的化学计算的解题方法第一部分知识梳理一、物质的量的单位——摩尔1.物质的量(1)概念:表示含有一定数目粒子的集合体的基本物理量。
(2)符号及单位:符号为n,单位为摩尔。
2.摩尔3.阿伏加德罗常数二、摩尔质量【点拨提升】物质的量——“四化”1.(2021·江苏·涟水县第一中学高一月考)下列说法中正确的是 A .摩尔是表示物质质量的单位B .物质的量适用于计量分子、原子、离子等粒子的集合体C .摩尔是表示物质所含微粒个数的物理量D .物质的量就是指物质的质量 【答案】B 【详解】A .摩尔是物质的量的单位,A 错误;B .物质的量是表示一定数目粒子的集合体的物理量,适用于计量分子、原子、离子等粒子的集合体,B 正确;C .摩尔是物质的量的单位,不是物理量,C 错误;D .物质的量是表示一定数目粒子的集合体的物理量,不是物质的质量,D 错误; 选B 。
2.(2021·黑龙江·佳木斯一中高一期中)下列关于摩尔质量的说法正确的是 A .2mol 2CO 的摩尔质是1mol 2CO 摩尔质量的2倍B .任何物质的摩尔质量都等于它的相对分子质或相对原子质量C .某1个原子的质量是a g ,则该原子的摩尔质量是a A N g/molD .硫酸的摩尔质量是98g 【答案】C 【详解】A .摩尔质量和物质的量无关,故A 错误;B .摩尔质量和相对分子质量或相对原子质量在数值上相同,而不是相等,故B 错误;C .1个原子的物质的量A AN 1n=mol N N ,摩尔质量A Am agM===aN g/mol 1n mol N ,故C 正确; D .摩尔质量的单位为g/mol ,硫酸的摩尔质量是98g/mol ,故D 错误; 故选C 。
【变式训练】1.(2021·山东·鄄城县实验中学高一月考)下列叙述错误的是 ①摩尔是国际单位制中的七个基本物理量之一 ②1 mol 任何物质都含有约6.02×1023个粒子 ③6.02×1023就是阿伏伽德罗常数 ④1 mol 氢原子就是一个氢原子 ⑤1 mol CO 2中含1 mol 碳和2 mol 氧 A .①②③ B .②③④C .②③④⑤D .①②③④⑤【答案】D 【详解】①摩尔是物质的量的单位,不是基本物理量,①错误;②1 mol 任何物质都含有约6.02×1023个组成物质的基本粒子,由于未指明是组成物质的基本微粒,因此该说法不合理,②错误;③6.02×1023是阿伏伽德罗常数的数值,阿伏伽德罗常数为6.02×1023mol -1,③错误; ④1 mol 氢原子是阿伏伽德罗常数个氢原子,④错误;⑤1 mol CO 2分子中含1 mol 碳和2 mol 氧原子,未指明是O 元素的原子,因此该说法不合理,⑤错误;综上所述可知:上述五种说法均错误; 故合理选项是D 。
以物质的量为中心的计算

《以物质的量为中心的有关计算》学案【学习目标】1.了解物质的量的单位——摩尔(mol )、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义。
2.根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
3.掌握有关溶液中溶质的物质的量浓度,质量百分比浓度,溶解度的计算,以及它们之间的联系。
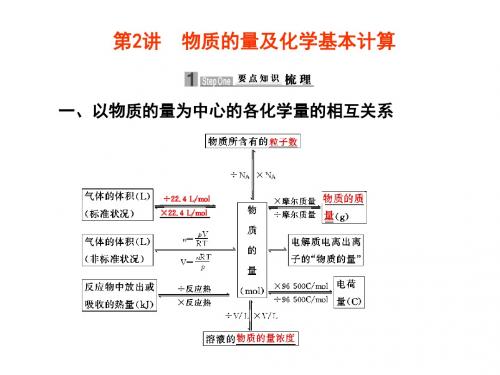
一、基础知识回顾1.注意:(1)“一个中心”:必须以物质的量为中心; (2)“两个前提”:在应用Vm=22.4L/mol 时,一定要以“标准状况”和“气体状态”为两个前提条件(混合气体也适用)。
2.阿伏伽德罗定律:同温同压下,相同体积的任何气体具有相同的粒子数。
万能公式:PV=nRT 【例一】铅笔芯的主要成分是石墨和黏土。
如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1 mg 。
那么一个铅笔字含有的碳原子数约为_________________个。
变式1:若50滴水正好是m mL ,则1滴水所含的分子数是_____________。
【例二】已知a g 某气体所含分子数为b ,则该气体的摩尔质量为_______,c g 该气体在标准状况下的体积为___________。
变式2: 有一真空瓶质量为m 1,该瓶充入空气后的质量为m 2,在相同状况下,若改为充入某气体A 时,总质量为m 3。
则A 的相对分子质量是__________。
(已知空气的相对分子质量是29)【例三】根据阿伏伽德罗定律,可以得出:(1)同温同压下两种气体的体积之比与摩尔质量之比成____比;(正/反,下同)(2)同温同压下两种气体的物质的量之比与密度之比成____比;(3)同温同压下两种气体的摩尔质量之比与密度之比成____比;变式3:在标准状况下,m g 气体A 与n g 气体B 的分子数相同,下列说法中不正确的是( )A.气体A 与气体B 的相对分子质量之比为m :nB.等质量气体A 与气体B 的分子数之比为n :mC.同温同压下,气体A 与气体B 的密度之比为n :mD.相同状况下,等体积的气体A 与气体B 的质量之比为m :n练习:1、同温同压下,等质量的CO 2和SO 2两种气体相比较,下列叙述正确的是( )A.密度比: 11:16B.体积比: 16 :11C.体积比: 1 :1 D 密度比: 16:112、在标准状况下,112ml 某气体体的质量为0.17g ,该气体可能是 ( )A. O 2B. N 2C. H 2SD. CO 23、标准状况下有①6.72LCH 4②3.01×1023个HCl ③13.6gH 2S ④0.2molNH 3,下列对四种气体的关系从小到大表示不正确的是 ( )A.体积 ④<①<②<③B.密度 ①<④<③<②×V m ÷V m ÷N A ×N A ×M ÷M ×V ÷V 物质的量 n (mol ) 物质的质量m(g) 物质的粒子数N (分子、原子、离子、电子等) 气体体积(标况)V (L ) 物质的量浓度C (mol/L)C.质量 ④<①<③<②D.氢原子数 ④<②<③<①4、标准状况下mg 气体A 和ngB 气体的分子数相同,下列说法不正确的 ( )A.A 与B 的相对分子质量之比为m:nB.同温同压下,两气体A 与B 的密度之比为n:mC.同质量的A 与B 分子个数之比为n:mD.相同状况下,同体积的气体A 与B 质量比为m:n5、同一状态下,20molA 2气体与30molB 2气体恰好完全反应生成20mol 某气体X,则可推出X 的化学式为 ( )A.AB 2B.AB 3C.A 2B 3D.A 3B 2二、一定物质的量浓度溶液的配制1、实验仪器2、实验步骤3、误差分析三、有关溶液的计算1、基本公式的相互转化2、稀释定律3、离子浓度的相关计算例1、500mL 0.2mol/L 的Ba(NO 3)2溶液中:Ba 2+的浓度为 ;NO 3-离子的浓度为 ;溶液中阴阳离子总数为 .变式1、下列各溶液中,Cl —浓度最大的是:( )A.3mol/L 的NaClB.2mol/L 的CaCl 2C.1mol/L 的FeCl 3D.1.5mol/L 的AlCl 3变式2、下列溶液中Na +的物质的量浓度最大的是( )A 、100mL 1mol/L 的NaCl 溶液B 、100mL 1mol/L 的Na 2SO 4溶液C 、100mL 0.5mol/L 的Na 3PO 4溶液D 、400mL 0.5mol/L 的Na 2SO 4溶液4、溶解度、质量分数、物质的量浓度的相互换算例2、某市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm 3。
第2讲物质的量及化学基本计算
D项,
正确。
m (a b) g 1 000 ( a b) g/L ,因此只有选项C 3 V V 10 L V
答案 C
考点四
一定物质的量浓度的溶液的配制及误差 分析
【例4】 实验室配制500 mL 0.5 mol/L的NaCl溶 ①把称量的NaCl晶体放入小烧杯中, ②把①所得溶液小心转入500 mL容 ③继续向容量瓶中加蒸馏水至液面距刻度2~3 cm 处,改用胶头滴管小心滴加蒸馏水至溶液凹液面
(填“偏高”、“偏低”或
(5)若实验过程中出现如下情况应如何处理?加蒸
馏水时不慎超过了刻度 面 取。(3)根据c=
n ,V偏小,c V
。向容量 。
瓶中转移溶液时(操作步骤②)溶液流到容量瓶外
解析 (2)为防止仪器的遗漏,可根据步骤进行选
(4)加蒸馏水超过刻度,V偏大,c偏低这种情况
下配制的溶液浓度不是0.5 mol/L,因此要重配。 答案 (1)①②④③⑤ (2)500 mL容量瓶、托盘天
有关阿伏加德罗常数的应用问题,实质上是以 物质的量为中心的各物理量间的换算,需要特别注 1.状态问题,如标准状况下SO3为固态,戊烷为
液态。标准状况下的气体适用气体摩尔体积
(22.4 L/mol),相同状况下的气体适用阿伏加德罗 2.特殊物质的摩尔质量,如D2O、18O2 3.物质分子中的原子个数,如O3、白磷、稀有气 4.某些物质中的化学键,如SiO2、P4、CO2等。
24
如加入足量强碱并加热可得到c mol NH3,则原溶液
中的Al3+离子浓度(mol/L)为
2b c A. 2a
(
D. 2b c
6a
)
B. 2b c
2019-2020版高考化学二轮教师用书第1部分 专题1 第2讲 阿伏加德罗常数 Word版含答案

第2讲 阿伏加德罗常数(对应学生用书第5页)■储知识——剖解重点难点备考·1.四个关键问题六大突破点阿伏加德罗常数应用的2. 求算N (微粒数)的基本思路:气体摩尔体积的适用条件1突破点 (1)角度:从V m =22.4 L·mol -1的适用条件和物质的状态突破。
(2)突破方法:一看气体是否处在“标准状况(0 ℃、101 kPa)”;二看标准状况下,物质是否为气态(如CCl 4、CHCl 3、CH 2Cl 2、H 2O 、溴、SO 3、己烷、HF 、苯、乙醇等在标准状况下均不为气态)。
与物质所处状况)或质量(物质的量 2突破点 (1)角度:设置与计算无关的一些干扰条件,给出非标准状况下气体的物质的量或质量,干扰正确判断。
(2)突破方法:排“干扰”,明确物质的量或质量与物质所处状况无关,物质的量或质量确定时,物质所含的粒子数与温度、压强等外界条件无关。
物质的组成与结构3突破点 (1)角度:从特殊物质的组成与结构特点突破。
(2)突破方法:①熟记特殊物质中所含微粒(分子、原子、电子、质子、中子等)的数目,常考查的特殊物质(如Ne 、D 2O 、18O 2、O 3、P 4、H 37Cl 、—OH 、OH -等)。
②记住最简式相同的物质,明确微粒数目特点(如NO 2和N 2O 4、乙烯和丙烯、O 2和O 3等)。
③记住物质中所含化学键的数目(如1 mol 硅中含Si —Si 键的数目为2N A,1 mol SiO 2中含Si —O 键的数目为4N A ,再如H 2O 2、C n H 2n +2中化学键的数目分别为3、3n +1等)。
④记住摩尔质量相同的物质(如N 2、CO 、C 2H 4等)。
电解质溶液中粒子数目4突破点 (1)角度:难电离、易水解的粒子的数目计算以及电解质组成、溶液体积等因素上突破。
(2)突破方法:细审题、抓“三看”:一看是否指明溶液的体积;二看是否有弱电解质或可水解的弱酸根离子(或弱碱阳离子),如1 L 0.1 mol·L -1的乙酸溶液和1 L 0.1 mol·L -1的乙酸钠溶液中含CH 3COO -的数目不相等且都小于0.1N A ;三看所给条件是否与电解质的组成有关,如pH =1的H 2SO 4溶液中c (H +)=0.1 mol·L -1(与电解质的组成无关),0.05 mol·L -1的Ba(OH)2溶液中c (OH -)=0.1 mol·L -1(与电解质的组成有关),不要忽略溶剂水中的H 、O 原子数目。
