【化学】初三化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析
(化学)九年级化学化学方程式的计算解题技巧及练习题(含答案)及解析

(化学)九年级化学化学方程式的计算解题技巧及练习题(含答案)及解析一、中考化学方程式的计算1.洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。
向一锥形瓶中加入100 g 该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO 3溶液120 g ,反应结束后溶液的总质量是215.6 g 。
试计算下列问题: (知识卡片)①洁厕灵有效成分是HCl ,洁厕灵中其它成分均不跟NaHCO 3反应。
②HCl 和NaHCO 3反应的化学方程式为HCl+NaHCO 3=NaCl+H 2O+CO 2↑ (1) 产生的二氧化碳质量为_________克。
(2) 该品牌洁厕灵中HCl 的质量分数是多少?_____(写出计算过程) 【答案】4.4 3.65% 【解析】 【分析】盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量。
【详解】(1) 由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量,故产生的二氧化碳质量为100g+120g-215.6g=4.4g 。
(2) 设100 g 该品牌洁厕灵中HCl 的质量为x322HCl +NaHCO =NaCl +H O +CO 36.544x4.4g↑ 36.544=x 4.4gx=3.65g该品牌洁厕灵中HCl 的质量分数为:3.65g100%=3.65%100g⨯ 答:该品牌洁厕灵中HCl 的质量分数为3.65%。
【点睛】=100%⨯溶质质量溶质质量分数溶液质量2.一同学取来某品牌的钾肥(主要成分硫酸钾,还含少量的氯化钾)共200克,投入到908克的氯化钡溶液中恰好完全反应。
经过滤后得到硫酸钡沉淀233克和氯化钾的不饱和溶液。
请帮他计算:(注明:K 2SO 4+ BaCl 2= BaSO 4↓+2KCl ) (1)氯化钾的相对分子质量是_______。
初三化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析

初三化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析一、中考化学方程式的计算1.称取5.8g某生铁样品放入94.6g稀盐酸中,恰好完全反应后气体全部逸出,所得剩余物质的质量为100.2g(生铁样品中的杂质不溶于水,也不与盐酸发生反应)。
试计算该生铁样品中铁的质量是多少_____。
【答案】5.6g【解析】【分析】铁与稀盐酸反应生成氯化亚铁和氢气。
【详解】根据质量守恒定律,生成氢气的质量为:5.8g+94.6g-100.2g=0.2g设该生铁样品中铁的质量是x,2442Fe+H SO=FeSO+H562x0.2g56x=20.2gx=5.6g答:该生铁样品中铁的质量是5.6g。
2.请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:计算稀盐酸中溶质质量。
【答案】7.3g【解析】【分析】【详解】根据质量守恒反应前后物质总质量不变可得二氧化碳的质量等于12g+100g+100g-207.6g=4.4g设稀盐酸中溶质质量为x3222CaCO 2HCl =CaCl CO H O7344x4.4g 73x =,x=7.3g 44 4.4g++↑+ 答:稀盐酸中溶质质量7.3g 【点睛】根据质量守恒,求出二氧化碳质量,根据二氧化碳质量求稀盐酸中溶质质量3.波尔多液是一种运用广泛的农药,由熟石灰和硫酸铜配制而成。
某工厂用以下反应:2Cu+O 2+2H 2SO 4=2CuSO 4+2H 2O 来生产硫酸铜,若要制得 40kg 硫酸铜。
试计算: (1)硫酸铜中铜元素质量分数是_____。
(2)若恰好消耗稀硫酸的质量是 200kg ,则该稀硫酸溶质的质量分数是多少_____?【答案】40% 12.25%【解析】【分析】【详解】(1)CuSO 4中Cu 元素质量分数=6464100%=100%=40%6432416160⨯⨯++⨯。
(2)设消耗的硫酸的质量为x 。
22442H SO 2CuSO 2Cu O 2=2982160x 40kg2H O+++⨯⨯ x 29840kg 2160⨯=⨯ x=24.5kg则稀硫酸溶质的质量分数=24.5kg 100%=12.25%200kg⨯。
九年级化学化学方程式的计算解题技巧(超强)及练习题(含答案)及解析

九年级化学化学方程式的计算解题技巧(超强)及练习题(含答案)及解析一、中考化学方程式的计算1.铝被称为“年轻的金属”,工业上用电解氧化铝的方法制取金属铝。
反应的化学方程式为2Al2O3通电4Al+3O2↑。
请计算生成1.08t金属铝,理论上需要氧化铝的质量是多少____?【答案】2.04t【解析】【分析】【详解】解:设生成1.08t金属铝,理论上需要氧化铝的质量为x232 2Al O4Al+3O204108x 1.08t通电204x=108 1.08tx=2.04t答:生成1.08t金属铝,理论上需要氧化铝的质量为2.04t。
2.向 100 克 MgCl2和 HCl 的混合溶液中,逐滴加入 10%的氢氧化钠溶液,反应情况,如图所示。
(1)当滴加氢氧化钠溶液的质量至 N 点时所得溶液的 pH 值为_______(填编号);A大于 7 B等于 7 C小于 7(2)通过计算,确定 M 点时所得溶液中溶质的质量分数,写出计算过程____。
【答案】A 9.2%(详见解析)【解析】【分析】向 100 克 MgCl2和 HCl 的混合溶液中,逐滴加入 10%的氢氧化钠溶液,氢氧化钠先与盐酸反应,等盐酸完全反应后再与氯化镁反应。
【详解】(1)当滴加氢氧化钠溶液的质量至N 点时,氢氧化钠过量,溶液呈碱性,pH.>7,故选A ;(2)根据图示可知,反应过程中生成了5.8g 的氢氧化镁。
设恰好完全反应时,和氯化镁反应的氢氧化钠溶液的质量为x()222NaOH +MgCl =2NaCl +Mg OH 8058x 10%5.8g↓⨯ 80x 10%=58 5.8g⨯ x=80g所以反应的全部的氢氧化钠的质量为(80g+80g )×10%=16g ;设生成的氯化钠的质量为y ,由于钠元素最终转到氯化钠得关系式为: N 4058.516g yaOH NaCl~ 4016=58.5yy=23.4g 所得氯化钠溶液中氯化钠的质量分数为23.4g 100%9.2%100g+80g+80g-5.8g⨯≈。
【化学】九年级化学化学方程式的计算的基本方法技巧及练习题及练习题(含答案)及解析
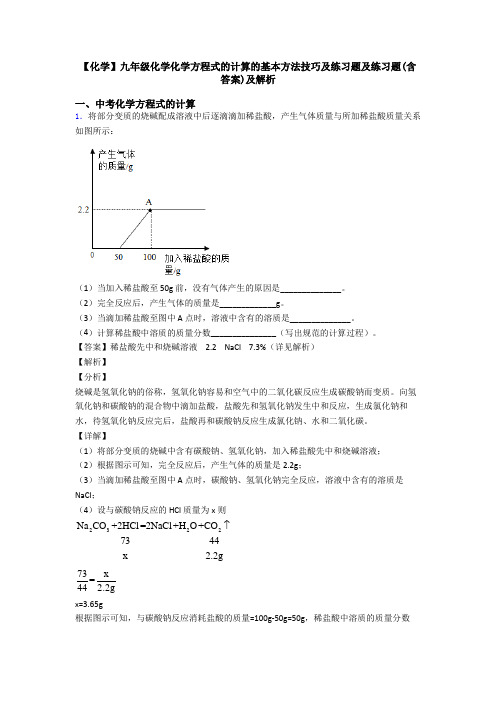
【化学】九年级化学化学方程式的计算的基本方法技巧及练习题及练习题(含答案)及解析一、中考化学方程式的计算1.将部分变质的烧碱配成溶液中后逐滴滴加稀盐酸,产生气体质量与所加稀盐酸质量关系如图所示:(1)当加入稀盐酸至 50g 前,没有气体产生的原因是______________。
(2)完全反应后,产生气体的质量是_____________g。
(3)当滴加稀盐酸至图中 A 点时,溶液中含有的溶质是______________。
(4)计算稀盐酸中溶质的质量分数_______________(写出规范的计算过程)。
【答案】稀盐酸先中和烧碱溶液 2.2 NaCl 7.3%(详见解析)【解析】【分析】烧碱是氢氧化钠的俗称,氢氧化钠容易和空气中的二氧化碳反应生成碳酸钠而变质。
向氢氧化钠和碳酸钠的混合物中滴加盐酸,盐酸先和氢氧化钠发生中和反应,生成氯化钠和水,待氢氧化钠反应完后,盐酸再和碳酸钠反应生成氯化钠、水和二氧化碳。
【详解】(1)将部分变质的烧碱中含有碳酸钠、氢氧化钠,加入稀盐酸先中和烧碱溶液;(2)根据图示可知,完全反应后,产生气体的质量是2.2g;(3)当滴加稀盐酸至图中 A 点时,碳酸钠、氢氧化钠完全反应,溶液中含有的溶质是NaCl;(4)设与碳酸钠反应的 HCl 质量为x则Na CO+2HCl=2NaCl+H O+CO23227344x 2.2g73x=44 2.2gx=3.65g根据图示可知,与碳酸钠反应消耗盐酸的质量=100g-50g=50g,稀盐酸中溶质的质量分数=3.65g100%=7.3%50g⨯。
答:稀盐酸中溶质的质量分数为7.3%。
2.碳酸氢钠用于焙制糕点,在270℃时分解:323222NaHCO Na C ΔO H O CO ++↑。
现取3NaHCO 16.8g ,在敞口容器中加热到质量不再改变为止,减少的质量为( ) A .4.4g B .6.2gC .8.8gD .10.6g【答案】B 【解析】 【分析】 【详解】根据题意可知,在敞口容器中加热到质量不再改变为止,剩余物质为固体碳酸钠。
九年级化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析

九年级化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析一、中考化学方程式的计算1.为测定某石灰石矿中碳酸钙的含量,进行了如下实验:称取10g石灰石样品,高温煅烧至质量不再改变,称得剩余固体质量为6.7g(假设杂质不参与反应)。
请计算:(1)反应生成的CO2的质量______________。
(2)该石灰石样品中碳酸钙的质量分数____________。
【答案】3.3g 75%【解析】【分析】【详解】(1)由质量守恒定律,反应生成的CO2的质量为10g-6.7g=3.3g,故填:3.3;(2)解:设该石灰石样品中碳酸钙的质量为x3222CaCO+2HCl=CaCl+H O+CO10044x 3.3g10044=x 3.3g↑x=7.5g该石灰石样品中碳酸钙的质量分数为7.5g10g×100%=75%答:该石灰石样品中碳酸钙的质量分数为75%。
2.向盛有100g质量分数为8%的氧氧化钠溶液的烧杯中,逐滴加入193.8g硫酸铜溶液,二者恰好完全反应。
请计算:(化学方程式为 CuSO4+ 2NaOH = Cu(OH)2↓+ Na2SO4)(1)恰好完全反应时生成沉淀的质量__________。
(2)恰好完全反应时溶液中溶质的质量分数__________。
【答案】9.8g 5%【解析】【分析】100g质量分数为8%的氧氧化钠溶液中溶质质量为:100g×8%=8g。
【详解】设恰好完全反应时,生成沉淀氢氧化铜质量为x,生成硫酸钠的质量为y。
42422NaOH+CuSO=Na SO+Cu(OH)80142988g y x8014298==8g y xx=9.8g,y=14.2g100g+193.8g-9.8g=284g恰好完全反应时溶液中溶质的质量分数14.2g100%=5% 284g⨯。
3.生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示:注:碳既不溶于水也不与稀盐酸发生反应。
(化学)九年级化学化学方程式的计算解题技巧和训练方法及练习题(含答案)含解析

(化学)九年级化学化学方程式的计算解题技巧和训练方法及练习题(含答案)含解析一、中考化学方程式的计算1.请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:计算稀盐酸中溶质质量。
【答案】7.3g【解析】【分析】【详解】根据质量守恒反应前后物质总质量不变可得二氧化碳的质量等于12g+100g+100g-207.6g=4.4g设稀盐酸中溶质质量为xCaCO2HCl=CaCl CO H O++↑+32227344x 4.4g73x=,x=7.3g44 4.4g答:稀盐酸中溶质质量7.3g【点睛】根据质量守恒,求出二氧化碳质量,根据二氧化碳质量求稀盐酸中溶质质量2.某校学习小组测定酸碱中和反应。
他们向50g 8%的氢氧化钠溶液中加入100g的稀盐酸恰好完全反应,此时溶液的pH=7。
请你计算,所得溶液溶质的质量分数是多少?【答案】3.9%【解析】【分析】氢氧化钠和盐酸发生中和反应,生成氯化钠和水。
【详解】解:设生成氯化钠的质量为x。
2NaOH +HCl=NaCl +H O4058.550g 8%x⨯ 4050g 8%=58.5xx=5.85g⨯ 所得溶液溶质的质量分数是 5.85g 100%=3.9%50g+100g⨯ 答:所得溶液溶质的质量分数是3.9%。
【点睛】本题考查的是溶液与化学方程式的综合计算,难度不算大,但要学会运用化学方程式先求出溶质的质量,再利用溶质质量分数计算公式进行解答。
3.工业上冶炼 150吨含杂质为 2%的生铁,需要含杂质 20%的赤铁矿石多少吨?【答案】262.5t【解析】【分析】【详解】解:设需要纯氧化铁的质量为 x232Fe O 2Fe +3CO 160112x 150t (1-2%)3CO+⨯高温 160x =112150t (12%)⨯- x=210t故需要含杂质为 20%的铁矿石的质量为:210t =262.5t 1-20%答:需要含杂质 20%赤铁矿石的质量为 262.5t 。4.为测定一瓶敞口放置的浓盐酸的溶质质量分数,某同学量取50g 的盐酸与大理石充分反应,共用去含碳酸钙80%的大理石12.5g 。
(化学)九年级化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析

(化学)九年级化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析一、中考化学方程式的计算1.欲测得某块大理石中所含碳酸钙的含量,现取该大理石加入到足量稀盐酸中(杂质不与稀盐酸反应),产生CO2的质量与稀盐酸的质量关系如图所示,请计算。
(1)该实验中最多制得CO2的质量为_____。
(2)该大理石中所含碳酸钙的质量_____(写出计算过程)。
【答案】8.8g 20g【解析】【分析】碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
【详解】(1)由图像可知,该实验中最多制得CO2的质量为8. 8g。
(2)设该大理石中碳酸钙的质量为xCaCO+2HCl=CaCl+H O+CO↑322210044x8.8g100x=448.8gx=20g答:大理石中所含碳酸钙的质量为20g。
2.某校学习小组测定酸碱中和反应。
他们向50g 8%的氢氧化钠溶液中加入100g的稀盐酸恰好完全反应,此时溶液PH=7。
请你帮他们计算:所用稀盐酸溶质的质量分数是多少?【答案】3.65%【解析】设盐酸溶液中氯化氢的质量为xNaOH + HCl == NaCl + H2O40 36.550g ×8% x4036.5=⨯g x508%x=3.65g稀盐酸溶质的质量分数=3.65g÷100g×100%=3.65%答:所用稀盐酸溶质的质量分数是3.65%3.取碳酸钙和硫酸钡的混合物15.0g于烧杯中,将150.0g的稀盐酸平均分成三次加入烧杯中,加入稀盐酸与烧杯中固体的质量关系如图所示,请完成下列问题:(1)该混合物中硫酸钡的质量为________g;(2)求恰好完全反应时所得溶液中溶质的质量分数______。
(结果精确到0.1%)【答案】5 10.5%【解析】【分析】【详解】(1)碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳。
而硫酸钡不能与稀盐酸反应。
所以最终剩余固体的质量是硫酸钡的质量。
故答案为:5;(2)由图分析可知,10g碳酸钙恰好和100g的盐酸反应。
【化学】初三化学《化学方程式》解题技巧及练习题含解析
【化学】初三化学《化学方程式》解题技巧及练习题含解析一、选择题1.下列是酒精被氧化,最终生成乙酸的过程。
下列说法正确的是( )A .甲、乙完全燃烧的产物不同B .转化②中乙和氧气的分子个数之比为2∶1C .转化①和转化②都是化合反应D .丙物质中碳元素的质量分数大于甲物质 【答案】B 【解析】 【详解】A 、甲乙均为有机物,完全燃烧的产物相同,故A 错误;B 、由反应的图示结合质量守恒定律可知,参加反应的两种物质分子个数之比为1:2,故B 正确;C 、根据反应图示可知,转化①不属于化合反应,故C 错误;D 、根据甲和丙的化学式,丙物质中碳元素的质量分数小于甲物质,故D 错误。
故选B 。
2.如图表示某个化学反应,据图分析判断,下列各项中,不正确的是A .该反应属于置换反应B .反应中乙、丙两物质质量比为2: 7C .图示中x 的数值为4D .反应前后氢元素的化合价发生了改变【答案】B 【解析】 【分析】由化学反应的微观模型图可知,该反应是在一定条件下氢气与四氯化硅(SiCl 4)反应生成了硅和氯化氢气体,反应的化学方程式为:42SiCl +2H Si+4HCl 一定条件,由方程式可知: 【详解】A 、该反应是一种单质和一种化合物反应生成了另一种单质和另一种化合物,属于置换反应,故A 正确;B 、反应中乙、丙两物质质量比就是氢气和硅的质量比为:(2×1×2):28=1:7,故B 不正确;C 、由方程式可知,图示中x 的数值为4,故C 正确;D 、由方程式可知,氢元素的化合价由0价变成了+1价,故D 正确。
故选B 。
3.长途运输鱼苗时,为了防止鱼苗缺氧,常在水中加入物质X ,发生反应的化学方程式为:2X+2H 2O=2Ca(OH)2+O 2↑,其中X 的化学式为 ( ) A .CaO B .CaO 2C .CaCO 3D .CaCl 2【答案】B 【解析】试题分析: 依据质量守恒定律可知:化学变化前后元素种类不变,每一种元素的原子个数不变;反应后Ca 、O 、H 的原子个数依次为:2、6、4,已知反应前O 、H 的原子个数分别为:2、4,则2X 中应含有Ca 、O 的原子个数分别为:2、4,则X 的化学式为CaO 2,故选B考点:质量守恒定律4.将CO 和CO 2的混合气体通入足量澄清的石灰水中,生成沉淀的质量与原混合气体的质量相等,则原混合气体中CO 和CO 2的质量比为 A .14:11 B .11:14C .11:7D .7:11【答案】A 【解析】 【分析】根据反应方程式:Ca (OH )2+CO 2═CaCO 3↓+H 2O ,分别设出CO 和CO 2的质量,利用生成的沉淀质量恰好等于原混合气体的质量的关系,列出等式,进行解答。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【解析】
【分析】
【详解】
(1)过氧化钙中氧元素的质量分数为:
32 100% 44.4% 40+32
(2)解:设理论上可以制得氧气的质量为 X。
2CaO2 +2H2O=2Ca(OH)2+O 2
144
32
150g 96%
X
144 150g 96%
=
32
X
X=32g
答:理论上可以制得氧气的质量为 32 g。
请回答 : (1)用质量分数为 30%的浓盐酸配制 10%的稀盐酸 100g,需要水 ________________g (结果精 确到 0.1)。 (2)当 a 为 160g 时,消耗盐酸多少克 ?_______________ 【答案】 66.7g 73g
【解析】 【分析】 【详解】 设需要水的质量为 x。 (100g-x)× 30%=100g× 10%
7. 为检测市场销售的小苏打 (主要成分是碳酸氢钠 )的含量,取 5.0g 样品加热到质量不再减
少为止,收集到干燥的气体 0.88g。(碳酸氢钠受热分解的化学方程式为: 2NaHCO3= Na2CO3 +H2O+ CO2↑,杂质不参加反应 )。求该样品中碳酸氢钠的质量分数。 _____ 【答案】 67.2%
80 98
142
80gx 9.8g
y
80gx y 9.8g ==
80 142 98
x=10%, y=14.2g,
(3)往上述 80g 废水中逐渐加入稀硫酸至过量,加入硫酸之前,硫酸钠为
0,所以七点为
0,至加入硫酸溶液 100g,硫酸钠质量达到最大为 14.2g,之后不再变化, Na2SO4 质量随加
CaO + CO2
100
44
m
22t
100 m
44 22t
m=50t
碳酸钙质量
50t
石灰石中碳酸钙质量分数 =
100%=
100%=50%
石灰石质量
100t
答:石灰石中碳酸钙的质量分数为 50%。
9. 用质量分数为 5%的氢氧化钠溶液中和 10%的稀盐酸,反应过程中溶液的酸碱度变化如 图 25 所示。
2NaOH + H 2SO4 = Na 2SO4 + 2H 2O
80
98
25g 20% x
80 25g 20%
98
x
x=6.125g 稀硫酸中溶质的质量分数为:
6.125g 100% 30.6%
20g
答:稀硫酸中溶质的质量分数为 30.6%。
4. 过氧化钙( CaO2)常用于活鱼运输时的增氧剂,过氧化钙与水反应方程式为: 2CaO2+2H2O═2Ca( OH) 2+O2↑.某过氧化钙样品中含有少量不溶于水且不与水反应杂 质,取该样品 15.0g 投入盛有 108.0g 水的烧杯中,缓慢搅拌,充分反应,最终收集到氧气 质量为 3.20g,计算该样品中过氧化钙的质量分数 ____(写出计算过程)。 【答案】 96% 【解析】 【分析】 【详解】 解:设过氧化钙质量为 x,
【详解】
解:理论上可制得铁的质量为 x。
高温
2Al+ Fe2O3 = Al 2O3 + 2Fe
160
112
48kg
x
160 48kg =
112 x
x=33.6kg 答:用足量铝与 48 kg 氧化铁反应,理论上可制得铁的质量是
33.6kg。
2. 铝被称为“年轻的金属”,工业上用电解氧化铝的方法制取金属铝。反应的化学方程式
入稀硫酸质量变化的曲线如图:
;
(4)设若工厂每天需处理上述废水 8 吨,需要的 98%硫酸的质量为 a,需要的 30%的盐酸的
质量为 b,根据化学方程式 NaOH+HCl=NaCl+H2O,2NaOH+H2SO4=Na2SO4+2H2O 可得:
2HCl 2NaOH H 2SO4
73 80
98
b 8t 10% 98%a
6. 某化学实验室用稀硫酸处理含有氢氧化钠的废水。现取废水样品
80g 倒入烧杯中,加入
几滴无色酚酞溶液,然后逐滴加入 9.8%的稀硫酸,反应过程中溶液的 pH 变化如图所示。
(1)当恰好完全反应时,溶液的颜色变化是 ____________。 (2)求废水中氢氧化钠的质量分数 _______ (写出计算过程 )。 (3)往上述 80g 废水中逐渐加入稀硫酸至过量,请在答题卡中画出 质量变化的曲线 _______。 (4)下表为市面上浓硫酸和浓盐酸的有关数据 :
通电
为 2Al2O3
4Al+ 3O2↑。请计算生成 1.08t 金属铝,理论上需要氧化铝的质量是多少
____?
【答案】 2.04t
【解析】
【分析】
【详解】
解:设生成 1.08t 金属铝,理论上需要氧化铝的质量为 x
通电
2Al 2O3
4Al +3O 2
204
108
x
1.08t
204 x =
108 1.08t
98%a b 8t 10% ==
98 73 80
a=1t, b=0.73t , 所用硫酸的价值为 1t ×1000kg/t ×0元.6 /kg=600 元,所用盐酸的价值为
0.73t ×1000kg/t ×0元.4
/kg=292 元,若工厂每天需处理上述废水 8 吨,选用 浓盐酸更合算,每天可节约 600 元 292 元 =308 元。 【点睛】 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算 过程要完整。
(4)配制 100g 该浓度的稀硫酸需要质量分数为 98%浓硫酸的质量是多少 ____?
【答案】 Cu 17.4 44% 9.8% 10g
【解析】
【详解】
(1)由金属活动性可知,合金中只有锌可以与硫酸反应;由表中的数据可知:第
4 次再加
入 40g 稀硫酸时。第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应;
8. 将 100t 的石灰石高温条件下煅烧使其完全分解,剩余固体质量是
78t,求 : 石灰石中碳
酸钙的质量分数。 _________
【答案】 50%
【解析】
【分析】
【详解】
根据质量守恒定律,固体减少的质量为生成二氧化碳质量,所以生成二氧化碳质量
=100t-
78t=22t 。设碳酸钙质量为 m,
高温
CaCO3
【化学】初三化学化学方程式的计算解题技巧讲解及练习题 ( 含答案 ) 及解析
一、中考化学方程式的计算
1. 高铁快速发展方便了人们的出行。工业上可利用铝和氧化铁在高温下发生置换反应制得
铁来焊接钢轨。若用足量铝与 48 kg 氧化铁反应,理论上可制得铁的质量是多少?
【答案】 33.6kg
【解析】
【分析】
20g
(3)设 40g 稀硫酸中硫酸的质量为 X,
H 2SO4 +Zn = ZnSO4 +H 2 98 65 X 2.6g
X 98 =,
2.6g 65
X=3.92g,
3.92g
稀硫酸中硫酸的质量分数 =
×100%=9.8%;
40g
(4)设需要质量分数为 98%浓硫酸的质量为 Y,则: 100g×9.8%=Y×98%,Y=10g。
HCl 的质量为 y。
10. Cu 与 Zn 的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化
学兴趣小组的同学为了测定某黄铜的组成,取
20g 该黄铜样品于烧杯中,向其中分 5 次加
入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量
记录于下表:
加入稀硫酸的质量( g)
______。
【答案】 Na2SO4、 NaOH 30.6% 【解析】
【分析】 【详解】
(1)氢氧化钠和硫酸反应生成硫酸钠和水,反应后的溶液中一定有硫酸钠,可能有氢氧化
钠或硫酸,在 a 点 pH 大于 7,所以氢氧化钠过量,在溶液中的溶质有: (2)设 20g 稀硫酸中溶质的质量为 x
Na2SO4、 NaOH;
充分反应后剩次
40
14.8
第 3次
40
12.2
第 4次
40
11.2
第 5次
40
11.2
试回答下列问题: (1)从以上数据可知,最后剩余的 11.2g 固体的成分是 ______;表格中, m=______。 (2)黄铜样品中锌的质量分数为 ______。 (3)计算所用稀硫酸中硫酸的质量分数是多少 ____?
x≈ 66.7g 答:需要水的质量为 66.7g。 (2)设氢氧化钠和盐酸恰好完全反应时,消耗
NaOH
HCl = NaCl
40
36.5
160g 5% x
40
36.5
=
160g 5% x
H 2O
y=7.3g 消耗稀盐酸的质量为: 7.3g÷ 10%=73g 答:当 a 为 160g 时所消耗稀盐酸 73g。 故答案为: (1) 66.7; (2) 73g。
x=2.04t 答:生成 1.08t 金属铝,理论上需要氧化铝的质量为
2.04t 。
3. 为测定某未知浓度的稀硫酸溶液的溶质质量分数,取
20g 该稀硫酸溶液,逐滴加入 20%
氢氧化钠溶液 30g,同时用 pH 计测定并记录反应过程中混合溶液 pH 变化情况。请回答下
列问题。
(1) a 点溶液中的溶质的化学式是 ______。 (2)通过计算求出稀硫酸中溶质的质量分数(计算过程中保留一位小数)
物质
纯度 价格 (元 /kg)
