吸光光度分析tang10
紫外可见分光光度法基本原理PPT讲稿

E=h=hc/
(Planck常数:h=6.626 × 10 -34 J × S ) 光的波长越短(频率越高),其能量越大。 白光(太阳光):由各种单色光组成的复合光 单色光:单波长的光(由具有相同能量的光子组成) 可见光区:400-750 nm 紫外光区:近紫外区200 - 400 nm
生的吸收光谱在紫外—可见光区,称为紫外—可见光谱或分子的 电子光谱。
讨论:
(4)吸收光谱的波长分布是由产生谱带的跃迁能级间的 能量差所决定,反映了分子内部能级分布状况,是物质定性 的依据。 (5)吸收谱带强度与分子偶极矩变化、跃迁几率有关, 也提供分子结构的信息。通常将在最大吸收波长处测得的摩 尔吸光系数εmax也作为定性的依据。不同物质的λmax有时可能 相同,但εmax不一定相同; (6)吸收谱带强度与该物质分子吸收的光子数成正比, 这是定量分析的依据。
* σ σ* (150~210nm)
H
* n σ* (259nm)
HCI
H
(2)不饱和脂肪烃
• 这类化合物有孤立双键的烯烃(如乙烯)和共轭双键的烯
烃(如丁二烯),它们含有π键电子,吸收能量后产生
π→π*跃迁。乙烯(孤立双键)的
m
a
为171nm(
x
=
15530 L mol1 cm1 );而丁二烯H(2C CH CH CH2 )
列吸收带,称为精细结构吸收带,亦称为B吸收带[从德文 Benzenoid(苯的)得名],这是由于跃迁和苯环的振动的重叠引起的。B 吸收带的精细结构常用来辨认芳香族化合物。 苯环与生色团连结时,有B和K两种吸收带,有时还有R吸收带,其中 R吸收带的波长最长 。
生色团与助色团
生色团(Chromophore): 最有用的紫外—可见光谱是由π→π*和n→π*跃迁产生
火焰原子吸收光谱测定葡萄糖酸锌口服液中锌含量

大 学 化 学Univ. Chem. 2024, 39 (1), 142收稿:2023-06-27;录用:2023-07-11;网络发表:2023-07-19 *通讯作者,Email:*******************•化学实验•doi: 10.3866/PKU.DXHX202306056火焰原子吸收光谱测定葡萄糖酸锌口服液中锌含量许锦帆1,朱信宇1,杨科1,杨尔文1,赵之翰1,陈秋同1,李泓毅1,程晋凯1, 孙一骏1,王京1,3,陈朗星1,2,唐安娜1,2,*1南开大学化学学院,天津 3000712南开大学分析科学研究中心,天津市生物传感与分子识别重点实验室,天津 3000713南开大学化学国家级实验教学示范中心,天津300071摘要:“火焰原子吸收光谱”是本科生仪器分析实验教学中的重要实验之一。
原子吸收光谱用于实际样品中某一特定元素的定量测定,具有测定准确度高、精密度高和选择性好等优点。
葡萄糖酸锌口服液是生活中常见的口服补锌类非处方药,通过本科生自主实验,建立火焰原子吸收实验方法,测定葡萄糖酸锌口服液中锌含量,方法简便、易于操作。
通过该自主实验,培养学生利用课堂所学理论知识解决实际问题的能力,实现“学以致用,用以促学”的育人目标。
关键词:自主实验;原子吸收光谱;锌含量 中图分类号:G64;O6Determination of Zinc Content in Zinc Gluconate Oral Solution by Flame Atomic Absorption SpectrometryJinfan Xu 1, Xinyu Zhu 1, Ke Yang 1, Erwen Yang 1, Zhihan Zhao 1, Qiutong Chen 1, Hongyi Li 1, Jinkai Cheng 1, Yijun Sun 1, Jing Wang 1,3, Langxing Chen 1,2, Anna Tang 1,2,*1College of Chemistry, Nankai University, Tianjin 300071, China.2 Tianjin Key Laboratory of Biosensing and Molecular Recognition, Research Center for Analytical Sciences, Nankai University, Tianjin 300071, China.3 National Demonstration Center for Experimental Chemistry Education, Nankai University, Tianjin 300071, China.Abstract: Flame atomic absorption spectrometry (FAAS) is an important experiment in instrumental analysis laboratory teaching for undergraduates. Atomic absorption spectroscopy (AAS) is used to quantitatively determine a specific element in real samples, which has the advantages of high accuracy, precision, and selectivity. Zinc gluconate oral solution is a common over-the-counter zinc supplement in daily life. Through independent experiments of undergraduates, a simple and easy-to-operate FAAS method is established to determine the zinc content in zinc gluconate oral solution. This experiment aims to cultivate students’ ability to apply theoretical knowledge learned in class to solve practical problems, and achieve the educational goal of “learning for application, and application to promote learning”.Key Words: Independent experiment; Atomic absorption spectrometry; Zinc content1 自主实验选题南开大学实验教学中心积极鼓励本科生开展自主实验,培养学生在基础仪器分析实验教学的基础上进行深度学习;提高学生的创新性意识、自主能动性和积极性;培养学生将理论知识与实际应用相结合,解决生活中一些实际问题的能力[1]。
《分析化学》试题及答案

一、选择题(20分。
1.用法扬司法测Cl 时,常加入糊精,其作用是--------------------------(B )A. 掩蔽干扰离子;B. 防止AgCl凝聚;C. 防止AgCl沉淀转化D. 防止AgCl感光2.间接碘量法中正确使用淀粉指示剂的做法是----------------------------(D )A. 滴定开始时加入指示剂;B. 为使指示剂变色灵敏,应适当加热;C. 指示剂须终点时加入;D. 指示剂必须在接近终点时加入。
3.螯合剂二乙三氨五乙酸(EDPA,用H5L表示)的五个p K a值分别为1.94,2.87,4.37,8.69和10.56,溶液中组分HL4-的浓度最大时,溶液的pH值为------( D )A. 1.94;B. 2.87;C. 5.00;D. 9.62。
4. K2Cr2O7法测定铁时,哪一项与加入H2SO4-H3PO4的作用无关----------( C )A.提供必要的酸度;B.掩蔽Fe3+;C.提高E(Fe3+/Fe2+);D.降低E(Fe3+/Fe2+)。
5.用BaSO4重量分析法测定Ba2+时,若溶液中还存在少量Ca2+、Na+、CO32-、Cl-、H+和OH-等离子,则沉淀BaSO4表面吸附杂质为------------------------------( A )A. SO42-和Ca2+;B. Ba2+和CO32-;C. CO32-和Ca2+;D. H+和OH-。
6.下列各条件中何者不是晶形沉淀所要求的沉淀条件---------------------(A )A.沉淀作用宜在较浓溶液中进行;B.应在不断的搅拌下加入沉淀剂;C.沉淀作用宜在热溶液中进行;D.应进行沉淀的陈化。
7.为了获得纯净而易过滤、洗涤的晶形沉淀,要求----------------------(A )A.沉淀时的聚集速度小而定向速度大;B.沉淀时的聚集速度大而定向速度小;C.溶液的过饱和程度要大;D.沉淀的溶解度要小。
紫外―可见分光光度计在药品检测中的应用[权威资料]
![紫外―可见分光光度计在药品检测中的应用[权威资料]](https://img.taocdn.com/s3/m/7b87624a814d2b160b4e767f5acfa1c7aa008294.png)
紫外―可见分光光度计在药品检测中的应用药品分析是保证药品安全有效的重要手段,在药品的研究、生产、流通、使用和监督管理等环节中均有举足轻重的作用,其主要内容包括性状分析、鉴别、检查和含量测定等方面。
高效液相色谱仪、气相色谱仪、紫外分光光度计等是制药生产中常用的检测仪器。
其中,紫外分光光度计由于准确度高、测定限度低、设备简便、仪器成本低、易于操作等优点,已成为制药生产中必备的检测设备之一,用于药物鉴别、检查和含量测定等。
紫外-可见分光光度法是通过测定物质在紫外-可见光区(200-760nm)产生紫外-可见吸收光谱,根据吸收光谱的特性,对该物质进行定性和定量分析的方法。
其理论基础为朗伯-比耳定律,溶液的吸光度和吸光物质含量、液层厚度乘积成正比。
对于一般的紫外分光光度法,其测量的相对误差在1%~3%。
随着大量心得显色剂的合成及应用,尤其是有关多元络合物和各种表面活性剂的应用研究,推进了元素测定的灵敏度的大幅提高。
采用预富集和示差法,适用质量分数从常量(1%~50%)到痕量(10-10~10-8)。
紫外-可见分光光度法由紫外分光光度法和可见分光光度法两种方法构成,这两种方法在测定的原理、仪器、操作等方面皆相同。
因此,统称为紫外-可见分光光度法,测定仪器一般采用紫外-可见分光光度仪。
在各国药典中,药品的理化常数、鉴别、检查和含量测定等很多项目中,都能见到紫外分光光度法的应用实例。
在制药生产中,紫外分光光度法应用最多的是药物含量的测定、药物杂质检测、药物稳定性考察、释放度、药物负载行为测定及物质结构鉴定等方面。
目前利用紫外分光光度计分析的药物品种有维生素、抗生素、解热药、去痛药、降血压药、安定药、镇咳药、滴眼药、磺胺类药、利尿药、某些妇科药、痢疾药、腹泻药、抗肿瘤药、抗结核药等。
1 紫外分光光度法应用于药物含量测定紫外-可见分光光度法由于灵敏度较高,不仅可用于常量组分的含量测定,也可用于测定微量组分、超微量组分以及多组分混合物同时测定等,在药物分析中主要用于原料药含量测定、制剂含量测定、含量均匀度和溶出度的检查等。
分析检验技术复习题11

1.滴定分析的相对误差一般要求为±0.1%,滴定时消耗用标准溶液的体积应控制在( )。
A .10mL 以下B .15~20mLC .20~30mLD .40~50mL2.已知在1mol/LH 2SO 4溶液中,Ce 4+/Ce 3+和 Fe 3+/Fe 2+电对的条件电极电位分别为1.44V 和 0.68V 。
在此条件下用 Ce 4+标准溶液滴定Fe 2+,其化学计量点的电位值为( )。
A .0.73VB .1.06VC .1.32VD .1.49V3.能使沉淀溶解度减小的有( )。
A .同离子效应B .盐效应C .酸效应D .配位效应4.在吸光光度法中,透过光强度和入射光强度之比,称为( )。
A .吸光度B .透光度C .吸收波长D .吸光系数5.下列操作中正确的是( )。
A .比色皿外壁有水珠B .手捏比色皿的磨光面C .手捏比色皿的毛面D .用报纸去擦比色皿外壁的水6.用同一高锰酸钾溶液分别滴定体积相等的FeSO 4和H 2C 2O 4溶液,若消耗高锰酸钾溶液的体积相等,则两溶液浓度( )。
A . c = c 4224O C H FeSOB . 2c = c 4224OC H FeSO C .4422FeSO O C H 2c c =D .4422FeSO O C H 4c c = 7.将称好的基准物质倒入湿烧杯,对分析结果产生的影响是( )。
A .正误差B .负误差C .无影响D .不能滴定8.现要用EDTA 滴定法测定水样中Ca 2+的含量,则用于标定EDTA 的基准物质应为( )。
A .Pb(NO 3)2B .Na 2CO 3C .ZnD .CaCO 39.应用佛尔哈德法测定Cl -时,若没有加入硝基苯,则测定结果将会( )A .偏高B .偏低C .无影响D .难预测10.KCl 溶液的浓度增加,25℃时甘汞电极的电极电势( )。
A .增加B .减小C .不变D .不能确定11.有色溶液,当用1cm 比色皿时,其透光率为T ,若改用2cm 比色皿时,则透光率为 ( )。
第9章吸光光度法(2)。

60nm
二、 显色条件的选择
吸光光度法是测定待测物质的吸光度或显色 反应平衡后溶液的吸光度,因此为了得到准确的 结果,必须控制适当的条件,使显色反应完全和 稳定。
显色条件包括: 溶液酸度,显色剂用量,显 色时间,显色温度,有机络合物的稳定性及共存 离子的干扰等。
1、溶液酸度(pH值及缓冲溶液)
在相同条件下测的试液的吸光度, 从工作曲线上就可查到试液的浓 度, 该方法称为工作曲线法。 注意什么? a. 标准溶液浓度必须在线性范围内,即符合A= bc
b. 试液的吸光度必须在标准曲线范围内,即A1≤ Ax ≤An
五、光度分析法的误差(准确度)
对朗伯-比尔定律的偏离
在实际分析中,常会发现标准曲线发生弯曲,尤其当溶液
2.有机显色剂
有机显色剂分子中含有某些含不饱和键的基 团如偶氮基、对醌基和羰基等生色团( chromophoric group)和含孤对电子的基团如氨 基 、 羟 基 和 卤 代 基 等 助 色 团 ( auxochrome group)。
生色团:-N=N-,-N=O,
O
C=S,-N
(共轭双键)πe
为避免铁的干扰,可以选择波 长 520 nm进行测定,虽然而测镍的 灵敏度有所降低,但酒石酸铁不干 扰镍的测定。
二、参比溶液的选择
为什么要使用参比溶液? 目的:扣除非待测组分(吸收池和各种试剂)对光的吸收, 使测得的的吸光度真正反映待测物对光的吸收。
测定时,采用两个材质、厚度相同的比色皿进行测量,其中 一个作为参比池,装入参比溶液,调节仪器使透过参比池的吸光 度为零。则测得待测溶液的吸光度为:
显色剂的用量来消除干扰。 g. 采用预先分离的方法。
三、三元配合物在光度分析中的应用特性简介(自学)
吸光光度法 PPT

T It I0
朗伯(Lambert J H)与比尔(Beer A)分别于 1760与1852年研究了光的吸收与溶液层的厚 度及溶液浓度的定量关系,二者结合称为朗伯比尔定律,也称为光的吸收定律。
光栅(grating)是依照光的衍射与干涉原理将复 合光色散为不同波长的单色光,然后再让所需波 长的光通过狭缝照射到吸收池上。它的分辨率 比棱镜大,可用的波长范围也较宽。
3、吸收系统——比色皿或吸收池
用于盛放试液的容器。它是由无色透明、耐腐 蚀、化学性质相同、厚度相等的玻璃制成的,按 其厚度分为0、5cm,lcm,2cm,3cm与5cm。
• 偏离朗伯-比尔定律的原
因主要是仪器或溶液的实际
条件与朗伯—比尔定律所要
求的理想条件不一致。
1、物理因素
(1)非单色光引起的偏离
* 朗伯-比尔定律只适用于单色光,但由于单色器
色散能力的限制与出口狭缝需要保持一定的宽度, 因此目前各种分光光度计得到的入射光实际上都 是具有某一波段的复合光。由于物质对不同波长 光的吸收程度的不同,因而导致对朗伯-比尔定ຫໍສະໝຸດ * 分子吸收光谱 -带状光谱
molecular absorption spectrum →由电子能级跃迁而产生吸收光谱[能量差
在1~20(eV)],为紫外及可见分光光度法。
UV/Vis Spectrophotometry →由分子振动能级(能量差约0、05~l eV)与
转动能级(能量差小于0、05 eV)的跃迁而 产生的吸收光谱,为红外吸收光谱。用于 分子结构的研究。
B 络合:显色剂与金属离子生成的是多级络合物,且各 级络合物对光的吸收性质不同,例如在Fe(Ⅲ) 与 SCN-的络合物中,Fe(SCN)3颜色最深,Fe(SCN)2+颜 色最浅,故SCN-浓度越大,溶液颜色越深,即吸光度 越大。
仪器分析试题及答案(完整版)
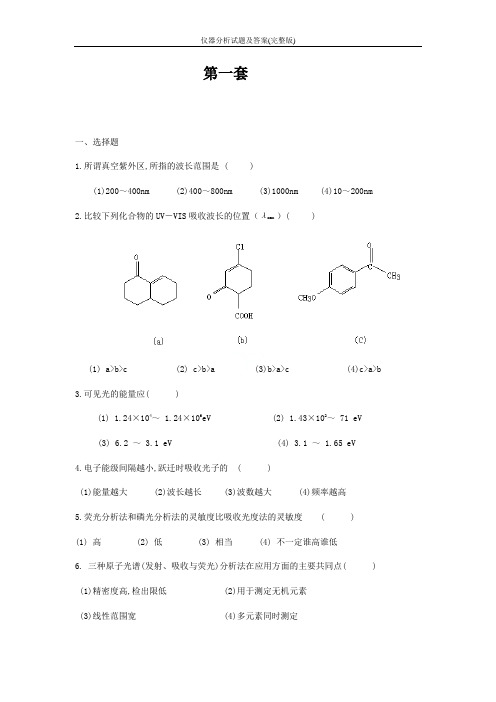
第一套一、选择题1.所谓真空紫外区,所指的波长范围是 ( )(1)200~400nm (2)400~800nm (3)1000nm (4)10~200nm2.比较下列化合物的UV-VIS吸收波长的位置(λmax )( )(1) a>b>c (2) c>b>a (3)b>a>c (4)c>a>b 3.可见光的能量应( )(1) 1.24×104~ 1.24×106eV (2) 1.43×102~ 71 eV(3) 6.2 ~ 3.1 eV (4) 3.1 ~ 1.65 eV4.电子能级间隔越小,跃迁时吸收光子的 ( )(1)能量越大 (2)波长越长 (3)波数越大 (4)频率越高5.荧光分析法和磷光分析法的灵敏度比吸收光度法的灵敏度 ( )(1) 高 (2) 低 (3) 相当 (4) 不一定谁高谁低6. 三种原子光谱(发射、吸收与荧光)分析法在应用方面的主要共同点( ) (1)精密度高,检出限低 (2)用于测定无机元素(3)线性范围宽 (4)多元素同时测定7.当弹簧的力常数增加一倍时,其振动频率 ( )(1) 增加倍 (2) 减少倍 (3) 增加0.41倍 (4) 增加1倍8. 请回答下列化合物中哪个吸收峰的频率最高? ( )9.下列化合物的1HNMR谱, 各组峰全是单峰的是 ( )(1) CH3-OOC-CH2CH3 (2) (CH3)2CH-O-CH(CH3)2(3) CH3-OOC-CH2-COO-CH3 (4) CH3CH2-OOC-CH2CH2-COO-CH2CH310. 某化合物的相对分子质量M r=72,红外光谱指出,该化合物含羰基,则该化合物可能的分子式为 ( )(1) C4H8O (2) C3H4O2 (3) C3H6NO (4) (1)或(2)11.物质的紫外-可见吸收光谱的产生是由于 ( )(1) 分子的振动 (2) 分子的转动(3) 原子核外层电子的跃迁 (4) 原子核内层电子的跃迁12. 磁各向异性效应是通过下列哪一个因素起作用的( )(1) 空间感应磁场 (2) 成键电子的传递 (3) 自旋偶合 (4) 氢键13.外磁场强度增大时,质子从低能级跃迁至高能级所需的能量 ( )(1) 变大 (2) 变小 (3) 逐渐变小 (4) 不变化14. 某化合物在一个具有固定狭峰位置和恒定磁场强度B的质谱仪中分析, 当加速电压V慢慢地增加时, 则首先通过狭峰的是: ( )(1) 质量最小的正离子 (2) 质量最大的负离子(3) 质荷比最低的正离子(4) 质荷比最高的正离子15.某化合物Cl-CH2-CH2-CH2-Cl的1HNMR谱图上为 ( )(1) 1个单峰 (2) 3个单峰(3) 2组峰: 1个为单峰, 1个为二重峰 (4) 2组峰: 1个为三重峰, 1个为五重峰二、填空题1. 核磁共振的化学位移是由于 _______________________________________ 而造成的,化学位移值是以 _________________________________为相对标准制定出来的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节 基本原理
一、光的本质与溶液的颜色 二、光的吸收定律 三、吸收光谱曲线
一、光的本质与溶液的颜色
表11-1 电磁波谱
区域
波长范围
x射线 10-3~10(nm)
跃迁类型 内层电子跃迁
远紫外 10~200(nm) 价电子和非键电子
紫外 200~400(nm)
跃迁
光谱类型
x射线吸收、发射、衍射,荧光光谱、 光电子能谱
可表述为:当一束平行的单色光通过均匀、无 散射的溶液时,在单色光强度和溶液温度等条 件不变的情况下,溶液的吸光度正比于溶液浓 度与液层厚度的乘积。
上述的k1、k2、ɑ均为比例常数,又称为吸光 系数,它表示物质对光的吸收能力。
3.吸光系数与摩尔吸光系数
(1)当溶液浓度c的量纲为gL-1时,则吸光系数 ɑ的量纲为Lg-1cm-1。
(2)当溶液浓度c的量纲为molL-1时,比例常数 ɑ改用符号ε表示,称为摩尔吸光系数,量纲为 Lmol-1cm-1,朗伯-比尔定律表示为:
A=εbc
(11-7)
ɑ和ε可以通过下式换算:
ε=ɑM
(11-8)
式中:M为吸光物质的摩尔质量。
三、吸收光谱曲线
吸收光谱曲线又称吸收曲线,它是溶液吸光度随入射 光波长变化的曲线。
(3)吸收池 吸收池又称比色杯或比色皿,它是由无色透明的耐腐 蚀玻璃制成,用来盛放被测溶液和参比溶液。每台仪器通常配有厚度 为0.5cm、1.0cm、2.0cm、3.0cm、5.0cm等规格的吸收池供选用。
(4)检测器 分光光度计常用的检测器是光电管或光电倍增管,光 电管是一个二极管,管内装有一个阳极和一个光敏阴极
远紫外吸收光谱,光电子能谱 紫外-可见吸收和发射光谱
可见光 400~750(nm)
近红外 0.75~2.5(μm)
分子振动
近红外吸收光谱
红外 2.5~1000(μm)
分子振动
红外吸收光谱
微波 0.1~100(cm) 分子转动、电子自 旋
微波光谱,电子顺磁共振
各种色光的近似波长范围
光的颜色 红色 橙色 黄色 绿色
操作简便;
缺点是标准色阶不易保存,常需临时配制。主 观误差较大。
二、可见分光光度法
可见分光光度法是以钨丝灯发出的光作光源,灯光 经单色器色散,取所需波长的单色光通过被测溶液,测 得溶液的吸光度,然后进行分析的方法。
图11-4 721型分光光度计结构示意图 1.光源 2.透镜 3.反光镜 4.狭缝 5.准光镜 6.棱镜 7.吸收池 8.光门
图11–2 不同浓度KMnO4溶液的吸收曲线
第三节 分析方法
一 目视比色法
1 目视比色法原理来自目视比色法的理论依据是朗伯-比尔定
律。当日光透过组成相同的两个有色溶液时,
如果液层的厚度相等,则颜色深浅相同(吸
光度相等)的溶液浓度相等。
2.目视比色法的测定方法
测定时将标准溶液按照由少至多的顺序依次加入到 一套(6~10个)比色管中,加入等量的显色剂,加水 稀释至刻度,摇匀可得一系列颜色由浅至深的标准色 阶。另取一比色管,加入一定量的试液,在相同条件 下显色并稀释至刻度。将该比色管与标准色阶进行比 较,根据颜色相同,浓度相同的原理,可求得试液的 浓度。
(5)显示器 显示器的作用是把放大的讯号以适当的方法显示或记 录下来,721型分光光度计的显示器是指针式的微安电表,在微安电 表的标尺上刻有透光率和吸光度两种刻度,
第四节 溶液浓度的测定方法
一、标准曲线法 二、比较法
(1)灵敏者度高 可用于测定微量组分的含 量,测定下限可达10-5-10-6mol·L-1。
(2)准确度较高 比色法的相对误差为5%20%,分光光度法的相对误差为2%-5%。
(3)简便快速 吸光光度法所使用的仪器设 备简单,价格便宜,一般实验室都能具备。
(4)应用范围广 几乎所有的无机离子和有 机化合物都可直接或间接的用分光光度法进行 测定。
(1)溶液对不同波长光的吸收有选择性。 (2)同一溶液不同浓度的吸收曲线形状相似,
(3)在最大吸收波长附近(不一定在λmax处), 即使浓度较低时,吸光度A也有较大的数值。
物质对光的吸收程度可用最大吸收波长下 的摩尔吸光系数εmax表示。 εmax <104,测定的灵敏度低;104<εmax <5104属中等灵敏度; 5104<εmax <105属高灵敏度;εmax >106 属超高灵敏度。
第十一章 吸光光度法
§11.1 吸光光度法概述
吸光光度法是光学分析法的一种,也称为吸收 光谱法。它是基于物质对光的选择性吸收而建 立起来的分析方法。
吸光光度法分类: 比色法、可见光分光光度法、紫外分光光
度法、红外光谱法和原子吸收分光光度法。 吸光光度法意义:定性、定量分析
吸光光度法的特点
9.保护玻璃 10.光电管
分光光度计主要由光源、单色器、吸收池、 检测器、显示器等五个部件构成。
(1)光源 以6~12V的钨丝灯作光源,单色光的波长范围为360~ 800nm。
(2)单色器 单色器的作用是将钨丝灯发出的复合光分解为单色光。 单色器由入射狭缝、色散元件(棱镜或光栅)、准光镜和出光狭缝组 成。
二、光的吸收定律
1.透光率T 和吸光度A
I0=Ia+It (11-1)
I0为入射光的强度,Ia为吸收光的强度,It为透过光的 强度。
T%=
It ×100
I0
A=1g
1 T
=-1gT
=1g
I0 It
2.光的吸收定律——朗伯-比尔定律
朗伯定律 A=k1b (11-4) 比尔定律 A=k2c (11-5) 朗伯-比尔定律 A=ɑbc (11-6)
波长范围 (nm) 610~780 595~610 560~595 500~560
光的颜 色 青色 蓝色 紫色
波长范围 (nm) 480~500 435~480
400~435
可见色光的互补性
不同物质对各种波长光的吸收具有选择性
该溶液对该波长范围的光都不吸收,则溶液 无色透明。 如果溶液选择性的吸收了某种颜色的光,则 溶液将呈现出它的互补色 。 如: 高锰酸钾溶液因吸收了绿色光而呈现紫色, 氯化钠溶液让日光全部透过而呈无色透明。
