价键理论
价键理论

价键理论自1916年路易斯提出经典的共价键理论以来,共价键理论有了很大的发展。
现代共价键理论有两种,一是价键理论,二是分子轨道理论。
(一)价键理论的基本要点价键理论,又称电子配对法,其基本要点如下:1.具有自旋相反的未成对电子的两个原子相互接近,可以形成稳定的共价键。
如果A、B两个原子各有一个自旋相反的未成对的电子,那么这两个未成对电子可以相互配对形成稳定的共价键,这对电子为A、B两原子所共有(共用)。
如果A、B各有两个或三个未成对的电子,则自旋相反的单电子可两两配对形成双键或叁键。
如果A原子有两个未成对电子,B原子有一个未成对电子,那么一个A原子能与两个B原子结合形成AB2型分子,…。
2.原子中未成对的电子数等于原子所能形成的共价键数目(共价键的饱和性)。
共价键是由成键原子中自旋相反的未成对电子配对形成的。
一个原子的一个电子和另一个原子的一个电子配对以后,不能再和第二个电子配对。
因为这时其中必有两个电子的自旋方向相同而相斥。
也就是说一个原子所能形成共价键的数目是一定的。
原子中未成对的电子数等于原子所能形成的共价键数目,这就是共键价的饱和性。
例如,H原子只有一个未成对电子,它和另一个H原子的未成对电子配对后,就不能再与第二个H原子的电子配对了,……。
3.成键电子的电子云重叠越多,核间电子子云密度就越大,形成的共价键就越牢固(共价健的方向性)。
共价键的生成是由于自旋相反的单电子相互配对,电子云重叠的结果。
因此,当两个原子形成分子时,电子云重叠的程度越大,则两原子间的电子云密度越大,生成的共价键就越牢固,所以,在形成共价键时,电子云总是尽可能达到最大程度的重叠。
因此,在形成共价键时,原子间总是尽可能沿着电子云最大重叠方向成键。
s电子云呈球形对称分布,p、d、f电子云在空间都有一定的伸展方向。
在形成共价键时,除了s 电子云和s电子云可以在任何方向上都能达到最大程度的重叠外,p、d电子云的重叠,只有在一定方向上才能使电子云有最大程度的重叠。
价键理论概述

价键理论概述价键理论概述摘要:价键理论是指固体或分⼦中原⼦的价电⼦结构和原⼦与原⼦之间形成的键以及两者关系的理论。
它是从原⼦和原⼦结构层次, 深⼊了解材料⼀种重要理论, 能帮助⼈们设计满⾜需要的新材料。
根据收集到的资料, 对价键理论及其应⽤进⾏扼要地归纳与阐述。
关键词:价键理论共价键键参数⾦属应⽤价键理论起源于1916 年美国科学家G1 N1Lew is[1]提出的电⼦配对理论。
1927 年德国科学家W1 He itler与F1 L London[2]第⼀个⽤量⼦⼒学处理H2分⼦, 揭⽰了共价键的本质。
1930 年前后Pauling[3]和S later[4]等把这个理论发展成为⼀种全⾯的键理论, 称为价键理论。
⾦属的价键理论实质就是⽤电⼦配对法来处理⾦属键。
这⼀理论在⾦属材料中有着重要的指导作⽤, 它能帮助⼈们从电⼦结构和原⼦结构层次了解晶体结构, 并以此寻找需要的⾦属新材料。
因此, 国内外科学家, 在这⽅⾯做了⼤量的⼯作, 鉴于价键理论的重要性, 对其发展与应⽤做扼要的归纳与阐述。
⼀、键价理论的基本知识1.基本概念价键理论是在Pauling 离⼦晶体电价规则基础上发展起来的, 它继承了电价规则中/原⼦的价分配在原⼦所连诸键上0的基本概念, 同时允许原⼦所连诸键的键价做不均匀的分配。
价鍵的主要内容包括以下⼏个⽅⾯:(1)在价键理论或价键法则中, 将在反应中保持不变的最基本的实体称作原⼦。
在由⼴义( Lewis)酸(阳离⼦)与⼴义碱(阴离⼦)组成的离⼦性化合物中, 荷正电者为正价, 荷负电者为负价。
(2)化学计量要求离⼦性(或酸碱)化合物中的总正价与总负价的绝对值相等。
即化合物整体保持电中性的原理。
(3)原⼦以化学键与其近邻原⼦键合, 其键连原⼦数称为该原⼦的配位数, 此数亦为该原⼦参与化学键的成键数。
(4)价键理论认为, 原⼦的价将分配在它所参与的诸键上, 使每个键均有⼀定的键价, 并符合价和规则。
高中化学—— 配合物的价键理论
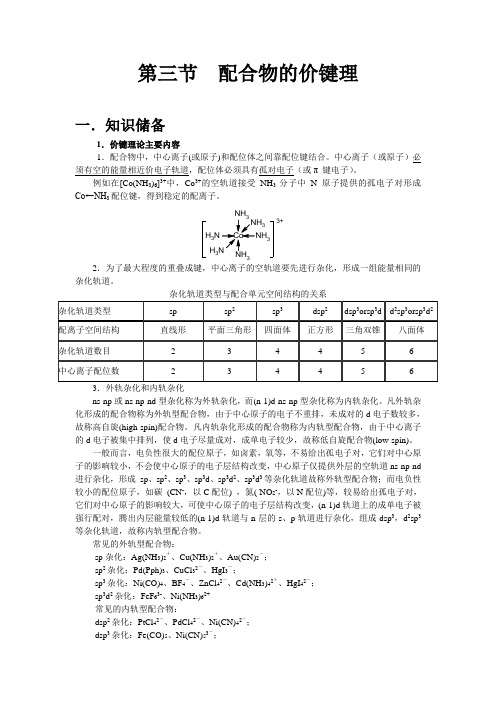
Fe3+ Fe2+ Co3+ Co2+ Mn2+ Fe3+ Co3+ Mn2+ Ni2+
sp3d2 sp3d2 sp3d2 sp3d2 sp3 d2sp3 d2sp3 d2sp3 dsp2
5
5.92
5.88 正八面体
4
4.90
4.为了增加配合物的稳定性,在某些配合物中除了形成 σ 配键外,还能形成反馈 π 配键。
(1)电中性原理:在形成一个稳定的分子或配离子时,其电子结构是竭力设法使每个 原子的静电荷基本上等于零。
(2)反馈 π 键:当配位体给出电子对与中心元素形成 σ 键时,如果中心元素的某些 d 轨道有孤电子对,而配位体有空的 π 分子轨道或空的 p 或 d 轨道,而两者的对称性又合适时, 则中心元素的孤对 d 电子也可以反过来给予配位体形成所谓的“反馈 π 键”。
1.A 的化学式 Cr(NH3)3O4 或 CrN3H9O4 A 的可能结构式如下图:
NH3
O
O
O
O Cr
O and/or O Cr
NH3
O
NH3
O
NH3
NH3
NH3
2.A 中铬的氧化数为+4 3.氧化还原性(或易分解或不稳定等) 4.化学方程式:CrO42-+3NH3+3H2O2=Cr(NH3)3(O2)2+O2+2H2O+2OH-
2.设配合物中碳原子数为 nC,则:nC︰nN=17.74/12︰31.04/14=0.667 已知 nN=2×2+2=6, 所以,nC=0.677×6=4 求出摩尔质量,由于剩余量过小,只能设 A 是氮氢化合物,由此得氢数,可
推得配体 A 为 H2NCH2CH2NH2,
H2C
配合物的结构示意图为:
Fe(CN)63-
研究生课件-价键与轨道理论

轨道理论在材料科 学中的应用
轨道理论在材料科学领域的应 用也取得了显著进展,尤其是 在研究固体材料的电子结构和 物理性质方面,如导电性、光 学性质等。
价键与轨道理论的 交叉研究
随着研究的深入,价键理论与 轨道理论的交叉研究逐渐增多 ,二者相互借鉴和融合,为化 学和材料科学领域的研究提供 了更全面的理论支持。
轨道理论的发展历程
01
轨道理论最早可以追溯到20世纪 初的量子力学发展初期,当时科 学家们开始尝试用量子力学来描 述电子在原子中的运动状态。
02
随着科学家们对量子力学理解的 深入,轨道理论逐渐发展并完善 ,成为描述原子和分子中电子运 动的重要工具。
轨道理论的应用领域
轨道理论在化学、物理、材料科学等多个领域都 有广泛的应用,它可以帮助科学家们更好地理解 物质的性质和行为,从而为新材料的开发和应用 提供理论支持。
实验验证的加强
随着实验技术的不断发展,将会有更多机会对价键与轨道理论的预 测结果进行实验验证,促进理论与实验的相互印证。
感谢观看
THANKS
价键与轨道理论在化学反应中的协同作用
互补性
价键理论与轨道理论在描述化学键和分子结构方面各有侧重,但它们之间存在互补性。价键理论强调共价键的形成和 类型,而轨道理论关注电子行为的细节。
相互印证
在实际的化学反应中,价键理论和轨道理论可以相互印证。通过比较反应前后的分子结构和电子状态,可以更全面地 理解反应机理和预测反应结果。
04
价键与轨道理论在化学反 应中的作用
价键理论在化学反应中的作用
价键理论定义
价键理论是描述共价键形成的理论,它强调电子对的共享在化学键形成中的关键作用。
电子对的共享
在价键理论中,原子间通过电子对的共享形成共价键。电子的完全共享导致完全的电子 云重叠,形成稳定的共价键。
化学竞赛—价键理论

π键的电子云
头碰头——σ键
肩并肩——π键
(1)π键的重叠程度不及σ键,键能较 小,键的活泼性较大,是化学反应 的参与者。 (2)所有共价单键均为σ键,共价双键 中有一个σ键和一个π键。 (3)普通σ键和π键为定域键,多个原 子间构成的大π键为离域键。
离域π键 由两个以上的 p轨道以“肩并肩” 的方式重叠形成的键,称为离域π键或 大π键。 n 通常离域π键用符号π m 表示,n表 示p轨道数,也是成键的原子数,m表 示电子数。
二、 价键理论
离子键理论能很好地说明离子化合物的形 成和性质,但不能说明由相同原子组成的单质 分子(如H2、Cl2、N2等),也不能说明不同非金 属元素结合生成的分子,如HCl、CO2、NH3等 和大量的有机化合物分子形成的化学键本质。 1916年美国化学家路易斯(G N Lewis, 1875~1946)提出了共价学说,建立了经典的共 价键理论。原子间可共用一对或几对电子,以 形成稳定的分子。
N N
键长:成键两原子间的平均间距。
在101.3kPa,298K条件下,断开1molAB(g)分子 中的化学键,使其分别变成气态A原子和气态B原子 所吸收的能量。
共价键 键长 键能 l/pm E/(kJ· -1) mol 92 570 H-F 432 H-Cl 127 366 H-Br 141 161 298 H-I 141 159 F-F 243 Cl-Cl 198 193 Br-Br 228 267 151 I-I 共价键 键长 键能 l/pm E/(kJ· -1) mol 436 H-H 74 346 C-C 154 C C 134 602 C C 120 835 159 N-N 145 N N 110 946 414 C-H 109 464 O-H 96
化学竞赛-价键理论

价键理论强调了电子在形成化学 键中的重要作用,并解释了分子 中的键合类型、键合强度和分子 几何结构等方面的信息。
价键理论的发展历程
19世纪初,价键理论的基本概念开始萌芽,当时科学 家们开始认识到电子在化学键中的作用。
20世纪初,价键理论得到了进一步的发展和完善,其 中最为著名的科学家是英国化学家莫里斯·威廉·皮尔兹
洪特规则
洪特规则是描述电子排布和化学键形成的规则之一,它指 出在相同能级的不同轨道中,电子优先以自旋方向相同的 方式占据轨道。
在形成化学键时,洪特规则可以预测电子在轨道中的排布 方式,从而影响化学键的类型和稳定性。
洪特规则可以解释许多化合物的电子构型和几何构型,是 理解和预测化学反应的重要工具。
03 价键理论的实际应用
分子的几何构型
分子构型的确定
价键理论不仅解释了共价键的形成,还为确定分子几何构型提供了理论基础。根 据电子对的排斥作用和最小化能量原则,可以预测分子的几何构型。
分子构型的稳定性
分子的几何构型不仅决定了分子的物理和化学性质,还影响了分子的稳定性。根 据价键理论,电子对的最大重叠和最小排斥原则有助于理解分子构型的稳定性。
以及金属与配体的相互作用。
无机化学
价键理论可以用来描述无机化合物的分子 结构和性质,如氢化物、氧化物和含金属 的化合物等。
生物化学
虽然价键理论在生物化学中的应用相对较 少,但它仍然可以用来描述某些生物分子 的结构和性质,如蛋白质和核酸等。
02 价键理论的基本原理
电子配对原理
01
电子配对原理是价键理论的核心,它指出原子在形成化学键时, 倾向于将未成对的电子配对成键,以使系统能量最低。
共价键的形成与断裂
共价键的形成
价键理论

于是, CO 可表示成 :
C
O
配位键形成条件: 一个原子中有对电子;而另一原子中有可 与对电子所在轨道相互重叠的空轨道。 在配位化合物中,经常见到配位键。 在形成共价键时,单电子也可以由对电子分开而得到。如 CH4 分子, C 原子 2s2 2p2 ,只有 2 个单电子。 2s 2p 2s 2p
2 价键理论 将对 H2 的处理结果推广到其它分子中,形成了以量子力学 为基础的价键理论 ( V. B. 法 ) 。 1°共价键的形成 A、B 两原子各有一个成单电子,当 A、B 相互接近时,若 两个电子所在的原子轨道能量相近,对称性相同,则可以相互重 叠,两电子以自旋相反的方式结成电子对。于是体系能量降低, 形成化学键。一对电子形成一个共价键。 形成的共价键越多,则体系能量越低,形成的分子越稳定。 因此,各原子中的未成对电子尽可能多地形成共价键 。 例如,H2 中,可形成一个共价键; HCl 分子中,也形成一个 共价键。 N2 分子怎样呢 ?
这说明破坏 H2 的化学键要吸热 ( 吸收能量 ),此热量 D 的 大小与 H2 分子中的键能有关。 计算还表明,若两个 1s 电 子以相同自旋的方式靠近,则 r 越小,V 越大。此时,不形 成化学键。 如图中上方红色曲 线所示,能量不降低 。
0 V
-D
ro
r
H2 中的化学键,可以认为是电子自旋相反成对,结果使体 系的能量降低 。 从电子云的观点考虑,可认为 H 的 1s 轨道在两核间重叠,使电子在两核间出现 的几率大,形成负电区。两核吸引核间负 电区,使 2 个 H 结合在一起。
3s
3p
激发
3d
3s 3pFra bibliotek3d 激发后,有 5 个单电子,与 5 个 Cl 形成共价键 。
价键理论

价键理论价键理论valence-bond theory,一种获得分子薛定谔方程近似解的处理方法。
又称电子配对法。
历史上最早发展起来的化学键理论。
主要描述分子中的共价键和共价结合,其核心思想是电子配对形成定域化学键。
1产生1927年W.H.海特勒和F.W.伦敦首次完成了氢分子中电子对键的量子力学近似处理,这是近代价键理论的基础。
L.C.鲍林等加以发展,引入杂化轨道概念,综合成价键理论,成功地应用于双原子分子和多原子分子的结构。
价键理论与化学家所熟悉的经典电子对键概念相吻合,一出现就得到迅速发展。
但价键理论计算比较复杂,使得后来发展缓慢。
随着计算技术日益提高,该理论还会有新发展。
1927年,Heitler 和London 用量子力学处理氢气分子H2,解决了两个氢原子之间化学键的本质问题,使共价键理论从典型的Lewis理论发展到今天的现代共价键理论。
海特勒-伦敦方法处理氢分子氢分子的哈密顿算符是:式中rA1、rB1为核A、B与电子1之间的距离;r12为两个电子之间的距离;RAB为两个原子核之间的距离……(图1);1/RAB表示两个原子核之间的势能(氢核和电子电荷皆为1基本电荷单位);1/rA1、1/rB1、…也是势能;墷是拉普拉斯算符。
海特勒-伦敦方法的要点在于如何恰当地选取基态H2的近似波函数Ψ(1,2)(或称尝试波函数),然后用变分公式使氢分子能量E为最低(假定Ψ是归一化的):式中*表示复数共轭。
考虑两个氢原子组成的体系,若两个氢原子A(有电子1)和B(有电子2)的基态波函数为:φA⑴=πexp(-rA1)φB⑵=πexp(-rB2)假如两个氢原子相距很远,那么体系波函数是:Φ1(1,2)=φA⑴φB⑵实际上两个电子是不可区分的。
同样合适的函数是:Φ2(1,2)=φB⑴φA⑵两个函数Φ1和Φ2都对应相同的能量。
海特勒和伦敦就取两个函数的等权线性组合作为H2的变分函数:Ψ(1,2)=c1Φ1+c2Φ2解久期方程得c1=±c2,波函数和能量是:式中s称原子轨道的重叠积分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
主要的杂化类型和立体构型列于下表:
杂化类型
sp3
sp2
sp
sp3d或dsp3
sp3d2或d2sp3
立体构型
正四面体
正三角形
直线形
三角双锥体
正八面体
VSEPR模型
AY4
AY3
AY2
AY5
AY6
有d轨道参与的杂化轨道在配位化合物的价键理论中有介绍。
价Hale Waihona Puke 理论价键理论(Valence bond theory,VB理论)是一种获得薛定谔方程近似解的处理方法,又称为电子配对法。它是历史上最早发展起来的化学键理论。价键理论主要描述分子中的共价键及共价结合,核心思想是电子配对形成定域化学键。
其量子化学模型认为,共价键是由不同原子的电子云重叠形成的。例如,p电子和p电子可以有两种基本的成键方式:
价键理论中,为了解释分子或离子的立体结构,泡林以量子力学为基础提出了杂化轨道理论。其核心思想即是不同原子轨道的叠加重组,从而成为数目相同,能量相等的新轨道。例如,为了解释甲烷的正四面体结构,杂化轨道理论认为:
碳基态原子构型为1s22s22p2。首先碳2s中的一个电子被激发到空的2p轨道上,然后1个s轨道和3个p轨道重新组合成4个sp3杂化轨道,再分别和4个氢原子的1s电子成键。4个杂化轨道呈正四面体构型,键角109o28',能量没有任何差别。
1.电子云顺着原子核的连线重叠,得到轴对称的电子云图像,这种共价键叫做σ键。
2.电子云重叠后得到的电子云图像呈镜像对称,这种共价键叫做π键。
用形象的言语来描述,σ键是两个原子轨道“头碰头”重叠形成的;π键是两个原子轨道“肩并肩”重叠形成的。一般而言,如果原子之间只有1对电子,形成的共价键是单键,通常是σ键;如果原子间的共价键是双键,由一个σ键和一个π键组成;如果是叁键,则由一个σ键和两个π键组成。σ键可以是s-s,s-p,p-p等电子之间形成的,而π键可由p-p,d-p,d-d等电子之间形成的。除此之外,还存在十分多样的共价键类型,如苯环的p-p大π键,硫酸根的d-p大π键,硼烷中的多中心键,π酸配合物中的反馈键,Re2Cl82−中的δ键,等等。
