水环境化学氧化还原反应PPT课件
合集下载
无机化学第7章氧化还原反应

实验结果与讨论
实验结果
通过实验观察和测量,可以记录到电 流计和电压计的变化情况,从而得出 氧化还原反应过程中电子转移的结论 。
结果讨论
根据实验结果,分析氧化还原反应的 特点和规律,探讨影响氧化还原反应 的因素,以及在实际生产中的应用。
THANKS FOR WATCHING
感谢您的观看
子被氧化。
电子从还原剂转移到氧化剂
02
电子从还原剂转移到氧化剂是氧化还原反应的本质,也是判断
氧化剂和还原剂的依据。
反应趋向于降低电位
03
在自发反应中,反应总是趋向于降低电位,即趋向于更稳定的
电子状态。
氧化还原反应的速率
1 2
反应速率与反应物浓度成正比
在一定条件下,反应速率与反应物浓度呈正比关 系,即反应物浓度越大,反应速率越快。
特点
氧化还原反应是电子转移的过程 ,通常伴随着元素氧化数的变化 ,并伴随着能量的变化。
氧化数与氧化态
氧化数
表示元素在化合物中的氧化态,通常用罗马数字表示。例如,在H₂O中,H的 氧化数为+1,O的氧化数为-2。
氧化态
表示元素在某个特定反应中的氧化状态,通常用希腊字母表示。例如,在反应 H₂O + O₂ → H₂O₂中,H的氧化态为+1,O的氧化态为-1。
在达到平衡后,如果增加某一反应物的浓度,平衡会向减少该物质浓度的方向移动。
压力变化对平衡的影响取决于反应前后气体分子数的变化
如果反应前后气体分子数发生变化,压力变化会对平衡产生影响;反之则不会。
04 氧化还原反应的应用
在化学工业中的应用
氧化还原反应在化学工业中有着广泛的应用,如合成 有机物、制备无机物和金属冶炼等。
水环境化学-天然水中的氧化还原平衡
半反应的平衡常数: K [Re d ]
[Ox ][ e]n
电子活度和氧化还原电位的关系
• pE0 = E0 F / 2.303RT = E0 /0.059=16.92E0 ( 25℃ ) pE = E F / 2.303 RT = E /0.059=16.92E ( 25℃ )
pE = pE0 + 1/n lg [Ox]/[Red]
pE pE0 1 lg J n
水中常见氧化还原反应的pE0
3、天然水体的电位
自然环境中最重要的氧化剂
在自然环境中最重要的氧化剂是大气圈中的自由氧 和水圈的溶解氧,其次是三价铁、四价锰、六价的硫、 铬、钼及五价的氮、钒、砷等也都是自然界的氧化剂。
自然环境中最重要的还原剂
自然环境中最主要的还原剂是二价铁、负二价硫及 许多有机化合物;此外,二价锰、三价铬、三价钒等也 都是自然环境中的还原剂。
NH4+-NO2--NO3--H2O体系的pE-lgc图(pH=7)
(pE0 = 0, PH2=1atm) •pEH+/H2 = -pH (氢线)
边界条件
(2)1/4 O2 + H+ + e- ==1/2 H2O (pE0 = 20.75, PO2=1atm) pEO2/H2O = 20.75 - pH (氧线)
pEH+/H2 = -pH (氢线) pEO2/H2O = 20.75 – pH(氧线)
E E 2.303RT lgJ nF
E E 2 .303 RT lg c (还原型 )
nF
c (氧化型 )
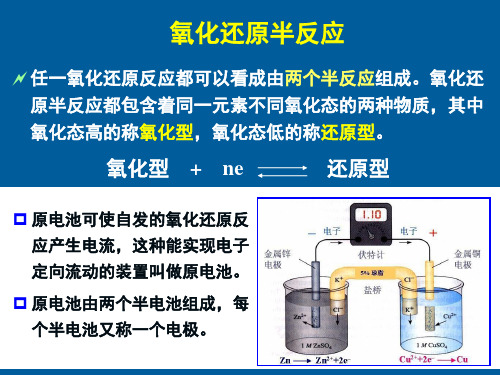
半反应: 氧化型 + ne 还原型
E E 2 .303 RT lg c (还原型 )
环境化学全部ppt课件

免疫毒性效应
污染物质对生物体免疫系统的影响,导致 免疫力下降或免疫功能紊乱,增加感染或 自身免疫性疾病的风险。
CHAPTER 06
环境质量评价方法及标准
环境质量评价概述
环境质量评价的定义和意义 环境质量评价的分类和内容
环境质量评价的程序和步骤
环境质量评价方法
环境质量指数法 指数的计算方法和步骤
大气污染物的归宿
包括干沉降、湿沉降、大气输送和转 化等过程,这些过程可以影响污染物 的浓度和分布。
CHAPTER 03
水环境化学
水体组成与性质
水体组成
水分子、溶解物质、悬浮物质、底泥 等。
水体性质
物理性质(温度、颜色、透明度等) 、化学性质(酸碱度、氧化还原电位 等)。
水体污染及危害
水体污染来源
体。
食物污染
受污染的食品,如含农药残留 的蔬菜、水果,受重金属污染
的鱼类等。
生物体内污染物质分布和排泄规律
分布规律
污染物质在生物体内的分布受多种因素影响,如物质的脂溶 性、分子量大小、生物体代谢能力等。一般来说,脂溶性物 质更易在脂肪组织中积累,而水溶性物质则更易在血液和体 液中分布。
排泄规律
生物体通过多种途径将污染物质排出体外,包括尿液、汗液 、呼吸、乳汁等。不同物质的排泄方式和速率也有所不同, 如重金属往往通过胆汁和尿液排出,而某些有机污染物则可 能通过皮肤排泄。
监管措施和 手段
环境质量标 准实施与监 管
实施效果评 估与反馈
CHAPTER 07
当代环境热点问题探讨
全球气候变化问题
温室气体排放
01
人类活动导致大量温室气体(如二氧化碳、甲烷等)排放,引
发全球气候变化。
《养殖水化学》第五章天然水的氧化还原作用

二级反应
反应速率与两个反应物的浓度成正比,速率常数k为常数。
复杂反应
包含多个步骤的反应,需要建立更复杂的动力学模型来描述。
04
天然水中的氧化还原状态及其指标
氧化还原状态的指示剂
溶解氧(DO) 是水体中溶解的分子态氧,是衡量水 体氧化还原状态的重要指标。
氧化还原电位(ORP)
表示水体中氧化还原反应的电位,可 以反映水体中氧化还原状态的变化。
生理需求
繁殖与发育
天然水的氧化还原作用还影响到水生 生物的繁殖与发育,如某些生物需要 在特定的氧化还原条件下才能正常繁 殖。
不同水生生物对溶解氧的需求不同, 某些生物对溶解氧的要求较高,而某 些生物则可以在低氧环境下生存。
对养殖水体的影响
养殖效益
养殖水体的氧化还原状态直接影响到养殖效益,如溶解氧 含量、酸碱度等。
氧化还原电位与水质的关系
氧化还原电位的变化可以反映水体中氧化还原反应 的强度和水质的变化趋势。
化学需氧量和生物需氧量 与水质的关系
化学需氧量和生物需氧量可以反映水体中有 机物的含量和生物降解能力,对水质评估和 治理具有重要意义。
05
天然水中氧化还原作用的生态意义
对水生生物的影响
生存环境
天然水的氧化还原状态直接影响到水 生生物的生存环境,如溶解氧含量、 酸碱度等。
《养殖水化学》第五章天 然水的氧化还原作用
• 天然水的氧化还原作用概述 • 天然水中的氧化剂与还原剂 • 天然水中的氧化还原反应动力学 • 天然水中的氧化还原状态及其指标 • 天然水中氧化还原作用的生态意义
01
天然水的氧化还原作用概述Biblioteka 氧化还原反应的定义氧化
物质失去电子的过程,通常伴随着能量的释放。
反应速率与两个反应物的浓度成正比,速率常数k为常数。
复杂反应
包含多个步骤的反应,需要建立更复杂的动力学模型来描述。
04
天然水中的氧化还原状态及其指标
氧化还原状态的指示剂
溶解氧(DO) 是水体中溶解的分子态氧,是衡量水 体氧化还原状态的重要指标。
氧化还原电位(ORP)
表示水体中氧化还原反应的电位,可 以反映水体中氧化还原状态的变化。
生理需求
繁殖与发育
天然水的氧化还原作用还影响到水生 生物的繁殖与发育,如某些生物需要 在特定的氧化还原条件下才能正常繁 殖。
不同水生生物对溶解氧的需求不同, 某些生物对溶解氧的要求较高,而某 些生物则可以在低氧环境下生存。
对养殖水体的影响
养殖效益
养殖水体的氧化还原状态直接影响到养殖效益,如溶解氧 含量、酸碱度等。
氧化还原电位与水质的关系
氧化还原电位的变化可以反映水体中氧化还原反应 的强度和水质的变化趋势。
化学需氧量和生物需氧量 与水质的关系
化学需氧量和生物需氧量可以反映水体中有 机物的含量和生物降解能力,对水质评估和 治理具有重要意义。
05
天然水中氧化还原作用的生态意义
对水生生物的影响
生存环境
天然水的氧化还原状态直接影响到水 生生物的生存环境,如溶解氧含量、 酸碱度等。
《养殖水化学》第五章天 然水的氧化还原作用
• 天然水的氧化还原作用概述 • 天然水中的氧化剂与还原剂 • 天然水中的氧化还原反应动力学 • 天然水中的氧化还原状态及其指标 • 天然水中氧化还原作用的生态意义
01
天然水的氧化还原作用概述Biblioteka 氧化还原反应的定义氧化
物质失去电子的过程,通常伴随着能量的释放。
《氧化还原反应的基本规律》氧化还原反应PPT

【解析】选B。A项反应若发生则有氧化性S&g#43;可以氧化S2-;D项中Fe3+已是最高 价,没有还原性,不能被Cl2氧化。
3.在反应3NO2+H2O====2HNO3+NO中,发生还原反应和发 生氧化反应的分子个数之比为 ( )
A.3∶1 B.1∶3 C.1∶2 D.2∶1
【记忆口诀】 先确定变价元素,再计算价态变化; 桥上标明电子数,箭头还原到氧化。
【思考·讨论】 (1)在用双线桥法表示电子转移情况时,箭头的指向能 表示电子转移的方向吗?两个线桥上表示的电子总数有 何关系?请简要说明。
提示:双线桥不能表示电子转移方向;只能表明同一元 素原子的电子转移情况。两个线桥上电子总数相等。
氧化性,则氧化性
XO
4
>Z2>B2>A3+,可发生反应Z2+2A2+
====2A3++2Z-,氧化性Z2>A3+,A、C正确;①中Z元素的化 合价升高,③中Z元素的化合价降低,分别作还原剂、 氧化剂,B错误;①中X得到电子被还原,则X2+是 XO4 的还 原产物,D正确。
【迁移·应用】 1.(2019·武威高一检测)下列微粒中,只有氧化性的是
【典例2】在常温下发生下列反应:
①16H++10Z-+2 XO4 ====2X2++5Z2+8H2O ②2A2++B2====2A3++2B③2B-+Z2====B2+2Z根据上述反应,判断下列结论中错误的是 ( )
A.溶液中可能发生反应Z2+2A2+====2A3++2Z-
高中化学人教版必修一第二章第三节《氧化还原反应》ppt课件 (共50张PPT)

•上述反应中,哪些反应属于氧化 还原反应? •基本反应类型与氧化还原反应有 什么关系?
请同学通过图示来表示出氧化还原 反应与四种基本反应类型的关系:
分解 反应 化合 反应
氧化还原反应
置换 反应
复分解 反应
非氧化还原反应
氧化还原反应与四种基本反应类型的关 系可表示为:
氧化还原反应
复分解反应
【讨论】【交流ຫໍສະໝຸດ 论】在下列几个氧化还原反应中, H2O所起的作用一样吗?
既不是氧化剂 ⑴Cl2+H2O==HCl+HClO 也不是还原剂 ⑵2F2+2H2O==4HF+O2↑ 还原剂 ⑶2Na+2H2O==2NaOH+H2↑ 氧化剂 既是氧化剂 电解 ⑷2H2O == 2H2↑+O2↑ 也是还原剂
【知识拓展】
【练习】
1、下列变化中,需加入氧化剂才能实 现的是( BC ) A、HCl→ H2 B、CO → CO2 C、SO2 → SO3 D、FeCl3 → FeCl2
【练习】
2、下列变化中,加入还原剂才能实现 的是( AB ) A、Ag+ → Ag B、CuO → Cu C、FeO →Fe2O3 D、NO → NO2
特征
化合价 升高
化合价 降低
反应
氧化 反应
还原 反应 氧化 还原 反应
二、氧化剂和还原剂
氧化剂:定义:得到电子(或电子对偏向)的物质。
表现:在反应时所含元素化合价降低
还原剂:定义:失去电子(或电子对偏离)的物质。
表现:在反应时所含元素化合价升高
氧化性: 得电子的能力( 氧化剂的性质 ) 还原性: 失电子的能力( 还原剂的性质 )
【练习】
3、判断下列说法正确的是( A ) A、金属在化学反应中只做还原剂 B、非金属在化学反应中只做氧化剂 C、被氧化的是氧化剂,被还原的是 还原剂 D、失电子的反应是氧化反应,失电子 的物质是氧化剂
请同学通过图示来表示出氧化还原 反应与四种基本反应类型的关系:
分解 反应 化合 反应
氧化还原反应
置换 反应
复分解 反应
非氧化还原反应
氧化还原反应与四种基本反应类型的关 系可表示为:
氧化还原反应
复分解反应
【讨论】【交流ຫໍສະໝຸດ 论】在下列几个氧化还原反应中, H2O所起的作用一样吗?
既不是氧化剂 ⑴Cl2+H2O==HCl+HClO 也不是还原剂 ⑵2F2+2H2O==4HF+O2↑ 还原剂 ⑶2Na+2H2O==2NaOH+H2↑ 氧化剂 既是氧化剂 电解 ⑷2H2O == 2H2↑+O2↑ 也是还原剂
【知识拓展】
【练习】
1、下列变化中,需加入氧化剂才能实 现的是( BC ) A、HCl→ H2 B、CO → CO2 C、SO2 → SO3 D、FeCl3 → FeCl2
【练习】
2、下列变化中,加入还原剂才能实现 的是( AB ) A、Ag+ → Ag B、CuO → Cu C、FeO →Fe2O3 D、NO → NO2
特征
化合价 升高
化合价 降低
反应
氧化 反应
还原 反应 氧化 还原 反应
二、氧化剂和还原剂
氧化剂:定义:得到电子(或电子对偏向)的物质。
表现:在反应时所含元素化合价降低
还原剂:定义:失去电子(或电子对偏离)的物质。
表现:在反应时所含元素化合价升高
氧化性: 得电子的能力( 氧化剂的性质 ) 还原性: 失电子的能力( 还原剂的性质 )
【练习】
3、判断下列说法正确的是( A ) A、金属在化学反应中只做还原剂 B、非金属在化学反应中只做氧化剂 C、被氧化的是氧化剂,被还原的是 还原剂 D、失电子的反应是氧化反应,失电子 的物质是氧化剂
第五章天然水中的氧化还原反应

在含溶解氧丰富的氧化水环境与缺氧的还原水环境中,常见变价元素的主要存在形态列于表5-1。由表5-1可知,变价元素可同时以多种价态形式存在于水环境中,但在不同的水环境中,其主要的存在价态形式不同。如氮元素,在富含溶氧水的氧化环境中,主要以最高价(5+)的NO-3形态存在,即其含量最高;在溶氧量极低、甚至缺氧的还原性水环境中,NH4+(NH3)的含量较高,即氮以最低价(3-)的NH3(NH4+)为主要存在形态,NO-3含量很低,甚至可能无法检出。
(9)1/8SO42-+5/4H++e = 1/8H2S(g) +1/2H2O
(10) 1/8SO42-+9/8H++e = 1/8HS-+1/2H2O
(11)1/4CH2O(有机物)+ H++e = 1/4CH4(g) = 1/4H2O
水环境中物质氧化能力的强弱取决于其夺取电子的能力与浓度。显然,在天然水域中上述氧化还原半反应中O2/H2O电对反应的氧化能力最强,因氧夺取电子的能力仅次于氟,且在水中又具有较高的浓度。因此,在富含溶氧水中,H2S、Fe2+、Mn2+等均可被氧化,这也是在含溶氧丰富的天然水中,大部分元素以高价氧化态存在的原因。如碳主要以高价(4+)的形态:CO2, HCO3-, CO32-存在,硫主要以高价(6+)的形态:SO42-存在;氮主要以高价(5+)的形态:NO3-存在;Fe以高价(3+)的形态:FeOOH或Fe2O3形态存在;Mn以高价(4+)的形态:MnO2存在;同时N2和有机物可在含溶解氧丰富的水环境中存在。
天然水域中的许多氧化还原反应是缓慢的,海洋或湖泊中,在与大气相接触的表层水和沉积物的最深层之间,氧化还原环境有着显著的差别。在两者之间存有一系列的局部中间区域,这是由于各水层中均存有这样或那样的化学反应和各种生物的代谢活动,而各水层之间难以及时得到彻底或充分地混合,此势必导致不同水层存有不同的氧化还原环境,而且基本均未处于平衡状态。在天然水体中,所遇到的大多数氧化还原过程都需要有生物作媒介,这意味着达到平衡状态也强烈地依赖于生物体活动。但是,尽管某水体总的氧化还原平衡难以达到,但部分平衡却时常可接近于达到。通过对水体氧化还原平衡的研究,可以了解水体的环境状况,了解水环境中物质的存在形态、迁移转化机理与过程等,因此研究水体的氧化还原平衡仍具有实际意义。
(9)1/8SO42-+5/4H++e = 1/8H2S(g) +1/2H2O
(10) 1/8SO42-+9/8H++e = 1/8HS-+1/2H2O
(11)1/4CH2O(有机物)+ H++e = 1/4CH4(g) = 1/4H2O
水环境中物质氧化能力的强弱取决于其夺取电子的能力与浓度。显然,在天然水域中上述氧化还原半反应中O2/H2O电对反应的氧化能力最强,因氧夺取电子的能力仅次于氟,且在水中又具有较高的浓度。因此,在富含溶氧水中,H2S、Fe2+、Mn2+等均可被氧化,这也是在含溶氧丰富的天然水中,大部分元素以高价氧化态存在的原因。如碳主要以高价(4+)的形态:CO2, HCO3-, CO32-存在,硫主要以高价(6+)的形态:SO42-存在;氮主要以高价(5+)的形态:NO3-存在;Fe以高价(3+)的形态:FeOOH或Fe2O3形态存在;Mn以高价(4+)的形态:MnO2存在;同时N2和有机物可在含溶解氧丰富的水环境中存在。
天然水域中的许多氧化还原反应是缓慢的,海洋或湖泊中,在与大气相接触的表层水和沉积物的最深层之间,氧化还原环境有着显著的差别。在两者之间存有一系列的局部中间区域,这是由于各水层中均存有这样或那样的化学反应和各种生物的代谢活动,而各水层之间难以及时得到彻底或充分地混合,此势必导致不同水层存有不同的氧化还原环境,而且基本均未处于平衡状态。在天然水体中,所遇到的大多数氧化还原过程都需要有生物作媒介,这意味着达到平衡状态也强烈地依赖于生物体活动。但是,尽管某水体总的氧化还原平衡难以达到,但部分平衡却时常可接近于达到。通过对水体氧化还原平衡的研究,可以了解水体的环境状况,了解水环境中物质的存在形态、迁移转化机理与过程等,因此研究水体的氧化还原平衡仍具有实际意义。
水的课件ppt

硬水与软水
总结词
硬水是指含有较多钙、镁离子的水,而软水 是指含有较少钙、镁离子的水。
详细描述
硬水是指含有较多钙、镁离子的水,这些离 子在水中以碳酸钙和碳酸镁的形式存在。硬 水对日常生活和工业生产都有一定的影响, 例如在洗涤和锅炉等领域需要软化处理。软 水是指经过软化处理后的水,其钙、镁离子 含量较低,适合用于洗涤和锅炉等领域。
改变风向和风速
水体如海洋、湖泊等对气 流有阻碍作用,影响风向 和风速。
水对土壤的影响
土壤形成
水在土壤形成过程中起着 重要作用,通过侵蚀、搬 运和沉积作用形成土壤。
土壤肥力
水可以溶解土壤中的养分 ,促进植物吸收,提高土 壤肥力。
土壤质地
水的冲刷和沉积作用影响 土壤颗粒大小和质地,形 成不同类型的土壤。
05
CATALOGUE
水处理技术
污水处理技术
物理处理法
通过沉淀、过滤、离心分离等方法去 除水中的悬浮物和杂质。
化学处理法
利用化学药剂如氧化剂、还原剂、絮 凝剂等对水中的有害物质进行氧化、 还原、沉淀等处理。
生物处理法
利用微生物的代谢作用去除水中的有 机物和氨氮等有害物质,包括活性污 泥法和生物膜法等。
节约用水的意义与方法
总结词
节约用水是保护水资源的必要措施,通过合理利用水资源、减少浪费、提高用水效率等途径,可以有 效缓解水资源紧张状况。
详细描述
节约用水的意义在于减少水资源的浪费,提高水资源的利用效率,从而满足人类和生态系统对水资源 的需求。节约用水的方法包括推广节水器具、合理安排洗涤和沐浴时间、修缮滴水龙头和漏水水管等 。此外,合理规划农业灌溉和工业用水也是节约用水的有效途径。
详细描述
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
当T=298K时, pe0 =1/0.059E0 = 16.9E0 根据Nernst方程则: E=E0-2.303RT/nF·lg[Red]/[Ox] =2.303RT/F (pe0 -
1/nlg[Red]/[Ox]) 故 pe =EF/2.303RT
当T=298K时, pe =1/0.059 E = 16.9E
(好氧水,水体呈氧化环境,有夺取电子的倾向)
天然水体的pe
(三) 天然水体的pe值计算
eg2. 若在一个有微生物作用产生CH4及CO2的 厌氧水中,假定 pCO2=pCH4,pH=7.00, 相关半反应为1/8CO2+ H+ + e =1/8CH4+1/4H2O peo = 2.87,求pe值.
pe = -4.13 (说明水体是一还原环境,有提供电子的倾向。)
Ox + ne = Red
平衡表达式可表示为:
[Ox][e]n
k = [Red]/
两边取负对数,
并令:
pe0= lgk/n ,
pe= -lg[e]
则得:
pe= pe0 - 1/nlg[Red]/[Ox]
当氧化还原平衡,即 [Red] = [Ox]时
pe= pe0
[注:这里pe是氧化还原平衡体系电子浓度的负对
1. 电子活 度
⑴ 氢离子活度的概念
在酸碱反应中,酸和碱用质子的给予体和
质子的接受体来解释。且定义:
pH = -lg(αH+) αH+—水溶液中氢离子活度,衡量溶液接受或 迁移质子的相对趋势。
⑵ 电子活度的概念
在氧化还原反应中,还原剂和氧化剂是
电子给予体和电子接受体.定义: pe = -lg(αe)
(二)天然水体的氧化还原限度
边界条件:
氧化限度 1.0130×105Pa 氧分压 还原限度 1.0130×105Pa 氢分压
天然水体的pe
(二)天然水体的氧化还原限度
1.氧化限度
电对:1/4O2+H++e = 1/2H2O E0=1.224v
水体的氧化限度:
pe= 20.75 - pH
当pH=7时, pe= 13.75。在这种好氧
氧化态
CO2 Fe(OH)3 SO42- O2 NO3- 等;
天然水体的pe
(一)决定电位
若某个单体系的含量比其它体系高得多,则此 时该单体系电位几乎等于混合复杂体系的pe, 称决定电位。
一般情况下,天然水中溶解氧是决定电位,有 机物积累的厌氧环境中,有机物是决定电位。
天然水体的pe
已知:25℃时,1/4 O2 + H+ + e = 1/2 H2O,
E0 = 1.224 伏。则该体系对应的电子活度
( pe0 )为
。
3.天然水体的pe
问题:
水中主要还原剂为? 主要氧化剂为?
天然水体的pe
水中物质存在的形态
还原态
CH4 H2S Fe2+ S 物等;
NH4+ NO2- ,有机
水 的条件下,水有夺取电子的倾向。
天然水体的pe
(二)天然水体的氧化还原限度
2.还原限度 电对:H+ + e =1/2H2 E0=0v
水体的还原限度: pe= -pH (PH2=101325Pa)
天然水体的pe
(三) 天然水体的pe值计算
eg1. 若水中 po2 = 0.21×105 Pa,
[H+] = 1.0×10-7 mol/L,求pe值. pe = 13.58
△G0=-nFE0 △G0=-2.303nRTpe0
△G=-nFE △G=-2.303nRTpe
( E0=2.303RT/F · pe0
E=2.303RT/F · pe)
某一氧化还原体系的标准电极电位为0.771, 其pe0为______。
A 13.50 B 13.35 C 13.05 D
12.80
数,其定义与pH=-lg[H+]相似。pe0是氧化态和还 原态浓度相等时的pe,或是lgk/n。准确地讲,应 用电子活度来代替上述的电子浓度。]
pe= pe0 - 1/nlg[Red]/[Ox]
当反应平衡时:E0=2.303RT/nF ·lgK
(由于 pe0= lgk/n) =2.303RT/F · pe0
pe0 =E0F/2.303RT
pe
=EF/2.303RT
注:(1)由于pe0不能实测,须用E0实验值,
通过E0 =2.303RT/F · pe0式子计算得到。
(2)pe= pe0 -1/nlg[Red]/[Ox]
有了pe0 ,如果知道氧化态和还原态的浓度,用 浓度代替活度,就可以求出非标准状态的pe值。
出的碱水。 电子活度高的水称为还原性水,如污水处理厂厌
氧消化池水; 电子活度低的水称为氧化性水,如高度加氯水;
问题: 为什么用pH和 pe 来分别表示aH+、αe呢 ?
(aH+、αe往往在十几个乃至于20多个数量级内变 化,用它们大大简化了计算且便于比较。)
2. pe and E的关
系 对任意一个氧化还原半反应,
问题: 近年来,水化学中为何不用E而常用
pe表示氧化还原电位?
解释
(a) pe有明确的物理意义, pe= -lg[e]表 示电子 的相对活度。
(b) pe每变化一个单位,[Red]/[Ox]变化 10倍便于比较。 (n=1时)
(c) pe把数据拉开了便于比较。
Pe与△G 的关系
标准态: 任意态:
αe—水溶液中电子活度。衡量溶液接受 或迁移电子的相对趋势。
(3)电子活度的意义 [pe = -lg(αe)]
pe ↘ ,电子活度越高,体系提供电子的倾向 越强。(还原性越强) pe ↗ ,电子活度越低,体系接受电子的倾向 越强。(氧化性越强)
一般情况下,
H+离子活度高的水称为酸性水,如酸性矿水; H+离子活度低的水称为碱性水,如从碱性土壤溶
天然水体的pe
Pe=pe0-lg1/po21/4 ×1.0 ×10-7
-4.13=20.75+lgpo21/4 -7.0
Po2=3.04×10-67Pa
水环境化学3
水环境中的氧化还原反应
陈娟荣
2009.11.18
水环境中的氧化还原反应的特点
水体深度不同,其氧化还原状况不同(如湖面 与湖底)。
在天然水体中,由许多微生物引起的生化反应 常与之相关联。
水体可以为许多氧化中的氧化还原反应
提问:
在厌氧性湖泊的上层和下层, C、 N、S、Fe分别以什么形式存在呢?
1/nlg[Red]/[Ox]) 故 pe =EF/2.303RT
当T=298K时, pe =1/0.059 E = 16.9E
(好氧水,水体呈氧化环境,有夺取电子的倾向)
天然水体的pe
(三) 天然水体的pe值计算
eg2. 若在一个有微生物作用产生CH4及CO2的 厌氧水中,假定 pCO2=pCH4,pH=7.00, 相关半反应为1/8CO2+ H+ + e =1/8CH4+1/4H2O peo = 2.87,求pe值.
pe = -4.13 (说明水体是一还原环境,有提供电子的倾向。)
Ox + ne = Red
平衡表达式可表示为:
[Ox][e]n
k = [Red]/
两边取负对数,
并令:
pe0= lgk/n ,
pe= -lg[e]
则得:
pe= pe0 - 1/nlg[Red]/[Ox]
当氧化还原平衡,即 [Red] = [Ox]时
pe= pe0
[注:这里pe是氧化还原平衡体系电子浓度的负对
1. 电子活 度
⑴ 氢离子活度的概念
在酸碱反应中,酸和碱用质子的给予体和
质子的接受体来解释。且定义:
pH = -lg(αH+) αH+—水溶液中氢离子活度,衡量溶液接受或 迁移质子的相对趋势。
⑵ 电子活度的概念
在氧化还原反应中,还原剂和氧化剂是
电子给予体和电子接受体.定义: pe = -lg(αe)
(二)天然水体的氧化还原限度
边界条件:
氧化限度 1.0130×105Pa 氧分压 还原限度 1.0130×105Pa 氢分压
天然水体的pe
(二)天然水体的氧化还原限度
1.氧化限度
电对:1/4O2+H++e = 1/2H2O E0=1.224v
水体的氧化限度:
pe= 20.75 - pH
当pH=7时, pe= 13.75。在这种好氧
氧化态
CO2 Fe(OH)3 SO42- O2 NO3- 等;
天然水体的pe
(一)决定电位
若某个单体系的含量比其它体系高得多,则此 时该单体系电位几乎等于混合复杂体系的pe, 称决定电位。
一般情况下,天然水中溶解氧是决定电位,有 机物积累的厌氧环境中,有机物是决定电位。
天然水体的pe
已知:25℃时,1/4 O2 + H+ + e = 1/2 H2O,
E0 = 1.224 伏。则该体系对应的电子活度
( pe0 )为
。
3.天然水体的pe
问题:
水中主要还原剂为? 主要氧化剂为?
天然水体的pe
水中物质存在的形态
还原态
CH4 H2S Fe2+ S 物等;
NH4+ NO2- ,有机
水 的条件下,水有夺取电子的倾向。
天然水体的pe
(二)天然水体的氧化还原限度
2.还原限度 电对:H+ + e =1/2H2 E0=0v
水体的还原限度: pe= -pH (PH2=101325Pa)
天然水体的pe
(三) 天然水体的pe值计算
eg1. 若水中 po2 = 0.21×105 Pa,
[H+] = 1.0×10-7 mol/L,求pe值. pe = 13.58
△G0=-nFE0 △G0=-2.303nRTpe0
△G=-nFE △G=-2.303nRTpe
( E0=2.303RT/F · pe0
E=2.303RT/F · pe)
某一氧化还原体系的标准电极电位为0.771, 其pe0为______。
A 13.50 B 13.35 C 13.05 D
12.80
数,其定义与pH=-lg[H+]相似。pe0是氧化态和还 原态浓度相等时的pe,或是lgk/n。准确地讲,应 用电子活度来代替上述的电子浓度。]
pe= pe0 - 1/nlg[Red]/[Ox]
当反应平衡时:E0=2.303RT/nF ·lgK
(由于 pe0= lgk/n) =2.303RT/F · pe0
pe0 =E0F/2.303RT
pe
=EF/2.303RT
注:(1)由于pe0不能实测,须用E0实验值,
通过E0 =2.303RT/F · pe0式子计算得到。
(2)pe= pe0 -1/nlg[Red]/[Ox]
有了pe0 ,如果知道氧化态和还原态的浓度,用 浓度代替活度,就可以求出非标准状态的pe值。
出的碱水。 电子活度高的水称为还原性水,如污水处理厂厌
氧消化池水; 电子活度低的水称为氧化性水,如高度加氯水;
问题: 为什么用pH和 pe 来分别表示aH+、αe呢 ?
(aH+、αe往往在十几个乃至于20多个数量级内变 化,用它们大大简化了计算且便于比较。)
2. pe and E的关
系 对任意一个氧化还原半反应,
问题: 近年来,水化学中为何不用E而常用
pe表示氧化还原电位?
解释
(a) pe有明确的物理意义, pe= -lg[e]表 示电子 的相对活度。
(b) pe每变化一个单位,[Red]/[Ox]变化 10倍便于比较。 (n=1时)
(c) pe把数据拉开了便于比较。
Pe与△G 的关系
标准态: 任意态:
αe—水溶液中电子活度。衡量溶液接受 或迁移电子的相对趋势。
(3)电子活度的意义 [pe = -lg(αe)]
pe ↘ ,电子活度越高,体系提供电子的倾向 越强。(还原性越强) pe ↗ ,电子活度越低,体系接受电子的倾向 越强。(氧化性越强)
一般情况下,
H+离子活度高的水称为酸性水,如酸性矿水; H+离子活度低的水称为碱性水,如从碱性土壤溶
天然水体的pe
Pe=pe0-lg1/po21/4 ×1.0 ×10-7
-4.13=20.75+lgpo21/4 -7.0
Po2=3.04×10-67Pa
水环境化学3
水环境中的氧化还原反应
陈娟荣
2009.11.18
水环境中的氧化还原反应的特点
水体深度不同,其氧化还原状况不同(如湖面 与湖底)。
在天然水体中,由许多微生物引起的生化反应 常与之相关联。
水体可以为许多氧化中的氧化还原反应
提问:
在厌氧性湖泊的上层和下层, C、 N、S、Fe分别以什么形式存在呢?
