最新初三化学化学计算题试题(有答案和解析)
九年级化学化学计算题题20套(带答案)及解析
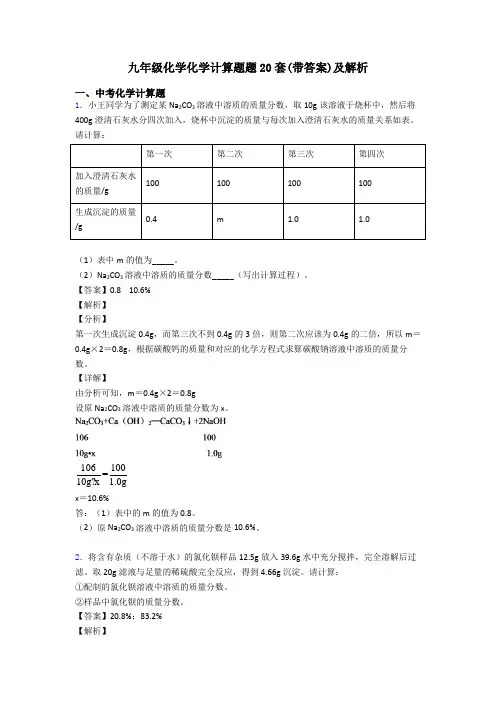
九年级化学化学计算题题20套(带答案)及解析一、中考化学计算题1.小王同学为了测定某Na2CO3溶液中溶质的质量分数,取10g该溶液于烧杯中,然后将400g澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。
请计算:第一次第二次第三次第四次加入澄清石灰水100100100100的质量/g生成沉淀的质量0.4m 1.0 1.0/g(1)表中m的值为_____。
(2)Na2CO3溶液中溶质的质量分数_____(写出计算过程)。
【答案】0.8 10.6%【解析】【分析】第一次生成沉淀0.4g,而第三次不到0.4g的3倍,则第二次应该为0.4g的二倍,所以m=0.4g×2=0.8g,根据碳酸钙的质量和对应的化学方程式求算碳酸钠溶液中溶质的质量分数。
【详解】由分析可知,m=0.4g×2=0.8g设原Na2CO3溶液中溶质的质量分数为x。
106100=10g?x 1.0gx=10.6%答:(1)表中的m的值为 0.8。
(2)原Na2CO3溶液中溶质的质量分数是10.6%。
2.将含有杂质(不溶于水)的氯化钡样品12.5g放入39.6g水中充分搅拌,完全溶解后过滤。
取20g滤液与足量的稀硫酸完全反应,得到4.66g沉淀。
请计算:①配制的氯化钡溶液中溶质的质量分数。
②样品中氯化钡的质量分数。
【答案】20.8%;83.2%【解析】【详解】①设参加反应的氯化钡的质量为x 。
2244BaCl +H SO =BaSO +2H 208233x4Cl.66g208233=x 4.66gx= 4.16g则配制的氯化钡溶液中溶质的质量分数为 :4.16g20g×100%=20.8% ②由于20g 溶液中含有4.16g 氯化钡,则可设样品中氯化钡的质量为y 。
则4.16g y=20g-4.16g 39.6gy=10.4g样品中氯化钡的质量分数为:10.4g12.5g×100%=83.2%答:①氯化钡溶液中溶质的质量分数为20.8% ②样品中氯化钡的质量分数为83.2%。
(化学)初三化学化学计算题试题(有答案和解析)含解析

(化学)初三化学化学计算题试题(有答案和解析)含解析一、中考化学计算题1.有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
试求:(1)样品中金属铜的质量是____g。
(2)所用稀硫酸的溶质质量分数____(写出计算过程)。
【答案】19.519.6%【解析】混合物中只有锌能够和稀硫酸反应生成氢气,题目给出了氢气的质量,所以可以根据氢气的质量和对应的化学方程式求算参加反应的锌的质量和消耗的稀硫酸中溶质的质量,进而求算铜的质量和硫酸中溶质的质量分数。
设参加反应的锌的质量为x,所消耗的硫酸中的溶质的质量为y。
Zn+ H2SO4 = ZnSO4 + H2↑65 98 2x y 0.4g659820.4x y g==x=13gy=19.6g混合物中铜的质量为32.5g-13g=19.5g所以稀硫酸中溶质的质量分数为19.6g0010019.600 100g⨯=答:(1)样品中金属铜的质量是19.5g。
(2)所用稀硫酸中溶质的质量分数为19.6%。
2.某小组同学将530 g碳酸钠溶液加入到280 g石灰乳(水和氢氧化钙的混合物)中,使之恰好完全反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数。
【答案】2%【解析】【详解】设原碳酸钠溶液中溶质的质量为xNa2CO3+ Ca(OH)2=CaCO3↓+ 2NaOH106 100 80X则解得x =10.6g所以加入的碳酸钠溶液中溶质的质量分数为答:加入的碳酸钠溶液中溶质的质量分数为2%。
3.某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,在 20℃时,称取5g 样品,加入27g 水完全溶解后,缓慢加入稀盐酸,至恰好完全反应时,用去 10%的稀盐酸 36.5g。
(该反应的化学方程式为:NaOH+HCl=NaCl+H2O)试计算:(1)样品中氢氧化钠的质量分数。
(化学)九年级化学化学计算题试题(有答案和解析)及解析

(化学)九年级化学化学计算题试题(有答案和解析)及解析一、中考化学计算题1.我国化工专家侯德榜发明了侯氏制碱法,为世界制碱工业作出了突出贡献。
(1)主产品Na2CO3的俗名是_____,副产品氯化铵中阳离子符号为_____。
(2)在实际生产中,产品Na2CO3中常混有少量的NaCl,现有样品11.0g,将其放入干净的烧杯中,向烧杯中逐滴加入溶质质量分数为7.3%的稀盐酸,反应后烧杯中物质的质量与滴入稀盐酸的质量关系如图所示。
①图中A点表示_____,B点的溶质为_____。
②计算样品中Na2CO3的质量分数_____(计算结果精确至0.1%)【答案】纯碱或苏打 NH4+ Na2CO3与盐酸或HCl恰好完全反应 NaCl、HCl 96.4%。
【解析】(1)Na2CO3的俗名是纯碱或苏打,氯化铵中的阳离子是铵根离子,符号为NH4+。
(2)①由图像可知,当滴入上述稀盐酸至图中A点时,加入的稀盐酸恰好与碳酸钠反应。
由图像可知,当滴入上述稀盐酸至图中B点时,加入的稀盐酸的量是过量的,烧杯中溶液里的溶质为NaCl、HCl。
(5).设样品中,含Na2CO3的质量为x。
Na2CO3+2HCl2NaCl+H2O+CO2↑106 73x 100 g×7.3%x=10.6 g样品中Na2CO3的质量分数是:≈96.4%答:样品中Na2CO3的质量分数是96.4%2.化学兴趣小组的同学用一瓶含有少量氯化钠和氯化钙的固体混合物进行下列实验:取样品14 g,放入烧杯中,加入96 g碳酸钠溶液恰好完全反应后过滤,称得滤液的总质量为100 g。
(1)根据质量守恒定律,可知生成沉淀的质量为___________________________。
(2)固体混合物中氯化钙的质量是___________?(3)所得滤液中溶质的质量分数是__________?【答案】10 g 2.9 g 14.6%【解析】(1) 、根据质量守恒定律可知,反应前物质质量总和=反应后物质质量总和,即反应前所有混合物的总质量=滤液的总质量+生成沉淀的质量;(2)、根据化学方程式中各物质之间的质量比,利用碳酸钙沉淀的质量,列出比例式,即可计算出固体混合物中氯化钙的质量。
初三化学化学计算题题20套(带答案)含解析

初三化学化学计算题题20套(带答案)含解析一、中考化学计算题1.我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:方案一: 取10g 石灰石粉末样品置于下图所示装置,充分加热至质量恒定,冷却后称得固体质量为8.12g方案二:另取10g 同质地石灰石颗粒样品,置于烧杯中加足量稀盐酸,充分反应后称得混合物的总质量减少了4.27g相关资料:当地石灰石含有的主要杂技为二氧化硅,其化学性质稳定,加热不易分解且不与盐酸发生化学反应.计算出两种方案测得的石灰石中碳酸钙的质量分数:(1)方案一中碳酸钙的质量分数是_______________________;(2)方案二中碳酸钙的质量分数是_______________________.(精确到0.1%)比较两方案测量的结果,分析两方案误差较大的可能原因?______【答案】42.7% 97% 石灰石分解需要高温,两方案误差较大的原因可能是酒精灯火焰温度偏低,石灰石粉末未能充分分解,引起误差较大.【解析】【分析】【详解】(1)生成二氧化碳的质量为10g-8.12g=1.88g设生成1.88g 二氧化碳需碳酸钙的质量为x32CaCO CaO +10044x 1.88CO g高温 10044=x 1.88gx=4.27g石灰石样品中碳酸钙的质量分数为4.27g100%=42.7% 10g⨯(2)混合物的总质量减少了4.27g说明生成了4.27g二氧化碳设样品中的碳酸钙的质量为y3222CaCO+2HCl=CaCl+H O+CO10044y 4.27g↑10044=y 4.27gy=9.7g石灰石样品中碳酸钙的质量分数为9.7g100%=97% 10g⨯石灰石分解需要高温,两方案误差较大的原因可能是酒精灯火焰温度偏低,石灰石粉末未能充分分解,引起误差较大。
2.我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质。
初中化学计算题大全(含答案及解析)

2024年中考化学《必考经典》计算题大全(含答案及解析)1.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。
分析并计算:(1)a点溶液中含有的离子是_____。
(2)当pH=7时,消耗氢氧化钠溶液中NaOH质量为_____g。
(3)计算稀H2SO4中溶质的质量分数。
_____(4)计算恰好完全反应时所得溶液的溶质质量分数。
_____【答案】Na+、H+、SO42- 0.8 稀H2SO4的溶质质量分数是9.8%;恰好完全反应时所得溶液的溶质质量分数是5.5%。
【解析】【详解】(1)由图示可知,在a点时溶液的pH小于7,说明加入的NaOH完全反应,有剩余的硫酸,所以,溶液中含有的离子为:Na+、H+、SO42-;(2)由图示可知,在溶液的pH等于7,消耗的NaOH溶液的质量为16g,溶质的质量为:16g×5%=0.8g;(3)10g稀硫酸样品含有H2SO4的质量为x,生成的硫酸钠的质量为y2NaOH+H SO=Na SO+2H O2424280981420.8g x y解得:x=0.98g y=1.42g稀H2SO4的溶质质量分数为:×100%=9.8%;(4)恰好完全反应时所得溶液的溶质质量分数:×100%≈5.5%。
2.某小组同学将530 g碳酸钠溶液加入到280 g石灰乳(水和氢氧化钙的混合物)中,使之恰好完全反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数。
【答案】2%【解析】【详解】设原碳酸钠溶液中溶质的质量为xNa2CO3+ Ca(OH)2=CaCO3↓+ 2NaOH106 100 80X则解得x =10.6g所以加入的碳酸钠溶液中溶质的质量分数为答:加入的碳酸钠溶液中溶质的质量分数为2%。
3.取一定量的氯化钠与氢氧化钠的混合物,加一定量的水配成溶液,然后向其中滴加溶质质量分数为7.3%稀盐酸,直至恰好反应,共消耗稀盐酸50g。
初三化学化学计算题题20套(带答案)

初三化学化学计算题题20套(带答案)1. 假设有一块铁块,其质量为56克。
求该铁块中含有的铁原子数。
解答:我们需要知道铁的摩尔质量。
铁的摩尔质量约为56克/摩尔。
因此,该铁块中含有的铁原子数为56克 / 56克/摩尔 = 1摩尔。
由于1摩尔物质中含有6.022 x 10²³个原子,所以该铁块中含有的铁原子数为1摩尔x 6.022 x 10²³个/摩尔= 6.022 x 10²³个。
2. 某化学反应中,反应物A和反应物B的化学计量比为2:3。
如果反应物A的质量为24克,求反应物B的质量。
解答:我们需要根据化学计量比计算出反应物B的质量。
由于反应物A和反应物B的化学计量比为2:3,所以反应物B的质量为24克x (3/2) = 36克。
3. 在一定条件下,一定量的氧气与一定量的氢气完全反应,了36克水。
求反应中消耗的氧气和氢气的质量。
解答:我们需要根据水的化学式H₂O计算出水的摩尔质量。
水的摩尔质量为2 x 1.008克/摩尔 + 16.00克/摩尔 = 18.016克/摩尔。
因此,36克水的物质的量为36克 / 18.016克/摩尔 = 2摩尔。
由于水的化学计量比为2:1,所以反应中消耗的氢气的物质的量为2摩尔,质量为2摩尔 x 2.016克/摩尔 = 4.032克。
同样,消耗的氧气的物质的量为1摩尔,质量为1摩尔 x 32.00克/摩尔 = 32.00克。
4. 某溶液中,溶质的质量分数为10%。
如果该溶液的质量为500克,求溶质的质量。
数为10%,即溶质的质量占溶液总质量的10%。
因此,溶质的质量为500克 x 10% = 50克。
5. 在一定条件下,一定量的氢气和一定量的氧气完全反应,了水。
如果反应中消耗的氢气的质量为2克,求反应中消耗的氧气的质量。
解答:我们需要根据水的化学式H₂O计算出水的摩尔质量。
水的摩尔质量为2 x 1.008克/摩尔 + 16.00克/摩尔 = 18.016克/摩尔。
(化学)初三化学化学计算题试题(有答案和解析)
一、中考化学计算题
1.将含有 NaCl 杂质的某烧碱样品 10 g 完全溶于 90 g 水中,再向所得溶液中慢慢滴入溶质 质量分数为 7.3%的稀盐酸。在实验过程中,溶液的 pH 与滴入稀盐酸的质量关系如图所 示。 (1)求 10 g 该样品中氢氧化钠的质量。 (2)求 a 点时,溶液中溶质的质量分数(计算结果精确到 0.1%)。
(1)当加入 196g 稀硫酸时,放出气体的质量为___________g。 (2)计算加入的稀硫酸溶液溶质的质量分数为____________。 (3)试通过计算求出加入 98g 稀硫酸(即 A 点)时烧杯中溶液溶质的质量分数。(写出 计算过程)_____________ 【答案】4.4 10% 7.1% 【解析】 【分析】 【详解】 (1)从题中图像可知,当加入稀硫酸 98g 时,生成的气体质量达到最大值 4.4g,此时碳酸 钠和稀硫酸完全反应,因此继续加入稀硫酸至 196g,气体质量不会增加,因此反应中放出 气体的质量为 4.4g; (2)因为加入稀硫酸 98g 时,生成的气体质量达到最大值 4.4g,所以此时碳酸钠和稀硫酸 完全反应。 设加入的 98g 稀硫酸中溶质硫酸的质量为 x,恰好反应时生成的硫酸钠质量为 y,参加反应 的碳酸钠的质量为 z。
4g
所用氢氧化钠溶液的溶质质量分数为: ×100%=16%
25g
稀释溶液前后,溶质的质量相等,设将 80g 溶质质量分数为 30%的氢氧化钠溶液稀释为 16%的溶液时,需要加水的质量是 z,则 80g×30%=(80g+z)×16%,解得 z=70g 点睛:根据化学方程式的计算,关键是找出相关物质的质量关系,利用反应中物质的质量
9.现有 HCl 与 CaCl2 的混合溶液,为了分析混合溶液中 HCl 和 CaCl2 的质量分数,设计了如 下实验方案(假设反应都是充分完全):
最新初三化学化学计算题题20套(带答案)
最新初三化学化学计算题题20套(带答案)一、中考化学计算题1.向13.6g碳酸钠和氯化钠的固体混合物滴加稀盐酸,所加稀盐酸质量与生成气体质量的关系如图所示。
计算:(1)固体混合物中碳酸钠的质量。
(2)该稀盐酸中溶质的质量分数。
(3)恰好完全反应时所得的溶液中溶质的质量分数。
(计算结果精确至0.1%)【答案】(1)10.6克(2)10%(3)17.9%【解析】试题分析:设固体混合物中Na2CO3的质量为x,稀盐酸中溶质的质量为y,反应生成NaCl 的质量为z。
Na2CO3+ 2HCl ="=" 2NaCl + H2O + CO2↑106 2×36.5 2×58.5 44x y z 4.4g得x=10.6克稀盐酸中溶质的质量分数为:恰好完全反应时所得的溶液溶质质量分数为:考点:根据化学方程式的计算物质的质量分数2.将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量Fe x C)与足量稀硫酸反应,得到0.48gH2(Fe x C与稀硫酸反应不产生H2)。
若将相同质量的粗还原铁粉在氧气流中完全反应,得到0.22gCO2.试通过计算确定:(1)此粗还原铁粉中单质铁的质量_____(2)此粗还原铁粉中杂质Fe x C的化学式。
_____【答案】13.44g Fe 2C 【解析】 【分析】 【详解】若将14.06g 还原铁粉(含少量Fe x C )在氧气流中加热,得到0.22gCO 2,碳元素的质量=0.22g ×1244=0.06g (1)将相同质量的还原铁粉与足量硫酸反应,得到0.48gH 2,设消耗铁的质量为x 。
2442Fe +H SO =FeSO +562x0H .48g562=x 0.48gx=13.44gFe x C 的质量=14.06g ﹣13.44g=0.62g ; Fe x C 的中铁元素的质量=0.62g ﹣0.06g=0.56g则:56x 0.56g=120.06gx=2所以化学式为Fe 2C3.食盐是维持人体正常生理活动必不可少的物质.人体细胞中约含有NaCl 0.9%,一般成年人每日需NaCl 的量为4.5g ~9g .(1)某病人因食盐摄入量不足,需要补充溶质质量分数约为0.9%的生理盐水,医生通过诊断需为他注射200g 生理盐水,则该病人每天可补充食盐约___g .(2)若用50g 溶质质量分数为18%的氯化钠溶液配制溶质质量分数为0.9%的生理盐水,需加水___g .(3)小明想检验某瓶生理盐水的氯化钠含量是否合格,他从该瓶生理盐水中取出65g 溶液,然后加入足量硝酸银溶液,充分反应后过滤、洗涤、干燥,得到1.435g 沉淀.请你通过计算帮助小明判断这瓶生理盐水的氯化钠含量是否合格____. 【答案】⑴1.8 ⑵950⑶设该生理盐水的溶质质量分数为0.9%,故此生理盐水的氯化钠含量合格。
初三化学考试 计算题25道(附答案)
25基础计算1.在一个实验室中发现一橡胶球可以漂浮在0.5mol/L的NaCl溶液表面,求该NaCl溶液的密度。
答案:1.018g/mL。
解析:根据阿威休斯定律得到:Fb=FgρVg=m*gρ=m/V=(Vg*g)/V=(Fg/Ag*g)/V=(4πr^3/3*g)/[(4/3)*π*r^3]=3/4*r*g=7.35*10^-5*g其中,Ag为橡胶球跟水接触的面积,r为橡胶球半径,g为重力加速度。
因此,NaCl溶液的密度为:ρNaCl=ρwater+ρball=1.000g/mL+7.35*10^-5*g/mL=1.018g/mL。
2.一种饱和食盐水的密度为1.20g/mL,问在哪个温度下它的浓度为26%。
答案:56.8°C。
解析:首先,要知道饱和食盐水在不同温度下的密度变化情况,参考表格得出如下数据:温度(°C)密度(g/mL)01.091101.078201.064301.049401.033501.015600.996700.975800.951900.9241000.895然后,根据浓度的定义可知:浓度=质量/总质量总质量=质量/浓度因为食盐水是饱和的,所以其浓度为100%。
设实验时食盐水的质量为m,则总质量为m/1.20,其中1.20为食盐水的密度。
根据题意,浓度为26%,所以食盐的质量为0.26*(m/1.20)。
由此0.26*(m/1.20)=m/(1.20+Δρ)其中Δρ为实验时食盐水的密度与需要求的密度的差值。
将参考表格中的数据代入上式计算,得到Δρ为0.325g/mL。
解方程得出:Δρ=0.325=0.26*m/(1.20+Δρ)m=68.45g因此,实验时食盐水的质量为68.45g。
而在哪个温度下其密度为1.20*0.26=0.312g/mL呢?查表可得,在56.8°C时,食盐水的密度约为0.312g/mL,因此答案为56.8°C。
九年级化学化学计算题试题(有答案和解析)及解析
九年级化学化学计算题试题(有答案和解析)及解析一、中考化学计算题1.取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。
求:(1)混合物CaCO3中的质量为_______;(2)稀盐酸中的溶质质量分数为________;(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为________?(写出计算过程,计算结果精确到0.1%)【答案】10g7.3%12.6%【解析】试题分析:盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,由图可知:二氧化碳的质量为4.4g设碳酸钙的质量为x,稀盐酸中的溶质质量为z,生成氯化钙的质量为y。
CaCO3+2HCl=CaCl2+H2O+CO2↑100 73 111 44x z y 4.4gx=10g z=7.3g y=11.1g(1)混合物CaCO3中的质量为10g;(2)稀盐酸中的溶质质量分数为100%=7.3%;(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数=100%≈12.6%。
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算2.实验室有一部分被氧化成氧化镁的镁粉样品、未知浓度盐酸和40%的氢氧化钠溶液。
兴趣小组同学为分析样品中金属镁的质量百分含量和计算盐酸的质量分株,进行如下探究:(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量。
实验数据如下表所示:实验序号所取样品质量(g)所加盐酸质量(g)生成氢气质量(g)Ⅰ16.060.00.5Ⅱ16.0130.0 1.0Ⅲ16.0150.0 1.0镁粉样品中金属镁的质量百分含量为_________________。
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示。
计算盐酸的质量分数为_______________。
(写出计算过程)【答案】75% 36.5%【解析】【详解】(1)对比第Ⅱ、Ⅲ组中发现,对比第Ⅲ组中所加盐酸质量由130g增加到150g时,氢气的质量没有增加,说明第Ⅲ组中镁完全反应,设样品中金属镁的质量为x,22Mg+2HCl=MgCl+H242x 1.0g242=x 1.0g↑x=12.0g样品中金属镁的质量百分含量为:12.0g100%=75%16.0g⨯。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CuSO4 + 2NaOH = Cu(OH)2 Na2SO4
160
98
x
9.8g
160 = 98 x 9.8g
x=16g
硫酸铜溶液溶质质量分数为 16g 100%=16% 100g
答:硫酸铜溶液溶质质量分数为 16%。 考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算
10.将铁粉和铜粉混合物 7.0g,加入到盛有 60.0 g 稀盐酸的烧杯中,恰好完全反应。此时 烧杯内各物质的总质量为 66.8 g。试计算:
的质量不变可得关系式:①y-90g=x,②y 89.5%=x+90g
100%,
x=5.2g,
答:生成氧气的质量为 5.2g。
解法二:可根据反应前后氢元素的质量不变进行分析解答,则:
根据题意过氧化氢溶液的质量=90g
100% (1-89.5%),
生成氧气的质量=90g
100% (1-89.5%)-90g=5.2g,
反应后所得溶液中溶质的质量分数 5.85g 5g 4g 100% 10% 5g 27g 36.5g
饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100% , 20℃时,20℃时,氯化钠的 溶解度为 36g,其饱和溶液溶质的质量分数=36g÷(36g +100g)×100%≈26.5%>10%; 点睛:方程式的计算,关键根据化学反应方程式找出相关物质的质量关系,利用反应中物 质的质量比不变进行列比例计算,易错点是,由方程式求质量比算数错误,所以这一步要 仔细检查。
(1)第一次生成的二氧化碳气体的质量为 20g+12g-30.9g=1.1g ,第二次生成的二氧化碳气 体的质量为 20g+20g+12g-49.5g=2.2g ,第四次生成的二氧化碳气体的质量为
80g+12g-87.6g=4.4g ,第五次生成的二氧化碳气体的质量为100g+12g-107.6g=4.4g ,
65 = 161 = 2 ;解得:x=6.5g y=16.1g;故填:6.5 x y 0.2g
(2)反应后所得溶液中溶质的质量分数为:
16.1g
100%=16.1%
93.7g+6.5g-0.2g
答:反应后,所得溶液中溶质的质量分数为 16.1%。故填:16.1% 【点睛】 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性 和准确性。
9.向 100g 硫酸铜溶液中,逐滴加入 NaOH 溶液,化学反应方程式为: CuSO4+2NaOH═ Cu(OH)2↓+Na2SO4。 加入 NaOH 溶液的质量与生成沉淀的质量之间的关系如图所示:
请回答下列问题: (1)Cu(OH)2 质量为______g。 (2)计算硫酸铜溶液溶质质量分数(请写出计算过程)_____。 【答案】9.8 16% 【解析】 【分析】 【详解】 (1)由图象可见氢氧化铜沉淀的质量为 9.8g (2)设硫酸铜溶液中溶质质量为 x
5.化学兴趣小组的同学取 10g 铜锌合金样品于烧杯中,向其中加入一定量的稀硫酸,当加 入稀硫酸的质量为 93.7g 时,恰好完全反应,生成气体的质量与反应时间的关系如图所 示,试回答下列问题:
(1)样品中锌的质量为_____ g。
(2)反应后,所得溶液中溶质的质量分数为_____
【答案】6.5 16.1%
56 127 2
X y 0.2 g
………(1 分)
56∶ 2 =x∶ 0.2 g x=5.6 g
3.某纯碱样品中含有少量氯化钠。现称量该样品 15.4g 放入烧杯中,再向其中加入一定溶 质质量分数的稀盐酸至 100g 时恰好完全反应。此时烧杯内的物质质量为 111g。试计算: (1)碳酸钠中钠元素、碳元素、氧元素的质量比为__________;(化为最简比) (2)反应后生成的气体质量为_________g; (3)恰好完全反应时所得溶液中溶质的质量分数________。(计算结果精确到 0.1%) 【答案】23:6:24。。 4.4; 14.9% 【解析】 【分析】 【详解】 (1)碳酸钠化学式为 Na2CO3,其中钠元素、碳元素、氧元素的质量比=23×2:12×1: 16×3=23:6:24; (2)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,根据质量守恒定律,生成二氧化碳气 体的质量=15.4g+100g-111g=4.4 g;
8.工业生产的纯碱中常含有少量氯化钠杂质,现称取 12 g 纯碱样品于烧杯中,加入水使 其完全溶解,逐渐加入氯化钙溶液至过量,测得加入氯化钙溶液的质量与生成沉淀的关系 如下图所示。(反应的化学方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl)
(1)计算样品中碳酸钠的质量分数________(要求写出计算过程,精确到 0.1%)。 (2)若要计算氯化钙溶液中溶质的质量分数,可使用上图中_____点的一组数据(填标号)。 【答案】(1)88.3%;(2)a(或 b )
最新初三化学化学计算题试题(有答案和解析)
一、中考化学计算题
1.现有一份氧元素质量分数为 89.5%的过氧化氢溶液,加入 MnO2 充分反应后,得到液体 的 质量为 90g(不考虑操作过程中液体的损失),则生成氧气的质量为________________g(精 确到小 数点后 1 位)。 【答案】 5.2 【解析】解法一:设生成氧气的质量为 x,过氧化氢溶液的质量为 y,根据反应前后氧元素
则第四次碳酸钙已反应完全。 设贝壳中碳酸钙的质量分数为 x
CaCO3 + 2 HCl = CaCl2 + CO2 + H2O
100
44
12g x
4.4g
100 = 44 12g x 4.4g
x 83.3%
(2)设稀盐酸与贝壳恰好完全反应后所得溶液中溶质的质量为 y,反应碳酸钙的质量为 z
CaCO3 + 2 HCl = CaCl2 + CO2 + H2O
已知:①FeCO3+H2SO4=FeSO4+CO2↑+H2O
②菱铁矿中杂质不参加反应,且难溶于水。
请计算:
(1)20.0g 菱铁矿中 FeCO3 的质量为 g。 (2)列式计算所用稀硫酸的溶质质量分数(结果准确到 0。1%)
【答案】(1)11.6 (2)19.6%
【解析】
根据所学知识和题中信息知,根据质量守恒定律知,(1)20.0g 菱铁矿中 FeCO3 的质量为 20g-8.4g=11.6g. (2)解∶设所用稀硫酸的溶质质量分数为 x
(3) 假设样品中碳酸钠质量为 x,生成的氯化钠质量为 y,则有:
=
= 解得 x=10.6g,y=11.7g
故样品中氯化钠质量=15.4g-10.6g=4.8g,反应后溶液中溶质为氯化钠,其总质量
=4.8g+11.7g=16.5g,故恰好完全反应时所得溶液中溶质的质量分数= ×100%≈14.9%。
第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量
20
20
20
/g
烧杯内物质的质量
30.9
49.8
m
7.6
(1)贝壳中碳酸钙的质量分数______(精确到 0.1%); (2)稀盐酸与贝壳恰好完全反应后所得溶液中溶质的质量分数_____(精确到 0.1%)。 【答案】83.3% 10.9% 【解析】 【分析】 根据质量守恒定律,反应前反应物的总质量等于反应后生成的生成物的总质量,减少的质 量即为生成的二氧化碳的质量。 【详解】
FeCO3+H2SO4=FeSO4+CO2↑+H2O
116
98
11.6g 50g×x
116
98
=
, x=19.6%.
11.6g 50g x
答∶(1)20.0g 菱铁矿中 FeCO3 的质量为 11.6g。(2)所用稀硫酸的溶质质量分数是 19.6%.。
点睛∶本题主要考查质量守恒定律的应用以及根据化学方程式进行计算。
(1)原混合物中铁粉的质量分数。(精确到 0.1%)
(2)反应后所得溶液中溶质的质量分数。(精确到 0.1%)
【答案】解:生成 H2 的质量="7.0" g + 60 .0g—66.8 g =" 0.2" g ………(1 分)
设原混合物中 Fe 的质量为 x,生成 FeCl2 的质量为 y
Fe + 2HCl = FeCl2+ H2↑ ………(1 分)
x=19g 氯化镁中镁的质量为
样品中含镁元素的质量分数是 答:样品中含镁元素的质量分数是 16%。 【点睛】 氯化镁和氢氧化钠反应生成氯化钠和氢氧化钠。 7.菱铁矿(主要成分是 FeCO3)是炼铁的原料。现取 20.0g 菱铁矿,向其中加入足量稀硫 酸,充分反应,测得固体质量与所加稀硫酸的质量关系如下图所示。
100
111 44
z
y 4.4g
111 = 44 = 100 y 4.4g z
y=11.1g z=10g
稀盐酸与贝壳恰好完全反应后所得溶液中溶质的质量分数为
11.1g 100% 10.9% 100g+12g-10g
答:贝壳中碳酸钙的质量分数为 83.3%,稀盐酸与贝壳恰好完全反应后所得溶液中溶质的 质量分数为 10.9%。 【点睛】 碳酸钙和稀盐酸反应生成氯化钙和水和二氧化碳。
答:生成氧气的质量为 5.2g。
2.为了节约林木资源,近几年兴起了石头纸,石头纸可用沿海水产养殖中产生的大量废弃 贝壳制得。 某化学兴趣小组同学为了测定某种贝壳中碳酸钙的质量分数,将 100g 稀盐酸 分五次加入盛有 12g 贝壳的烧 杯中,充分反应后测得烧杯内物质的质量如表所示(贝壳中其 它物质不与盐酸反应且不溶于水)。请你计 算:
