利用电子守恒法巧解化学计算题论文
高中化学电子守恒

高中化学电子守恒篇一:高中化学守恒法解题技巧化学守恒法解题技巧守恒法是一种中学化学典型的解题方法,它利用物质变化过程中某一特定的量固定不变来列式求解,可以免去一些复杂的数学计算,大大简化解题过程,提高解题速度和正确率。
它的优点是用宏观的统揽全局的方式列式,不去探求某些细微末节,直接抓住其中的特有守恒关系,快速建立计算式,巧妙地解答题目。
物质在参加反应时,化合价升降的总数,反应物和生成物的总质量,各物质中所含的每一种原子的总数,各种微粒所带的电荷总和等等,都必须守恒。
所以守恒是解计算题时建立等量关系的依据,守恒法往往穿插在其它方法中同时使用,是各种解题方法的基础,利用守恒法可以很快建立等量关系,达到速算效果。
一、质量守恒质量守恒是根据化学反应前后反应物的总质量与生成物的总质量相等的原理,进行计算或推断。
主要包括:反应物总质量与生成物总质量守恒;反应中某元素的质量守恒;结晶过程中溶质总质量守恒;可逆反应中反应过程总质量守恒。
例1、在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR,则在此反应中Y和M的质量比为()(A)16:9 (B)23:9 (C)32:9 (D)46:9例2、1500C时,碳酸铵完全分解产生气态混合物,其密度是相同条件下氢气密度的()(A)96倍(B)48倍(C)12倍(D)32倍练习:1、将100℃的硫酸铜饱和溶液200克蒸发掉50克水后再冷却到0℃时,问能析出胆矾多少克?若在100℃硫酸铜饱和溶液200克里加入16克无水硫酸铜,应有多少克胆矾析出?(硫酸铜溶液度100℃时为75.4克。
0℃时为14.3克)(130.48克4.34克)2、在一定条件下,气体A可分解为气体B和气体C ,其分解方程式为2A====B+3C 。
若已知所得B和C混合气体对H2的相对密度为42.5。
求气体A的相对分子量。
(17)3、为了确定亚硫酸钠试剂部分氧化后的纯度,称取亚硫酸钠4g置于质量为30g的烧杯中,加入6mol/L盐酸18mL(密度为1.1 g/cm3),反应完毕后,再加2mL盐酸,无气体产生,此时烧杯及内盛物物质为54.4g,则该亚硫酸钠试剂的纯度为百分之几?4、向KI溶液中滴入AgNO3溶液直至完全反应,过滤后滤液的质量恰好与原溶液质量相等,则AgNO3溶液中溶质的质量分数为多少?二、物质的量守恒物质的量守恒是根据反应前后某一物质的量不变的原理进行推导和计算的方法。
浅谈守恒法巧解有关硝酸的典型计算

浅谈守恒法巧解有关硝酸的典型计算硝酸是一种常见的无机化合物,化学式为HNO3、守恒法是化学计算中常用的一种方法,用于计算化学反应中各种物质的质量、摩尔数或体积的关系。
下面将以守恒法为基础,对有关硝酸的典型计算进行简要探讨。
首先,我们可以考虑一种常见的硝酸的制备实验:用氧化亚氮与氧反应制备硝酸。
化学方程式如下:2NO(g)+O2(g)->2NO2(g)2NO2(g) + H2O(l) -> HNO2(aq) + HNO3(aq)在这个实验中,氧化亚氮(NO)气体与氧气(O2)气体反应生成二氧化氮(NO2)气体,再与水反应生成亚硝酸(HNO2)和硝酸(HNO3)。
为了使用守恒法解决这个问题,我们需要先了解反应物和生成物之间的摩尔关系。
根据化学平衡原理,反应物和生成物的摩尔比应满足化学方程式中的系数比。
首先,我们假设氧化亚氮和氧的初始摩尔数分别为n1和n2、根据化学方程式,反应得到的二氧化氮的摩尔数即为n1,并且生成的亚硝酸和硝酸的摩尔数应分别为n1/2和n1/2接下来,我们假设生成的亚硝酸的摩尔数为n3,生成的硝酸的摩尔数为n4、根据化学方程式,生成的亚硝酸和硝酸的摩尔数应满足如下关系式:2n1=n32n1=n4我们还需要考虑到物质的守恒,即物质的质量守恒和电荷守恒。
对于质量守恒,我们可以将反应物的质量与生成物的质量逐一比较。
对于电荷守恒,反应物和生成物的总电荷数应相等。
根据上述守恒条件和关系式,我们可以通过代入数据和解方程来计算出每个物质的摩尔数。
例如,我们假设初始状态下氧化亚氮的摩尔数为0.1 mol,氧气的摩尔数为0.2 mol。
代入关系式,可以得到二氧化氮的摩尔数为0.1 mol,亚硝酸和硝酸的摩尔数均为0.05 mol。
通过计算可以得出,摩尔为单位的物质质量可以通过其摩尔数与摩尔质量的乘积来计算。
例如,硝酸的摩尔质量为63 g/mol,因此硝酸的质量为0.05 mol * 63 g/mol = 3.15 g。
电子守恒定律在化学计算中的应用

电子守恒定律在化学计算中的应用氧化一还原反应是中学化学学习的主线,也是高考必考的考点之一。
在氧化一还原反应中遵循电子守恒,即氧化剂得到电子物质的量(或个数)等于还原剂失去电子的物质的量(或个数)。
若将电子守恒规律应用来解化学计算题,可以大大简化我们的计算过程,收到事半功倍的效果。
下面通过几个例题,谈谈电子守恒定律在化学计算中的应用。
一、在“活泼金属与酸或水反应产生氢气”类题中的应用活泼金属与酸或水反应产生氢气这类题很常见,很多学生认为解这类题比较难,我认为根本原因是没有弄清这类反应的实质:活泼金属失去电子,+1价的氢得到电子,而金属失去电子的物质的量等于生成氢气所需得到电子的物质的量,即n(金属)xAn==n(氢气)x2(n(金属):金属的物质的量,An:金属变化的化合价,n(氢气):氢气的物质的量) 例1A、B是同一短周期的两种元素,9gA单质跟足量的B的气态氢化物水溶液反应,产生11.2L氢气(标准状况下),A和B可形成化合物AB,,A原子核里中子数比质子数多1,通过计算确定A、B各为哪种元素。
解析:根据A、B可形成化合物AB,及A单质与足量的B的气态氢化物水溶液反应产生H2,可知A为金属元素且在上述反应中化合价表现为+3,n(H:)一11.2L+22.4L/mol-=0.5mol,n(金属)一9g~Mg·rnol 代入上述公式:9g~Mg·molx3-~-0.5molx2,得M一27g/mol,所以A为A1元素,可以进一步确定B为C1元素。
二、在金属与硝酸反应类题中的应用例25.12g铜和一定质量的浓硝酸反应,当铜反应完时,共收集到标准状况下的气体3.36L,若把装有这些气体的集气瓶倒立在盛水的水槽中,需要通入多少升标准状况下的氧气才能使集气瓶充满溶液? 解析:铜失去电子的物质的量==被还原的硝酸得到电子的物质的量=氧化硝酸的还原产物NO、NO:消耗的氧气的物质的量,省去中间计算,即铜失去电子的物质的量=氧气得到电子的物质的量。
巧用电子守恒原理解氧化还原反应计算题

巧用电子守恒原理解氧化还原反应计算题摘要:得失电子守恒是氧化还原反应的本质特征,电子守恒法是中学化学计算中的基本解题方法。
本文结合教学过程中常见的几种情况对此进行了系统的总结归纳。
关键字:电子守恒;氧化还原;计算氧化—还原反应的本质是电子得失或偏移,在同一个氧化—还原反应里,氧化剂得到电子的总数等于还原剂失去电子的总数,而电解或电镀实际上也是发生氧化—还原反应,因此,在同一时间内,阴极上物质得到电子的数目等于阳极上物质失去电子的数目。
利用得失电子守恒来建立等式是快速解决氧化还原反应计算题的基本方法。
下面通过几个例题,谈谈电子守恒法在氧化还原反应计算中的应用。
一、省去中间过程,简化计算新课程教育网@版权所有例1:将1.92gCu投入到一定量的浓硝酸中,随着反应的进行,生成气体的颜色逐渐变浅,当铜完全溶解后,共收集到χ?mL气体(标准状况)。
将盛有等量该气体的容器倒入水中,欲使容器内气体恰好完全溶解于水,试求需通入氧气的体积(标准状况)?新课程教育网@版权所有解析:由题意可知,铜与一定量的浓硝酸反应,先生成红棕色的NO2,后生成无色的NO;若用常规解法,应先求出NO、NO2的物质的量,再根据:计算出的物质的量,并求出其体积,此方法运算量大,中间计算多且复杂,容易出错。
用电子守恒法综合考虑,可省去中间的各步计算,使计算简化。
若由图示题意:新课程教育网@版权所有HNO3→?NO、NO2(χ?mL)→?HNO3新课程教育网@版权所有????就可发现Cu失去的电子总数等于O2得到的电子总数,即有2Cu~O2新课程教育网@版权所有新课程教育网@版权所有?二、判断氧化产物或还原产物的化合价?例2:24mL 溶液,恰好与20mL溶液完全反应,则铬元素在还原产物中的化合价为()A. +6B. +3C. +2D. 0解析:反应中的化合价变化为:Cr +6→?x↑ ,S +4→?+6↓6-4=2。
则有:三、在电解类题中的应用例3、用两支惰性电极插入500mL AgNO3溶液中,通电电解,当电解液的PH 从6.0变为3.0时(设电解时阴极没有H2析出,且电解前后溶液体积不变),电极上应析出银的质量是()。
转移电子守恒法在硝酸试题中的应用
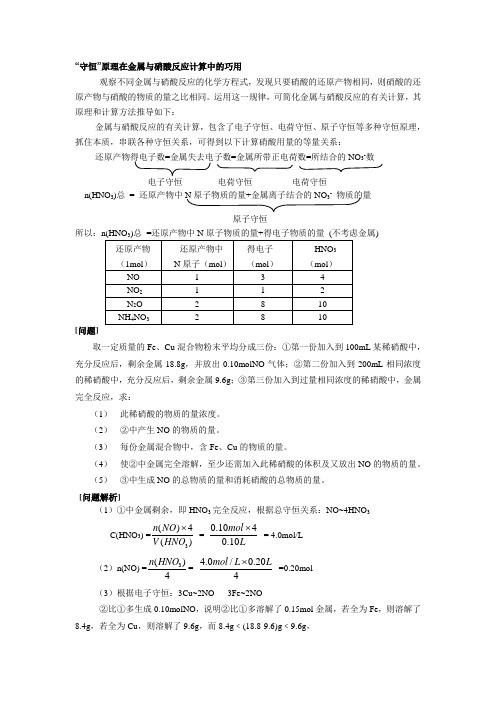
“守恒”原理在金属与硝酸反应计算中的巧用观察不同金属与硝酸反应的化学方程式,发现只要硝酸的还原产物相同,则硝酸的还原产物与硝酸的物质的量之比相同。
运用这一规律,可简化金属与硝酸反应的有关计算,其原理和计算方法推导如下:金属与硝酸反应的有关计算,包含了电子守恒、电荷守恒、原子守恒等多种守恒原理,抓住本质,串联各种守恒关系,可得到以下计算硝酸用量的等量关系:还原产物得电子数=金属失去电子数=金属所带正电荷数=所结合的NO 3-数电子守恒 电荷守恒 电荷守恒 n(HNO 3)总 = 还原产物中N 原子物质的量+金属离子结合的NO 3- 物质的量原子守恒 所以:)[问题]取一定质量的Fe 、Cu 混合物粉末平均分成三份:①第一份加入到100mL 某稀硝酸中,充分反应后,剩余金属18.8g ,并放出0.10molNO 气体;②第二份加入到200mL 相同浓度的稀硝酸中,充分反应后,剩余金属9.6g ;③第三份加入到过量相同浓度的稀硝酸中,金属完全反应,求:(1) 此稀硝酸的物质的量浓度。
(2) ②中产生NO 的物质的量。
(3) 每份金属混合物中,含Fe 、Cu 的物质的量。
(4) 使②中金属完全溶解,至少还需加入此稀硝酸的体积及又放出NO 的物质的量。
(5) ③中生成NO 的总物质的量和消耗硝酸的总物质的量。
[问题解析](1)①中金属剩余,即HNO 3完全反应,根据总守恒关系:NO~4HNO 3C(HNO 3) =3()4()n NO V HNO ⨯ = 0.1040.10mol L ⨯ = 4.0mol/L(2)n(NO) =3()4n HNO = 4.0/0.204mol L L⨯ =0.20mol (3)根据电子守恒:3Cu~2NO 3Fe~2NO②比①多生成0.10molNO ,说明②比①多溶解了0.15mol 金属,若全为Fe ,则溶解了8.4g ,若全为Cu ,则溶解了9.6g ,而8.4g ﹤(18.8-9.6)g ﹤9.6g ,说明②比①多溶解了Fe和Cu,且①中溶解的全是Fe,②中剩余的金属只有Cu。
浅谈如何用“得失电子守恒法”巧解高中化学计算题

浅谈如何用“得失电子守恒法”巧解高中化学计算题作者:惠忠艳来源:《中学课程辅导·教学研究》2020年第08期摘要:得失电子守恒法是中学化学计算中一种很重要的方法与技巧,也是高考试题中应用最多的方法之一,其特点是抓住有关变化的始态和终态,忽略中间过程,利用其中某种不变量建立关系式,从而简化思路,快速解题。
關键词:得失电子守恒法;高中化学;计算题中图分类号:G633.8文献标识码:A文章编号:1992-7711(2020)04-0130“得失电子守恒法”是依据氧化还原反应的本质:电子转移(即电子的得失与偏移),同一氧化还原反应中转移电子的总数的守恒,凡是属于氧化还原反应或电化学中的计算习题,均可采用“得失电子守恒法”进行计算。
“得失电子守恒法”的理论依据为:“氧化剂得到的电子总数=还原剂失去的电子总数”。
化学计算是从量的方面来反应物质的组成、结构、性质及变化规律,它具有情境新颖、信息量大、化学知识丰富、综合性强等特点,它不仅能用来考查学生的思维能力和自学能力,还可以用来考查学生应用各方面知识进行判断、推理和分析、综合的能力、逻辑思维、抽象思维的能力。
因此,这类试题区分度较大,具有选拔优秀学生的功能。
选用合适的方法解计算题,不但可以缩短解题的时间,还有助于减小计算过程中的运算量,尽可能地降低运算过程中出错的机会。
而化学计算往往离不开“三大守恒”定律,即原子守恒(质量守恒)、得失电子守恒、电荷守恒。
守恒的实质就是利用物质变化过程中某一特定的量固定不变而找出量的关系,基于宏观统揽全局而避开细枝末节,简化步骤,方便计算。
通俗地说,就是抓住一个在变化过程中始终不变的特征量来解决问题,其目的是简化步骤,方便计算。
一、与电化学结合原电池的负极和电解池的阳极失去电子发生氧化反应;原电池的正极和电解池的阴极得电子发生还原反应;正极与负极,阴极与阳极得失电子相等。
在书写电极反应式时,还应该注意原子守恒,得失电子守恒,电荷守恒。
电子守恒法在解题中的应用

电子守恒法在解题中的应用作者:刘辉来源:《中学生数理化·教与学》2011年第02期化学计算是历年来高考理综化学考查的重点内容之一从近年高考理综化学试题的答题情况来看,计算部分往往是考生的失分点,尤其是有关氧化还原反应的计算,掌握计算方法往往能化难为易,起到事半功倍的效果氧化还原反应是中学化学学习的主线,也是高考必考的内容之一在氧化还原反应中遵循电子守恒规律,即氧化剂得到电子的物质的量(或个数)等于还原剂失电子的物质的量(或个数),若将电子守恒规律应用到解化学计算题,就可以大大简化计算过程下面通过几个例题浅谈电子守恒法在解题中的应用一、在活泼金属与酸或水反应产生氢气中的应用活泼金属与酸或水反应产生氢气这类题很常见,很多学生认为解这类题比较难,我认为根本原因是没有弄清这类反应的实质,活泼金属失电子,+1价氢得电子,而金属失电子的物质的量等于生成氢气所需得到电子的物质的量例1 A、B是同一短周期的两种元素,9gA单质跟B的气态氢化物水溶液反应,产生11.2L氢气(标准状况下),A和B可形成化合物AB3,A原子核里中子数比质子数多1请通过计算确定A、B各为哪种元素解析:根据A、B可形成化合物AB3及A单质与足量B的气态氢化物水溶液反应产生氢气,可知A为金属且在反应中化合价为+3价,n(H2)=11.2L/22.4L·mol-1=0.5mol,n(A)=9M,所以3×9M=0.5×2,故M=27g/mol;根据A原子核里中子数比质子数多1求出A为铝元素,进一步确定B为氯元素二、在金属与硝酸反应一类题中的应用例2 5.12g铜和一定质量的浓硝酸反应,当铜反应完全时,共收集到标准状况下的气体3.36L若把装有这些气体的集气瓶倒立在盛水的水槽中,需通入多少升标准状况下的氧气才能使集气瓶充满溶液?解析:该题若用常规解法,应先求出NO和NO2的物质的量,再根据化学反应方程式:4NO2+O2+2H2O=4HNO3,4NO+3O2+2H2O=4HNO3,计算O2的物质的量,并求出其体积此方法运算量大,计算步骤多且易出错可用电子守恒法解:根据题意,铜失电子的物质的量等于被还原的硝酸得电子的物质的量还等于硝酸的还原产物NO、NO2消耗的氧气得电子的物质的量,省去中间计算,即简化为:铜失电子的物质的量等于氧气得电子的物质的量所以需通入0.896L标准状况下的氧气才能使集气瓶充满溶液三、在判断氧化产物或还原产物化合价中的应用例3 12mL浓度为0.10mol/L的Na2SO3溶液,恰好与10mL浓度为0.04mol/L的K2Cr2O7溶液完全反应,通过计算确定Cr元素在还原产物中的化合价解析:该题用常规方法求解比较困难我们不知道还原产物的化学式,也写不出该反应的化学反应方程式可用电子守恒法解:在Na2SO3与K2Cr2O7发生氧化还原反应中,Na2SO3是还原剂,1molNa2SO3失2mol电子,K2Cr2O7是氧化剂得电子,两者得失电子物质的量相等设还原产物中Cr元素的化合价为x.则0.012L×0.1mol/L×2=0.01L×0.04mol/L×2×(6-x)x=3所以Cr元素在还原产物中的化合价为+3价四、在电解电解质溶液中的应用例4 以惰性电极电解CuSO4溶液,若阳极上产生气体的物质的量为0.0100mol,则阴极上析出Cu的质量为()A.0.64gB.1.28gC.2.56gD.5.12g解析:常规解法是根据电解原理,以惰性电极电解溶液,在阳极上产生的气体为O2,要想计算出Cu的质量,先写出电解反应方程式2CuSO4+2H2O=2Cu+O2↑+2H2SO4,找出氧气与铜的关系,计算铜的物质的量为0.02mol,再确定铜的质量为1.28g,电解方程式比较复杂,这样处理容易出错且浪费时间可用电子守恒法:电解时阳极失去电子总数与阴极得到电子总数相等,可得:0.0100mol×4=n(Cu)×2,再计算铜的质量为1.28g答案为B五、在判断不熟悉反应中氧化与还原产物的物质的量之比中的应用例5 (NH4)2SO4在强热的条件下分解,生成NH3、SO2、N2和H2O,试求反应中SO2和N2的物质的量之比解析:常规解法:先写出(NH4)2SO4分解的反应方程式,然后配平,最后求解,这种解法耗时较多可用电子守恒法:分析发现,SO2是还原产物、N2是氧化产物,生成SO2得到电子的物质的量应等于生成N2失去电子的物质的量;生成1molSO2得2mol电子,生成1molN2失6mol电子,所以SO2与N2的物质的量之比为3∶1。
得失电子守恒在计算中的应用

As2 O3 的质量分数的实验过程如下:
解得:b = 3ꎬ答案选 B.
AsO 、AsO34 - 的混合溶液 100mL.
4) × 0. 05molL - 1 × 0. 024L
a. 称取 m g 粗产品溶解于 NaOH 溶液ꎬ得到含
3-
3
例 2 Na2 S x 在碱性溶液中可被 NaClO 氧化为
数ꎬ图 3 数据误差较大ꎬ删除该数据ꎬ再由图 2 和图
+5
+4
+5
+2
氧化剂:N → N 得(5 - 4) n( N)
N → N 得(5 - 2) n( N)
+1
+2
4 数据求平均数得消耗 I2 标准溶液 20mLꎻ氧化剂中
还原剂:Cu→Cu 失(2 - 1) n( Cu)
升高到 + 5 价.
— 138 —
2
)n(S)
x
b. 分 别 移 取 25. 00mL 上 述 溶 液ꎬ 用
0. 02500molL - 1 的 I2 标 准 溶 液 进 行 滴 定 ( I2 将
AsO33 - 氧化为 AsO34 - ꎬ淀粉溶液为指示剂) . 每次滴
定开始时液面读数如图 1 所示ꎬ三次滴定结束时ꎬI2
= 2. 5 mol + 2. 5 mol + 2 mol = 7 mol. 答案选 A.
上述通过实例分别阐述了基础版、升级版和高
级版等量关系式的用法. 并且对于基础版部分做了
=
n( As2 O3 ) 总 M
1. 0 × 10 - 3 mol × 198gmol - 1
=
=
mg
mg
0. 198
× 100%
化合价由 + 5 降低到 + 4、由 + 5 降低到 + 2ꎻ还原剂
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
利用电子守恒法巧解化学计算题
氧化还原反应是中学化学学习的重点和难点,也是历年高考热点之一。
从近几年高考试题的走向来看,出现了一种难度较大,以考查能力为导向的新题型:求氧化产物和还原产物的物质的量的比;给出陌生的物质,判断反应后的化合价或是否是氧化产物、还原产物等。
尽管形式千变万化,但都离不开判断化合价的升降、电子的转移、电子数的守恒。
下面仅通过几个实例,谈谈电子守恒法在化学计算中的应用。
一、判断氧化产物或还原产物的化合价
例1.24 ml浓度为0.05 mol·l-1的na2so3溶液,恰好与20 ml浓度为0.02 mol·l-1的k2cr2o7溶液完全反应,则cr元素在还原产物中的化合价为()
a.+6
b.+3
c.+2
d.0
解析:反应中cr元素的化合价变化为2×(6-x),s元素的化合价变化为6-4=2。
20×10-3×0.02×2×(6-x)=24
×10-3×0.05×2,则x=3。
答案:b。
二、省去中间过程,简化计算
例2.3.84 g铜和一定质量的浓硝酸反应,当铜反应完时,共收集到标准状况下的气体2.24 l,若把装有这些气体的集气瓶倒立在盛水的水槽中,需通入多少升标准状况下的氧气才能使集气瓶充满
溶液?
解析:铜失的电子数=被还原的硝酸得的电子数=氧化硝酸的还原产物no,no2消耗的氧气得的电子数,省去中间计算,得:铜失的电子数=氧气得的电子数。
则n(o2)=3.84 g÷64 g·mol-1×2×1/4=0.03 mol
v(o2)=0.03 mol×22.4 l·mol-1=0.672 l若用常规解法,应先求出no,no2的物质的量,再根据:
4no2+o2+2h2o=4hno3
4no+3o2+2h2o=4hno3
计算出o2的物质的量,并求出其体积,此方法运算量大,中间计算多且复杂,容易出错,用电子守恒法综合考虑,可省去中间的各步计算,使计算简化。
三、在电解类题中的应用
例3.用两支惰性电极插入500 mlagno3溶液中,通电电解,当电解液的ph从6.0变为3.0时(设电解时阴极没有h2析出,且电解前后溶液体积不变),电极上应析出银的质量是()a.27 mg b.54 mg
c.108 mg
d.216 mg
解析:根据得失电子守恒写出电极反应式:
阴极:4ag++4e=4ag
阳极:2h2o-4e=o2+4h+
可知:ag+—h+
1 mol 1 mol
x(1×10-3×0.5-1×10-6×0.5)mol
x=5×10-4mol
则析出银的质量为:
5×10-4mol×108 g·mol-1=5.4×10-2 g=
54 mg
四、在产物不确定类题中的应用
例4.10 g fe-mg合金溶解在一定量的某浓度的稀硝酸中,当金属完全反应后,收集到4.48 lno气体(设hno3的还原产物只有no)。
在反应后的溶液中加入足量的naoh溶液,可得多少克沉淀?
解析:该反应中fe的变价无法确定,用常规法得讨论计算。
仔细审题后发现,mg,fe失电子数等于氮元素得电子数。
n失=n得=4.48 l÷22.4 l·mol-1×3=0.6 mol
fe,mg失电子后的阳离子所带正电荷共为0.6 mol,它也等于沉淀该阳离子所需oh-的物质的量。
即n(oh-)=0.6 mol。
m沉淀=m阳+m(oh-)
=10 g+0.6 mol×17 g·mol-1
=20.2 g
得失电子守恒的规律是解氧化还原类题的一把钥匙,运用电子守恒法可以快速准确地解决问题,提高学生分析问题和解决问题的能力。
(作者单位河北赵县实验中学)。
