第四章碳碳双键的加成反应
碳碳双键的加成原理

碳碳双键的加成原理碳碳双键的加成原理是有机化学中的一个重要概念,它指的是在碳碳双键上进行化学反应时,发生的两个原子团的直接相互作用。
碳碳双键是有机化合物中常见的结构基团,其反应机理的理解对于有机合成和有机反应的研究具有重要意义。
碳碳双键的加成反应是指在碳碳双键上发生的加成反应,其中一个或多个原子或基团与双键上的两个碳原子形成新的化学键。
这种反应可以在碳碳双键上的任何一个碳原子上进行,形成两个不同的反应产物。
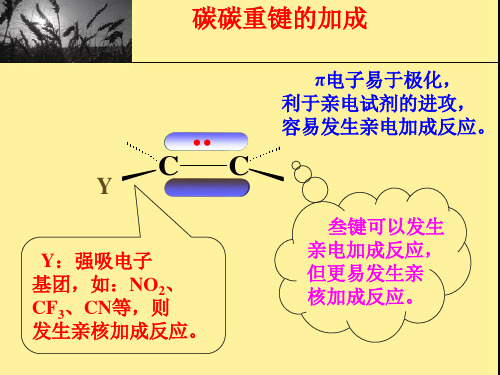
碳碳双键的加成反应可以分为电子亲攻型加成反应和亲电型加成反应两种基本类型。
电子亲攻型加成反应是指一个原子或基团通过共用电子对与双键上的一个碳原子形成新的化学键。
在这类反应中,一般会形成一个新的碳碳单键,同时产生一个带正电荷的中间体。
这类反应通常涉及碳原子上的π电子云的重排,常见的例子包括烯烃的氢化反应、卤代烃的消除反应等。
亲电型加成反应是指一个带正电荷的原子或基团与双键上的一个碳原子形成新的化学键。
在这类反应中,通常会形成一个新的碳碳单键,同时产生一个带负电荷的中间体。
这类反应通常涉及碳原子上的π电子云的离域,常见的例子包括烯烃的酸催化加成反应、烯烃的卤代反应等。
碳碳双键的加成原理是通过共用电子对或电荷分布的重新排列实现的。
在共用电子对的重新排列中,双键上的π电子云会重新组合,形成一个新的σ键。
在电荷分布的重新排列中,双键上的π电子云会向带正电荷或带负电荷的原子或基团转移,形成新的化学键。
碳碳双键的加成反应在有机化学中具有广泛的应用。
它可以用于构建碳骨架,形成新的化学键,实现有机物的合成。
通过选择不同的反应条件和反应物,可以控制加成反应的位置和产物的选择性。
此外,加成反应还可以用于合成复杂有机分子,如天然产物、药物和材料等。
碳碳双键的加成原理是有机化学中重要的基础概念。
通过了解和掌握加成反应的原理和机制,可以为有机合成和有机反应的研究提供理论基础和实验指导,推动有机化学领域的发展和应用。
碳碳双键发生的化学反应

碳碳双键发生的化学反应
碳碳双键是由两个碳原子共享四个电子而形成的共轭键。
它们可以参与许多化学反应,下面是一些常见的碳碳双键反应:
1. 加成反应:在加成反应中,一个或多个试剂添加到碳碳双键上,形成新的化学键。
例如,在氢化反应中,氢气(H2)可以加成到碳碳双键上,生成饱和的碳碳单键。
2. 消除反应:消除反应是碳碳双键断裂的反应,通常伴随着新的化学键的形成。
一个常见的消除反应是脱水反应,在这个反应中,碳碳双键上的一个碳原子失去一个水分子(H2O),形成一个新的双键。
3. 氧化反应:碳碳双键可以被氧化剂氧化,形成含有更多氧原子的化合物。
例如,碳碳双键可以被酸性高锰酸钾(KMnO4)氧化为羧酸。
4. 还原反应:碳碳双键可以被还原剂还原,减少为含有更少氧原子的化合物。
一个常见的还原反应是烷基化反应,其中碳碳双键上的一个碳原子被氢原子取代。
这只是碳碳双键可以发生的一些典型化学反应的例子,实际上有许多不同类型的反应都可以涉及到碳碳双键。
具体的反应类型和机理取决于反应条件和试剂的选择。
第四章碳氧双键的加成反应2
OH 90%
CH3
C6H5 1%
+ CH3CH=CH-C-C6H5 CH3CH-CH-CO-CH3
OH <1%
C6H5 37%
b)亲核试剂:
O C6H5-CH=CH-C-C6H5
OH
O
+ C6H5-CH=CH-C-(C6H5)2 C6H5-CH-CH2-C-C6H5
1,2加成
C6H5 1,4加成
C6H5MgBr
2.历程:
Wittig 反应经由两个阶段,(1)Wittig 试剂对羰基进行亲核
加成,(2)中间产物受热消除Ph3PO,生成烯烃。
如:
+
+ R1R2C O
Ph3P
-
CHR
R1 R2
C
CHR +
Ph3PO
R1 O
C R2 HC
P+Ph3
R
R1 O C
R2 HC R
PPh3
O
+-
加成
+ Ph3P CHR
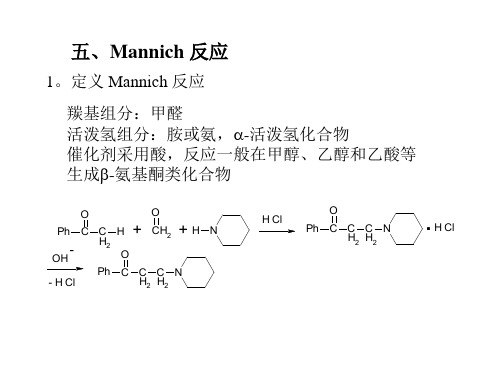
1.羟醛缩合是醛酮自身作为活泼氢组分。 2.Knoevenagel反应是以活泼亚甲基化合物为活泼氢组分 3.Stobbe 反应以丁二酸酯为活泼氢组分 4.Darzens缩合以-卤代酸酯为活泼氢组分 5.Mannich反应是但对羰基的亲核进攻,羰基为醛 6.Micheal 反应是,-不饱和羰基化合物为羰基组分,碳 负离子对它的亲核进攻(加成)
H2 H2
CH2 + HN.R2'
H Cl
水解
O
R
C
C H2
C H2
CH2COOH
所以,Mannich反应可以生成比原来酮多一个碳的,- 不 饱和酮,生成氨基醇,生成酮酸。
碳氧双键的加成反应

反应一般式如下:
OO
ArCHO + RCH2COCCH2R RCH2COO
H COOH C C + RCH2COOH
Ar R
反应机理:
-B RCH2COCCH2R
OO
ArCHO
OO
RCH2COCCHR
RCH2COCCHCHAr
OR
13
Ar
H2CR O CH
C
CHR
O OC
反应机理如下:
8
半缩醛或半缩酮继续与一分子醇反应形成缩醛或缩酮
9
3、羟醛缩合反应 含有α氢的羰基化合物在酸或碱的催化作用下,
缩合形成β-羟基醛或β-羟基酮的反应称为羟醛缩合 反应
H
O C CH2 H
CH3CH O
O C CH2 H
OO CH3CHCH2CH3
H2O
OH
H2C
C H
CH
22
OH
H2C
C H
CH
+ Cl
OH
ClH2C
C H
CH
O H2 ClH2C C CH
一般只进行1,4-亲电加成反应,因为其产物具有不稳定的烯醇 结构,经重排得到稳定的酮式结构,而1,2-加成产物不稳定
一般情况下,α, β-不饱和羰基化合物在进行1,4-亲电加成时, 正性基团加到α-碳原子上,负性基团加到β-碳原子上 例如:
1、羧酸衍生物与亲核试剂的加成反应
反应机理如下:
R CO
L
H
Nu
Nu H
RCO
L
Nu RCO HL
Nu C O + HL
R
18
反应活性:
第四章 碳碳双键的加成反应

+
CH3 CH3
反式( ) 顺式( ) 反式(dl) 顺式(dl) 50% 50% 4.2.3 不对称加成规则 不对称烯烃与不对称试剂的加成具有区域选择性, 不对称烯烃与不对称试剂的加成具有区域选择性 , 马氏加成。形成了较稳定的碳正离子。 为马氏加成。形成了较稳定的碳正离子。 试剂中带部分正电的原子或基团加到具有较多负 电荷双键碳上。 电荷双键碳上。
第四章 碳碳双键的加成反应
高等有机化学
加成反应:催化氢化、亲电加成、 加成反应:催化氢化、亲电加成、亲核加成和自由基 加成。 加成。 4.1 催化氢化 催化氢化分为非均相催化(多相催化) 均相催化。 催化氢化分为非均相催化(多相催化)和均相催化。 非均相催化 非均相催化的催化剂为固体, 非均相催化的催化剂为固体,均相催化的催化剂溶于 介质成液相,整个反应体系为一相。 介质成液相,整个反应体系为一相。 4.1.1 多相催化氢化 氢和烯烃吸附在催化剂表面, 键和H-H键断裂,形 键断裂, 氢和烯烃吸附在催化剂表面,使π键和 键和 键断裂 成金属氢化物和配合物, 成金属氢化物和配合物,氢原子再分别转移到双键碳 原子. 原子 立体化学为顺式加成,反应收率高,速度快。 立体化学为顺式加成,反应收率高,速度快。
CH3CH CH2 + HBr
过氧化 物
CH3CH2CH2Br
稳定性: 稳定性 旋转. 旋转
CH3CHCH2Br > CH3CHBrCH2
H3 C
CH2Br
溴亚甲基为供电子基:+C’ > -I 溴亚甲基为供电子基:
4.2.4 烯烃的羟汞化-脱汞反应 烯烃的羟汞化-
加成方向为马氏加成,是合成醇一种常用方法。 加成方向为马氏加成,是合成醇一种常用方法。
第四章羰基化合物的反应及碳负离子

OR
C
+
C
OR
OR H
+
OR H + H
缩酮
举例:
与其它亲核试剂的加成反应:
HCN、NaSO3H、RMgX
与亲核试剂加成-消除反应:
RNH2、HONH2、NH2NHR、 亚胺 肟 腙
羰基加成的立体化学:
1)若R、R’不含手性碳,则加成产物为外消旋体。
R
Nu
R'
C
O
R
R'
C
O
Nu
sp2杂化 平面三角型
sp3杂化 四面体
羰基加成的立体化学:
2)若羰基的邻近碳原子有手性,亲核加成遵循Cram规则
Nu
C M C OH
Cram规则-1
S
L
C M C
R
+
O
+ H Nu
L S
R
Et Ph
O
H
1) LiAlH4 2) H2O
Et HO
H
H CH3
CH3
Ph
羰基加成的立体化学:
Cram规则-2
L O R O
+ +
CH2
-
Ph3 P (CH3)2S
CH2 C H2
(CH3)2S PhLi
C H2 CH2
季铵盐:(CH ) N + Cl 反应活性:
(CH3)2S
+ (CH3)3 N
+
C H2 > Ph3P
-
+
-
CH2
+ > > (CH3)3 N
CH2
2) S电子成分效应
亲核加成反应
加成方向遵守克拉姆(Cram)规则
Cram规则——设α -手性碳原子上所连的三个基团 分别用L、M、S代表其大、中、小,则加成时Nu 主要从最小基团S一侧进攻最为有利,生成的产物 为主要产物。
20%KOH水溶液 ,P
CH2=CH-OCH 3
甲氧基乙烯 or甲基乙烯基醚
强亲核试剂
在碱性条件下,有:
CH3OH + KOH CH3OK + H 2O
可离解为
CH3O-带有负电荷,是一个强的亲核试剂:
CH3O- + K +
CH CH + CH 3O-
HC-=CH-OCH 3 CH3OH
CH2=CH-OCH 3 + CH 3O-
C2H5ONa
H-C=CH-COOC2H5 CH3COCHCOOC2H5
O
d
Micheal反应的应用
O O + O2N OH O CH=CH-COCH3 O O O CH OH CH2 COCH3 O NO2
130℃
O H3C
CH3
O CCH3
O
CH3 CH2CH2
NaOEt EtOH
O CCH3
羰基质子化,可以提高羰基的反应活性, 羰基质子化后,氧上带有正电荷,很不稳定, π电子发生转移,使碳原子带有正电荷。 决定反应速率的一步,是Nu -进攻中心碳原子的 一步。
酸除了活化羰基外,还能与羰基形成氢键:
δ δ
C O H Cl
质子化增强羰基碳正离子 的正电性,促进亲核试剂 进攻,都使羰基活化。
+
-
C C=O Cl H
>
CH3-C=O H
2. 试剂的亲核性
第四章 加成反应

②
4.2.3. 亲核加成反应的实例 1. Wittig 反应
Wittig 试剂与羰基发生亲核加成反应,生成烯烃:
C O
Ph3P C
R R'
R C C R'
2. 羟醛缩合
CH3CHO + CH3CHO
OH
O CH3CHCH2C H OH
3. Claisen 酯缩合反应及相关反应
两个酯分子至少有一个酯分子是含有α-氢,在 强碱的作用下,相互缩合成β-羰基酯。
例如溴与烯烃的加成反应。烯烃与溴首先生成π络合物, 然后Br+对π键进行亲电加成生成三元环状正离子中间体-溴 鎓离子,最后Br-从体积较大的溴鎓离子反面进攻原双键碳 原子之一,生成1,2-二溴化物。
H CH3 Br2 H CH3 Br Br- H CH3 H Br CH3 Br Br H CH3 H CH3 H CH3 H CH3 H Br H Br CH3 -Br- Br CH3
典型代表:Cl2、Br2、I2、HOCl、HOBr等与烯烃的亲 电加成反应。
2、三分子亲电加成
Y
2E
E
Y
C C
+ Y
Y+ C C Y
C C E
E
E
一般来说,烯烃与卤化氢的加成,若生成比较不稳定的 正碳离子时,则倾向于按AdE3历程进行,加成的立体化学 特征是反式加成。
4.1.2 亲电加成反应立体化学
Nu E 顺和反异构体
(1)正碳离子历程
a、若生成的正碳离子中间体的正电荷能够在碳骨架中发生 离域,则有利于按正碳离子历程进行; 典型代表:卤化氢、溴和氯与双键碳原子上连有苯基的烯烃 所进行的加成反应。
解释3,3-二甲基-1-丁烯与卤化氢的加成得到2,3-二甲基2-卤丁烷的历程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
加成反应包括,催化氢化、亲电加成、亲核加成和自由基加成。
4.1催化氢化
催化氢化分为非均相催化(多相催化)和均相催化。
非均相催化的催化剂为固体,均相催化的催化剂溶于介质成液相,整个反应体系为一相。
4.1.1多相催化氢化
氢分子和烯烃吸附在催化剂表面,使π键和H-H键断裂,形成金属氢化物和配合物,然后氢原子再分别转移溶剂双键碳原子,故其立体化学为顺式加成,该反应收率高,速度快。
试剂中带部分正电的部分加到具有较多负电荷双键碳上。
供电子基:+C’>-I,是合成醇一种常用方法。
历程
特点是不含发生重排反应。
4.2.5硼氢化反应
顺式的反马氏加成(形成与结果),事实上是马氏加成。
用这种方法,可以用末端烯烃来合成伯醇。
另一个特点是不会发生重排反应。
溶剂的种类和极性,反应体系的酸碱性均能影响催化氢化的反应速度的选择性。
C2H5OH 57%47%
C2H5OH+HCl(10%) 93% 7%
乙醇中几乎没有选择性。
4.2亲电加成
4.2.1亲电加成反应的历程
实验事实:1.乙烯和溴在NaCl水溶液中发生了混杂加成,说明反应是分步进行。而且有C+中间体。
2. 2,3-二甲醛丁烯二酸钠水溶液与Br2作用得溴代苹果酸的β-内酯,说明C+中间体存在,反应是分步。
4.底物结构
空阻大的底物催化氢化比较困难。
活性(含有电子效应作用的结果)
RCOCl (RCHO) > RNO2(R-NH2) > (RCH=CHR’) > RCHO(RCHOH)>RCH=CHR’(RCH2CH2R’)>RCOR’(RC(OH)HR’>ArCH2OR (ArCH3) >RCN (RCH2NH2)
2.压力
增加氢气压力相当于提高氢气浓度,从而有利于氢化的进行,但选择性降低,如Lindlar催化剂,常压生成烯,加压为烷烃。
3.催化剂
不同催化剂对同一反应的催化活性不同,同一反应用不同的催化剂,其产物可能不一样。
催化剂的活性与比表面、载体、助催化剂和抑制剂有关,催化剂的比表面越大,活性越高,载体的作用是提高催化剂的分散度,增加催化剂的稳定性和比表面。助催化剂能提高催化剂活性,而抑制剂可部分降低催化剂活性。
历程,链引发
链增长
链终止
而CHBr3是C-Br断裂,CHCl3中是C-H键断裂, 是共轭稳定。
3、加醛
合成酮
4.4烯烃的亲核加成反应
当烯烃的双键碳上带有强的吸电基时可以发生亲核加成。
不反应
历程
碳负离子无立体选择性
烯烃双键碳上带有的吸电基越多,中间体碳负离子越稳定,反应越容易发生,反应无立体选择性。
Michael加成:
有时为了提高催化剂的催化性能,常加入惰性载体的活性炭、碳酸钙等。
4.1.2影响催化氢化反应的因素
1.温度
(1)升高温度有利于氢化反应,但氢化反应的选择降低。
(2)氢化反应为放热反应,升高温度有利于逆反应,降低转化率。
(3)升温加速催化剂的失活,增加副反应。
因此,若催化剂有足够的活性时,氢化反应尽可能在低温下进行。
4.2.6烯烃与卡宾的加成反应
卡宾又叫碳烯,它是价电子层中只有6个电子的二价碳原子,它是一种亲电试剂,与烯烃反应得环丙烷衍生物,分为单线态和三线态。
三线态为双自由基形式
单线态与烯烃加成时的立体化学为顺式加成(立体专一性)。
顺式一步协同反应反式
三线态卡宾的加成反应为分步反应,几乎无立体选择性。
4.3自由基加成
4.3.1自由基的产生与自由基加成历程
一、自由基的产生
1、光解
过氧化苯甲酰
激发态
2、热解
温度一般为50-150℃,共价键发生均裂。
偶氮二异丁晴
3、氧化还原反应(发生单电子转移)
二、自由基加成历程
包括链引发、链增长和链传递,在链增长阶段要消耗一个自由基就产生一个自由基,活化能很小。
4.3.2自由基加成反应的方向
4.2.2亲电加成的立体化学
1.通过溴鎓离子的反式加成
meso
2.通过碳正离子的反式加成为主的历程
(这时的碳正离子较稳定)
苏式产物相当于反式加成,赤式产物相当于顺式加成。
3.通过平面碳正离子中间体的非立体选择性加成
反式(dl)顺式(dl)
50% 50%
4.2.3不对称加成规则
不对称烯烃与不对称试剂的加成是具有区域选择性,为马氏加成。形成了较稳定的碳正离子。
稳定性:
烯烃的自由基加成无立体选择性,中间体可绕C-Cσ键旋转,而三键的加成是反式加成(反马氏)
4.3.3烯烃的自由基加成
1、加卤素
在非极性溶剂或气相条件下,卤素在光照下与烯烃发生自由基加成。
链引发:
链增长
链终止:
(主要)
选择性试剂NBS、NBC可避免加成反应,发生-H的卤代反应。
2、加多卤甲烷
多卤甲烷CCl4,CBr4,CBrCl3,CHCl3,CHBr3,CHBrCl2,CHI3等均与烯烷发生自由基加成。
