第七章消除反应完
第七章 卤代烃亲核取代和β-消除

(C有H3助)3C于Br 1分×散10电8
荷,使
=
CH2=CCHH2–=CCHH2+>R3C+>R2CH+>RCCHH2 2+>CH过 稳3+渡 定态 。
按SN2反应活性:烯丙型>CH3X >伯>仲>叔>乙烯型
CH3Br CH3CH2Br (CH3)2CHBr (CH3)3CBr
SN2速率 150
1.0
CH3CH2Br CH3CH2CH2Br (CH3)2CHCH2Br (CH3)3CCH2Br
1.0
0.28
0.030
0.000042
《有机化学》教学课件(76-04-首页
凡是有利于生成C+,使C+稳定的因素,都有利于SN1。 ① R–X + AgNO3 乙醇 R–ONO2 + AgX↓ 反应活性:叔>仲>伯>CH3X (都按SN1反应) Ag+能够促使C+的生成 极性溶剂,通过溶剂化作 用使C+稳定 ② R–X + NaI 丙酮 R–I + NaX
0.01
0.001
用空间效应解释——空间阻碍越大,越不利于SN2。
《有机化学》教学课件(76-04-1.0版)—第十九讲
不同烃基结构的反应趋势
R3CX SN1
R2CHX
RCH2X
返回首页
SN2 CH3X
SN1
SN1 SN2
SN2
CH3 CH3C–CH2Br
H2O
? SN1 、SN2
CH3
空间阻碍对SN2反应速率的影响
–CH2CH2CH3 Br2
hv
–CH=CHCH3
碱性:C2H5ONa>NaOH
大学分析化学第七章氧化还原滴定

Fe3++e-
Fe2
E' Fe(III)/Fe(II)
0.68V
化学计量点 后
化学计量点 前
E
Eθ' Ce(IV)/Ce(III)
0.059Vlg
cCe(IV) cCe(III)
E
Eθ' Fe(III)/Fe(II)
0.059Vlg
cFe(III) cFe(II1)7
化学计量点
E sp n 1 E n 1 1 ' n n 2 2 E 2 ' ( 适 用 于 两 个 电 对 都 是 对 称 电 对 ) E sp11.4V 4 1 1 10.6V 81.06V
试剂存在,则从Eθ′的定义式可见,副反应系数必然改变。 副反应系数改变又必然引起Eθ′和E改变。
Eθ Fe3+/Fe2+
0.77V
2Fe3++2I-=2Fe2++I2
Eθ I2/I-
0.54V
10
(四)沉淀的生成
对于某一电对,如果加入一种可以与氧化型或还原 型生成沉淀的试剂时,将会改变氧化型或还原型的浓度, 从而改变电极电位.
n
c red red ox
E
E 0.059V lg ox red 0.059V lg cox
ox / red
ox / red
n
red ox
n
cred
E
E ' 0.059V lg cox
ox / red
ox / red
n
cred
6
E
E 0.059V lg ox red 0.059V lg cox
对上述滴定选用何种指示剂?
第七章卤代烃

CH3CH2OH + HBr
在一般情况下,此反应很慢。为增大反应速率,提高醇的产 率,常加入强碱(氢氧化钠),使生成的HX与强碱反应,可 加速反应并提高了醇的产率。
CH3CH2Br + NaOH
CH3CH2OH + NaBr
• 此反应工业用途不大,因卤烷在工业上是由醇制取,但可用 于有机合成中官能团的转化。用于复杂分子中引入羟基(先 卤代,再水解)。
醇 R-X + AgNO3
R-O NO2 + AgX 硝酸酯
反应通式如下:
R - L + :Nu RCH2X + -OH 反应物 亲核试剂 (底物) 进攻基团
R - Nu + L-
RCH2-OH + X-
产物
离去基团
1. 卤烃的水解
• 卤代烷与水作用,水解为醇,反应是可逆反应。如:
CH3CH2Br + H2O
• 查依采夫规则: • 卤代烷脱HX时,总是从含H较少的碳上脱去H原子。
Saytzeff规则应用
CH3
CH3
KOH / 醇
CH3 CH C CH2
CH3 CH C CH3 71%
CH3
H Br H
CH3 CH2 C CH2 29%
• Saytzeff规则的实质上是生成一个较稳定的烯烃。
• 总是要生成共轭效果较好的结构(较稳定)。如:
•而仲卤烃和叔卤烃在碱(氰化钠、氰化钾)的作用
下易发生消除反应,生成烯烃,此反应一般不用仲、 叔卤烃反应。
•产物腈还可转化为胺、酰胺和羧酸。
4. 卤烃的氨解
• 此反应既可用氨反应,也可用氨的衍生物反应,来 制取伯、仲、叔胺。
第七章功能高分子的制备方法

第七章 功能高分子的制备方法
2. 环醚的开环聚合 环醚主要是指环氧乙烷、环氧丙烷、四氢呋喃
等。它们的聚合物都是制备聚氨酯的重要原料。 环氧乙烷和环氧丙烷都是三元环,可进行阴离
子聚合和阳离子聚合。四苯基卟啉/烷基氯化铝可引 发他们进行阴离子活性开环聚合。
17
第七章 功能高分子的制备方法
四氢呋喃为四元环,较稳定,阴离子聚合不能 进行,而只能进行阳离子聚合。碳阳离子与较大的 反离子组成的引发剂可引发四氢呋喃的阳离子活性 聚合。例如 Ph3C+SbF6- 可在-58℃下引发四氢呋 喃聚合,产物的相对分子质量分散指数为1.04。
第七章 功能高分子的制备方法
功能高分子材料的制备是通过化学或者物理的 方法按照材料的设计要求将功能基与高分子骨架相 结合,从而实现预定功能的。
从上一世纪50年代起,活性聚合等一大批高分 子合成新方法的出现,为高分子的分子结构设计提 供了强有力的手段,功能高分子的制备越来越 “随 心所欲”。
1
第七章 功能高分子的制备方法
7.2 高分子合成新技术
7.2.1 活性与可控聚合的概念 活性聚合是1956年美国科学家Szwarc等人在研
究萘钠在四氢呋喃中引发苯乙烯聚合时发现的一种 具有划时代意义的聚合反应。其中阴离子活性聚合 是最早被人们发现,而且是目前唯一一个得到工业 应用的活性聚合方法。目前这一领域已经成为高分 子科学中最受科学界和工业界关注的热点话题。
8
第七章 功能高分子的制备方法
7.2.3 阳离子活性聚合 阳离子聚合出现于20世纪40年代,典型工业产
品有聚异丁烯和丁基橡胶。 阳离子活性中心的稳定性极差,聚合过程不易
控制。多年来阳离子活性聚合的探索研究一直在艰 难地进行。
第七章 还原反应

7.1 催化氢化
催化氢化:分子氢在催化剂作用下,将不饱和 键或基团转化为饱和键与基团的还原反应。
优点:反应定向进行,副反应少、产品质量好、
产率高。生产能力大,对解决环境污染问 题有明显的优越性。 缺点:对生产装置和工业控制的要求较高, 需要优良的催化剂和氢气来源。
机理:首先,在催化剂作用下氢气分解为氢原子、 并吸附在催化剂上。其次,氢原子进攻烯烃双键 碳,使烯烃双键打开,氢原子与其中一个碳原子 成键,另一个吸附在催化剂上的氢原子也与另一
酯族化合物。
N Na EtOH N PhCOCl NaOH N COPh 77-81%
COOH OH
Na , -C5H11OH
COOH COOH 43-50%
OH Li-NH3-EtOH
OH
苯环上有推电子基团,如烃基、烷氧基、胺
基等时,使苯环钝化(苯甲醚除外),致使质子
化发生在2,5位,得3,6-二氢化物。
+ 2CH 3CH 2ONa
2CH 3CH2OH H
H
苯甲醚用金属钠在液氨中还原得到3,6-二氢苯甲醚,
在酸性溶液中水解,经酸催化异构化可得环己烯-3-酮。 典型还原反应可用于(±)硫辛酸的合成。
OCH3 (1)BuLi (2) CH2 CH2 O OCH3 CH2CH2OH Na , NH3 EtOH OCH3 CH2CH2OH
还原。
在精细有机合成中,以化学还原法为主。有
机分子中的氢化反应是所有合成中发展水
平最高的反应。其选择性方面的知识也是
遥遥领先。
还原剂:氢气。低价金属盐,如TiCl3, TiCl2等。
还原性的金属:Li,Na,Mg,Ca,Zn
金属或金属配位催化剂:Ni,Pd,Pt,Ru, Rh, LiAlH4,NaBH4,B2H6 低价态化合物:(N2H4, N2H2,Ph3P,MeS, Na2S2O4,HO-CH2-SO3Na即SFS)。 催化剂活性:Pt>Rh>Ni>Ru, 反应速率跟压力、温度及溶剂有关。
第七章 消除反应

υ=k[RX][B:-]
双分子消除历程,二级反应
2. 反应活性(Reaction activity )
离去基团:RI > RBr > RCl
(与SN2反应相同)
进攻试剂的碱性越强,则反应活性越高。 如:HO﹣ > CH3COO﹣ (与SN2反应有所不同) 反应底物卤代烃的活性: 3º >1º >2º
1. 羧酸酯的热消除:
在无外加试剂存在下,通过加热,失去β-氢和羧 酸根,生成烯烃。
H O H O C H R R H H O + H O C R
R
H
H O
H C R
R
H
H
H O
反应特点:1) 高温,不需碱作催化剂 2) 环状过渡态机理 3) 通常是顺式消除。
环状化合物(Ⅰ)的热消除,只得化合 物(Ⅱ),为顺式消除。
(I) (II)
L
(2)
L: S(CH3)2 I / II 6.7
底物结构的影响
N(CH3)3 ~50
(CH3)3CCH2C(CH3)2 Br
EtO
(CH3)3CCH2C CH2 CH3
4.立体化学( Stereochemistry)
消除反应立体化学的确立:
(1)反应物中H和L 的空间关系:H和L可 在C-C键的两侧或同一侧,分别称为反式消 除和顺式消除。 (2)产物中取代基的空间关系:反应产物 是以顺式还是反式异构体为主
第七章 消除反应
Elimination Reaction
定义: 消除反应:是指从有机分子中消除去一个 小分子或两个原子或基团,生成双键、叁 键或环状结构化合物的反应。 分类: (1)α-消除(或1,1-消除)反应 H
第七章 配合物反应动力学
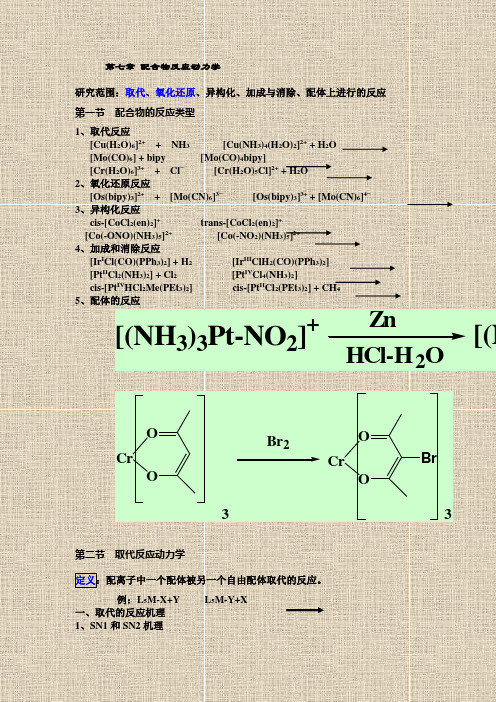
第七章配合物反应动力学研究范围:取代、氧化还原、异构化、加成与消除、配体上进行的反应第一节配合物的反应类型1、取代反应[Cu(H2O)6]2++ NH3 [Cu(NH3)4(H2O)2]2+ + H2O[Mo(CO)6] + bipy [Mo(CO)4bipy][Cr(H2O)6]3++ Cl−[Cr(H2O)5Cl]2+ + H2O2、氧化还原反应[Os(bipy)3]2++ [Mo(CN)6]3−[Os(bipy)3]3+ + [Mo(CN)6]4−3、异构化反应cis-[CoCl2(en)2]+trans-[CoCl2(en)2]+[Co(-ONO)(NH3)5]2+[Co(-NO2)(NH3)5]2+4、加成和消除反应[Ir I Cl(CO)(PPh3)2] + H2[Ir III ClH2(CO)(PPh3)2][Pt II Cl2(NH3)2] + Cl2[Pt IV Cl4(NH3)2]cis-[Pt IV HCl2Me(PEt3)2] cis-[Pt II Cl2(PEt3)2] + CH45、配体的反应ZnHCl-H2O [(NH3)3Pt-NO2]+[(NCrOOCrOOBrBr233第二节取代反应动力学定义:配离子中一个配体被另一个自由配体取代的反应。
例:L5M-X+Y L5M-Y+X一、取代的反应机理1、SN1和SN2机理(1)离解机理(SN1机理)慢a.L5M-X = L5M + X(配位数下降6 5)b.L5M + Y = L5M-Y速率方程:d[L5M-Y]/dt = k[L5M-X]速率与Y浓度无关,是对[L5M-X]的一级反应。
(2)缔合机理(SN2机理)慢a、L5M-X + Y = L5MXY(配位数升高6 7)b、L5MXY = L5M-Y + Xd[L5M-Y]/dt = k[L5M-X][Y]属于二级反应。
* SN1和SN2是两种极限情況。
二.活性与惰性配合物及理论解释1、活性与惰性配合物1)定义:配体可被快速取代的配合物,称为活性配合物;配体取代缓慢的配合物,称为惰性配合物划分标准:配合物与反应试剂(浓度均为0.1M)在25℃时反应,t1/2>1min,称为惰性配合物;t1/2<1min,称为活性配合物。
第七章卤代烃(修改)

CH3CH2CH2 O CH2CH3 + NaI 混合醚
该法是合成不对称醚的常用方法, 该法是合成不对称醚的常用方法,称为 Williamson (威廉逊)合成法。该法也常用于合成硫醚或芳醚。 威廉逊)合成法。该法也常用于合成硫醚或芳醚。 采用该法以伯卤烷效果最好,仲卤烷效果较差, 采用该法以伯卤烷效果最好,仲卤烷效果较差,但 伯卤烷效果最好 不能使用叔卤烷,因为叔卤烷易发生消除反应生成烯烃。 不能使用叔卤烷,因为叔卤烷易发生消除反应生成烯烃。 卤代醇在碱性条件下,可以生成环醚。 卤代醇在碱性条件下,可以生成环醚。
X +
H
OH
H2O
R OH +
R OH +
HX (该反应为什么是可逆的?) 该
NaX (为什么?) 为
7
NaOH
离去基 X 的碱性越弱,越容易被 OH 取代。
水解反应的相对活性: RI>RBr>RCl>RF (烷基相同) > > > 烷
2. 醇解 醇解:
CH3CH2CH2ONa + CH3CH2I
6
(1) 有机锂化合物的生成: 有机锂化合物的生成:
R X + 2 Li
醚
RLi
+ LiX
活性顺序:
RI >RBr > RCl >RF
(2)有机镁化合物的生成: (2)有机镁化合物的生成: 有机镁化合物的生成
R X + Mg
醚
R
MgX
亲核取代反应 一、反应: 反应: 1. 水解: 水解:
R
R
X +
到外消旋化合物。 到外消旋化合物。 然而, 然而,100 % 的外消旋化是很少 见的, 见的,经常是外消旋化伴随着构型反 转,且构型反转要多些。 且构型反转要多些。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章 消除反应消除反应:是指从一个分子中除去两个原子或基团 生成不饱和化合物或环状化合物的反应。
α-消除:从同碳原子上消除两个原子或基团,形成卡宾。
有些反应也产生氮烯β-消除:γ-消除:两个原子或基团也可以从相隔更远的位置上除去.第一节 消除反应的历程及影响因素 一、消除反应的历程根据离去基团和β-氢从分子中离去的顺序,分为三种机理: 根据离去基团和β-氢从分子中离去的顺序,分为三种机理:C NuE C + Nu EC 6H 5O 2S N 3Fe (CO)C 6H 5O 2S N+N 2加热C CNu ECCNuE+在相邻的两个碳原子上的原子或基团被消除,形成双键或叁键。
两个原子或基团从1,3位上除去,形成环状化合物.CC C NuECCC+ NuEH 2C H C HC CH 2H 2C H C HC CH 2+Br2-1. E1历程-单分子消除反应机理2. E1cb 历程-共轭碱单分子消除机理3. E2历程-双分子消除反应机理4. E1历程-单分子消除反应机理 E1历程与SN1相似。
两部均为单分子反应 第一步 第二步 反应活性:对于烷基:3°> 2°> 1°> CH3 动力学上表现为一级反应 支持E1历程的证据:反应速度只与反应的物的浓度有关,与溶剂无关 V=k [反应物]反应活性 R3CX > R2CHX > RCH2X 间接说明有正碳离子中间体生成选择合适的反应底物, 在E1条件下完成消除反应 时,常常发现重排产物2、 E2历程-双分子消除反应机理C C C C +L -slowC CH+H+υ= kC C H L亲核试剂从反应物夺取一个b-H ,与此同时,离去基团带着一对键合电子离去,它们是逐渐进行的,经过一个过渡态,最后旧键完全断裂,新键完全生成形成烯烃。
B: 中性或带负电荷,如:OR -, OH -, H2O 等。
L: X ,SO2R , NO2, CN , NR3+,SR2+等。
动力学为二级动力学,反应速度与反应物的浓度有关,也与碱浓度有关。
V=k [反应物] [B]反应为协同反应,氢提取和离去基团的脱掉发生在同一步骤,从来没有鉴定到过中间体3、 E1cb 历程-共轭碱单分子消除机理 第一步 第二步在碱进攻下,H 首先离去,然后L 再以负离子形式离去。
按E1cb 机理进行反应底物结构特征:CLC C + H B + LC C H LBδδC CL HC C +B -fastLBH共轭酸共轭碱碳负离子历程+L -C C L① L 是难离去基团。
②至少有一个酸性β-氢(被吸电子基团活化,如:COCH3、NO2、Me3N+等)乙酸-2-硝基环己酯与CH3OK 的CH3OH 溶液作用,经E1cb 机理消除CH3COOH 得到1-硝基环己烯: E1、E2和E1cb 是β-消除反应中的三种极限机理。
通常按E2机理进行的较多,但完全按协同机理进行仅是一种理想状态。
如果βC —H 键的断裂先于αC —L 的断裂及π键的形成,在过渡态时βC —H 键的断裂程度就大于αC —L 键,这种过渡态与E1cb 类似;反之,则与E1类似。
实际上E1通过E2到E1cb 是一个连续变化的过程——E2可变过渡态理论。
该理论认为,许多消除反应的机理介于典型的E1、E2、 E1cb 之间,过渡态的确切状态会随离去基团的性质、碱的强弱、溶剂效应及反应底物的空间结构的不同而改变 -E2可变过渡态理论协同的一步反应,无任何中间体,而E1和E1cb 均为二步反应。
多数情况下E2键的断裂和形成并非协同的,而且有先有后,为此提出了可变过渡理论。
OCCH 3O 2CH 3OOCCH 3O 2NO 2二、影响消去反应的因素 1、反应物结构的影响被消除原子所连的碳原子上有支链时:如果按双分子反应,在SN2历程反应中亲核试剂进攻(α-碳原子,而在E2历程反应中进攻β-氢原子,支链的空间效应对SN2不利,而相对对E2有利;如果按单分子反应,无论是SN1或E1的历程,在反应速度决定步骤中形成同样的碳正离子,只是第二步不同,若连有较多的烷基按E1消除β-氢后,形成双键可减少分子张力,使分子稳定;按SNl 取代碳正离子与亲核试剂结合,键角被压缩(由120︒减至109.5 ︒) 反而张力增加。
可见无论按双分子或按单分子反应都对消除反应有利。
对E1和E2底物分子α-碳上支链增多,消去反应的活性增大。
E1的α -碳上支链增多,碳正离子更稳定; E2消除β-H 机会增大,形成的烯烃更稳定;C CHB Lδ+δ-C HCL δ+δ-C CHB L δ-δ+CC H Bδ+δ-CC H BLδ-δ+过渡态中C-H 键断裂程度增加过渡态中C-L 键断裂程度增加E1cb E1"似E1"E2"似E1cb"E2协同E2E2而β-C 有弱吸电基时倾向于E1cb 。
2、试剂的碱性碱越强,浓度越大,利于E1cb 、E2机理。
反之,利于E1机理。
强碱有利于E2机理,弱碱有利于取代反应。
3、 离去基团的影响好的离去基团利于E1、 E2历程;带正电荷的离去基团利于E1cb 历程。
好的离去基团利于取代反应( OTs -SN2 );带正电荷的离去基团利于消除反应。
4、溶剂的影响极性强,利于E1或E1cb 机理;极性弱,利于E2机理。
极性增加有利于SN2,不利于E2。
5. 温度的影响升高温度有利于消除反应。
第二节 消除反应的取向 一、消除反应的一般规则 1. Saytzeff 规则氢从含氢较少的 碳上脱去,生成取代基较多的稳定烯烃。
札依采夫(saytzeff )规则: 在ß-消除反应中的主要产物是双键碳C H 3CH 2C CH 3CH 3Br KOH 乙醇C H 3CH CCH 3CH 3C H 3CH 2CCH 2CH 3+上连接烃基最多的烯烃。
2、Hofmann 规则季铵碱(锍盐)的热分解反应,总是得到含取代基最少的烯烃和叔胺。
3、反Saytzeff 规则和反Hofmann 规则 (1)生成共轭体系优先失去β-氢,因为生成稳定的负碳离子。
二、反应历程与消除反应的取向 1、E1消除反应中离去基团完全离开后碳正离子中间体的 -C —H 氢键才断裂因此决定产物取向的是碳正离子转变为烯烃的步骤 1、E1历程遵从Saytyeff 规则,形成热力学稳定的烯烃,如果空阻过大时则遵从Hofmann 消除2、E1cb 历程 遵从Hofmannn 规则CH 3CH 2CH CH 3N(CH 3)3OHCH 3CH 2CH 2N(CH 3)3△CH 3CH 2CHCH 295%PhCH 2CH 2N CH 3CH 3CH 2CH 3ββ'OHPhCH CH 2+C H 3CH 2N (CH 3)2(CH 3)3CCH 2CCH 3Cl CH 3NaOHH 2O(CH 3)3CCH 2CCH 2+CH 3CH 3CCH 3CH 3CH=CMe 23. E2历程(1).中性底物的E2消除按Saytzeff 消除; (1).中性底物的E2消除按Saytzeff 消除;(2).离去基带电荷的底物的E2消除按Hofmann 消除,这时β-H 的酸性不同。
亚甲基氢酸性大于甲基氢。
离去基越难离去时越有利于按Hofmann 消除消除时,不能在桥头碳原子上形成双键(不能共平面)CH 2C CH H XR R'R"B -CHC CH HXRR'R"CHCH CHR R'R"(主要)R CH 2CHCH 3+OH -R'3酸性βH>β'H 易消除βHβ'βRCOPhCN NO 2SO 2R 当β-C 上连有强吸电基时遵从Saytzeff 规则RCCHCHCH 3O共轭稳定RCC H 2CHC H 3ONMe 3OH -第三节消除反应与取代反应的竞争 一、反应物的结构第三节消除反应与取代反应的竞争 一、反应物的结构按此顺序,亲核取代的位阻增大,进攻β-H 的机会增大,产物烯烃更加稳定。
(2)SN1和E1-碳上的支链增多,SN1的快步骤中的位阻增大,有利于消除。
二、碱的影响1.对E1和E2的影响:强碱有利于E2,弱碱或无碱的溶剂有利于E1。
(1)强碱有利于消除,弱碱强亲核试剂有利于取代反应。
碱性 C2H5O->CH3COO- 21% 79% 强碱的浓度越高,有利于双分子,特别是E2。
低浓度碱或不用碱时,质子性溶剂中单分子反应占优势,特别是SN1。
CX C αβZS N 2亲核试剂碱E21°RX 2°RX 3°RXE2比例增加,S N 2比例降低CC H S N 1E1CH 3COO -+(CH 3)2CHBr CH 3COOCH(CH 3)2+Br -C 2H 5O -+(CH 3)2CHBrCH 3CH 2O CH(CH 3)2+CH 2=CHCH 3(2)进攻试剂体积大体积的强碱易发生E2,而不利于SN2(空阻)。
三、离去基团的影响 好的离去基有利于E1和E2,不好的离去基如F-、R4N +有利于E1cb (强吸电性,使β-H 酸性增加)。
四、溶剂的影响极性大的溶剂对单分子有利,对双分子不利,对E2更不利,极性小的溶剂对双分子反应有利,对单分子反应不利,对E2更有利。
定速步骤中,单分子反应的电荷产生很集中,强极性溶剂有利于中间体的溶剂化而稳定,提高反应速率。
双分子反应的过渡态电荷分散,E2比SN2更分散, 极性小溶剂有利于电荷分散。
CH 3(CH 2)15CH 2CH 2Br 回流CH 3(CH 2)15CH=CH 2+CH 3(CH 2)15CH 2CH 2OR-CH 3O -, CH 3OH Me 3CO -, Me 3COH~1%(E2)99%(S N 2)~85%(E2)~15%(S N 2)BCXδδ-δ-δ-CC H BRX +NaOH/H 2O醇 取代RX +NaOH/EtOH烯 消除五、反应温度的影响消去反应的过渡态有C-H拉长和断裂,活化能更大,升温有利于消除。
第四节、消去反应的立体化学1、E2反应的立体化学—E2按反式消除sp3 → sp2 过渡态有部分p键性质消去的H 和X 必须在同一平面上,才能满足逐渐生成的p轨道最大限度的交叠。
考虑顺式共平面消除(顺式消除)(CH3)C Br+C2H5ONaC2H5OHMe3C OEt+CH2=CMe2δ-Bδ-结论:顺式消除比反式消除难发生 采用反式消除,有利于:(1)过渡态中sp3 向 sp2过渡时两个P 轨道的重叠; (2)碱与离去基位阻排斥最小,降低反应阻力。
