2018年全国卷I高考真题化学试卷答案
2018高考全国I卷化学试题和答案解析

绝密★启用前2018年普通高等学校招生全国统一考试(全国I卷)化学试题注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号.回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35。
5 Ar 40 Fe 56 I 127一、选择题:本题共6个小题,每小题6分.在每小题给出的四个选项中,只有一项是符合题目要求的。
7.硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片"中可回收的金属元素有Al、Fe、LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠8.下列说法错误的是A.蔗糖、果糖和麦芽糖均为双糖B.酶是一类具有高选择催化性能的蛋白质C.植物油含不饱和脂肪酸酯,能使Br₂/CCl4褪色D.淀粉和纤维素水解的最终产物均为葡萄糖9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是10.N A是阿伏加德罗常数的值,下列说法正确的是A.16。
25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0。
1 N AB.22.4 L(标准状况)氨气含有的质子数为18N AC.92.0 g甘油(丙三醇)中含有羟基数为1.0N AD.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0N A11.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种。
下列关于该化合物的说法错误的是A.与环戊烯互为同分异构体B.二氯代物超过两种C.所有碳原子均处同一平面D生成1 mol C5H12至少需要2 mol H212.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20.W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。
2018年高考全国卷Ⅰ化学试题解析(解析版)
的贡献为1。
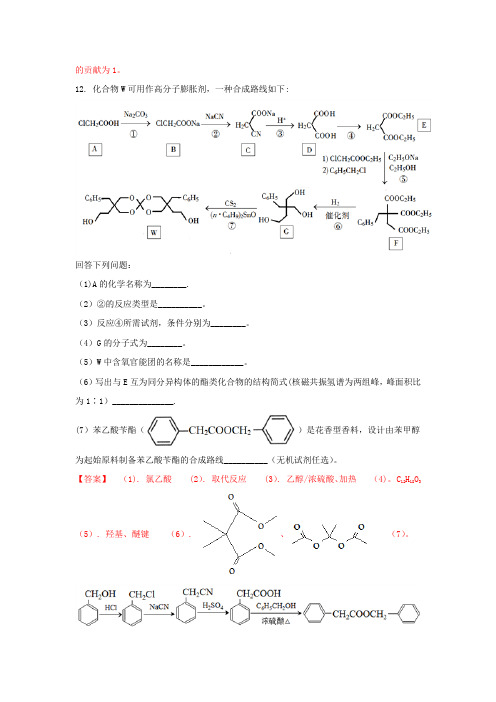
12. 化合物W可用作高分子膨胀剂,一种合成路线如下:回答下列问题:(1)A的化学名称为________.(2)②的反应类型是__________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是____________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________.(7)苯乙酸苄酯()是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
【答案】(1). 氯乙酸 (2). 取代反应 (3). 乙醇/浓硫酸、加热(4)。
C12H18O3(5). 羟基、醚键(6). 、(7)。
【解析】分析:A是氯乙酸与碳酸钠反应生成氯乙酸钠,氯乙酸钠与NaCN发生取代反应生成C,C水解又引入1个羧基.D与乙醇发生酯化反应生成E,E发生取代反应生成F,在催化剂作用下F与氢气发生加成反应将酯基均转化为醇羟基,2分子G发生羟基的脱水反应成环,据此解答.详解:(1)根据A的结构简式可知A是氯乙酸;(2)反应②中氯原子被-CN取代,属于取代反应。
(3)反应④是酯化反应,所需试剂和条件分别是乙醇/浓硫酸、加热;(4)根据G的键线式可知其分子式为C12H18O3;(5)根据W的结构简式可知分子中含有的官能团是醚键和羟基;(6)属于酯类,说明含有酯基。
核磁共振氢谱为两组峰,峰面积比为1:1,说明氢原子分为两类,各是6个氢原子,因此符合条件的有机物结构简式为或;(7)根据已知信息结合逆推法可知合成苯乙酸卞酯的路线图为。
点睛:本题考查有机物的推断和合成,涉及官能团的性质、有机物反应类型、同分异构体的书写、合成路线设计等知识,利用已经掌握的知识来考查有机合成与推断、反应条件的选择、物质的结构简式、化学方程式、同分异构体的书写的知识。
考查学生对知识的掌握程度、自学能力、接受新知识、新信息的能力;考查了学生应用所学知识进行必要的分析来解决实际问题的能力。
2018年高考全国I卷化学试题及答案

绝密★启用前2018年普通高等学校招生全国统一考试(全国I卷)化学试题注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127一、选择题:本题共6个小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A.合理处理废旧电池有利于保护环境和资源再利用页脚内容1B.从“正极片”中可回收的金属元素有Al、Fe、LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠8.下列说法错误的是A.蔗糖、果糖和麦芽糖均为双糖B.酶是一类具有高选择催化性能的蛋白质C.植物油含不饱和脂肪酸酯,能使Br₂/CCl4褪色D.淀粉和纤维素水解的最终产物均为葡萄糖9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是10.N A是阿伏加德罗常数的值,下列说法正确的是A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 N AB.22.4 L(标准状况)氨气含有的质子数为18N A页脚内容2C.92.0 g甘油(丙三醇)中含有羟基数为1.0N AD.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0N A11.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种。
下列关于该化合物的说法错误的是A.与环戊烯互为同分异构体B.二氯代物超过两种C.所有碳原子均处同一平面D生成1 mol C5H12至少需要2 mol H212.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
2018年高考全国I卷化学试题及答案(可编辑修改word版)

绝密★启用前2018 年普通高等学校招生全国统一考试(全国I 卷)化学试题注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127一、选择题:本题共 6 个小题,每小题 6 分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片”中可回收的金属元素有Al、Fe、LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠8.下列说法错误的是A.蔗糖、果糖和麦芽糖均为双糖B.酶是一类具有高选择催化性能的蛋白质C.植物油含不饱和脂肪酸酯,能使Br₂/CCl4褪色D.淀粉和纤维素水解的最终产物均为葡萄糖9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是10.N A是阿伏加德罗常数的值,下列说法正确的是A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 N AB.22.4 L(标准状况)氨气含有的质子数为18N AC.92.0 g 甘油(丙三醇)中含有羟基数为1.0N AD.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl 分子数为1.0N A11.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种。
下列关于该化合物的说法错误的是A.与环戊烯互为同分异构体B.二氯代物超过两种C.所有碳原子均处同一平面D 生成1 mol C5H12至少需要2 mol H212.主族元素W、X、Y、Z 的原子序数依次增加,且均不大于20。
2018年高考全国卷Ⅰ化学试题及答案(Word版)

2018年高考全国卷Ⅰ化学试题及答案(Word版)(考试时间:50分钟试卷满分:100分)可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127一、选择题:本题共7个小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片”中可回收的金属元素有Al、Fe、LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠8.下列说法错误的是A.蔗糖、果糖和麦芽糖均为双糖B.酶是一类具有高选择催化性能的蛋白质C.植物油含不饱和脂肪酸酯,能使Br₂/CCl4褪色D.淀粉和纤维素水解的最终产物均为葡萄糖9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是10.N A是阿伏加德罗常数的值,下列说法正确的是A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 N AB.22.4 L(标准状况)氨气含有的质子数为18N AC.92.0 g甘油(丙三醇)中含有羟基数为1.0N AD.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0N A11.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种。
下列关于该化合物的说法错误的是A.与环戊烯互为同分异构体 B.二氯代物超过两种C.所有碳原子均处同一平面 D生成1 mol C5H12至少需要2 mol H212.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。
下列说法正确的是A.常温常压下X的单质为气态B.Z的氢化物为离子化合物C.Y和Z形成的化合物的水溶液呈碱性D.W与Y具有相同的最高化合价13.最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。
2018年高考真题全国Ⅰ卷理综化学部分(附答案)

2018年高考真题全国Ⅰ卷理综化学部分(附答案)可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 1277.磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片”中可回收的金属元素有Al、Fe、LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠8.下列说法错误的是A.蔗糖、果糖和麦芽糖均为双糖B.酶是一类具有高选择催化性能的蛋白质C.植物油含不饱和脂肪酸酯,能使Br₂/CCl4褪色D.淀粉和纤维素水解的最终产物均为葡萄糖9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是10.N A是阿伏加德罗常数的值,下列说法正确的是A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 N AB.22.4 L(标准状况)氨气含有的质子数为18N AC.92.0 g甘油(丙三醇)中含有羟基数为1.0N AD.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0N A11.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种。
下列关于该化合物的说法错误的是A.与环戊烯互为同分异构体 B.二氯代物超过两种C.所有碳原子均处同一平面 D.生成1 mol C5H12至少需要2 mol H212.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。
下列说法正确的是A.常温常压下X的单质为气态 B.Z的氢化物为离子化合物C.Y和Z形成的化合物的水溶液呈碱性 D.W与Y具有相同的最高化合价13.最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。
2018高考全国I卷化学试题和答案解析

绝密★启用前2018年普通高等学校招生全国统一考试(全国I卷)化学试题注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127一、选择题:本题共6个小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片”中可回收的金属元素有Al、Fe、LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠8.下列说法错误的是A.蔗糖、果糖和麦芽糖均为双糖B.酶是一类具有高选择催化性能的蛋白质C.植物油含不饱和脂肪酸酯,能使Br₂/CCl4褪色D.淀粉和纤维素水解的最终产物均为葡萄糖9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是10.N A是阿伏加德罗常数的值,下列说法正确的是A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 N AB.22.4 L(标准状况)氨气含有的质子数为18N AC.92.0 g甘油(丙三醇)中含有羟基数为1.0N AD.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0N A11.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种。
下列关于该化合物的说法错误的是A.与环戊烯互为同分异构体B.二氯代物超过两种C.所有碳原子均处同一平面D生成1 mol C5H12至少需要2 mol H212.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
2018高考化学全国卷1答案及解析
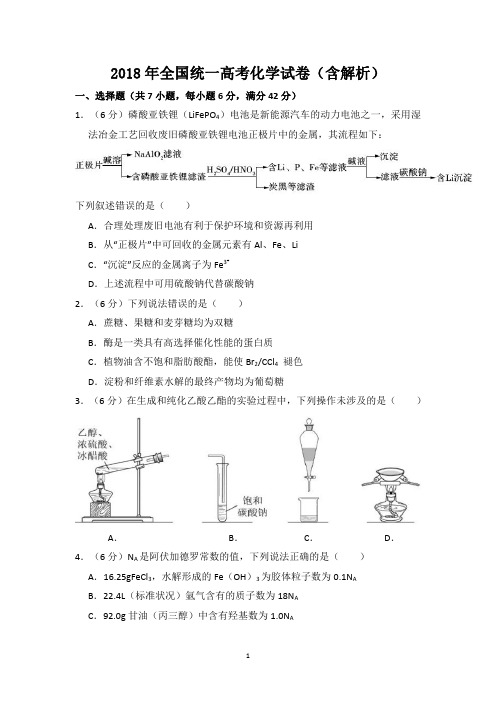
2018年全国统一高考化学试卷(含解析)一、选择题(共7小题,每小题6分,满分42分)1.(6分)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是()A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片”中可回收的金属元素有Al、Fe、LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠2.(6分)下列说法错误的是()A.蔗糖、果糖和麦芽糖均为双糖B.酶是一类具有高选择催化性能的蛋白质C.植物油含不饱和脂肪酸酯,能使Br2/CCl4褪色D.淀粉和纤维素水解的最终产物均为葡萄糖3.(6分)在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是()A.B.C.D.4.(6分)N A是阿伏加德罗常数的值,下列说法正确的是()A.16.25gFeCl3,水解形成的Fe(OH)3为胶体粒子数为0.1N AB.22.4L(标准状况)氩气含有的质子数为18N AC.92.0g甘油(丙三醇)中含有羟基数为1.0N AD.1.0molCH4与Cl2在光照下生成CH3Cl的分子数为1.0N A5.(6分)环之间共用一个碳原子的化合物称为螺环化合物,螺(2,2)戊烷()是最简单的一种,下列关于该化合物的说法错误的是()A.与环戊烯互为同分异构体B.二氯化物超过两种C.所有碳原子均处同一平面D.生成1molC5H12,至少需要2molH2 6.(6分)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20.W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。
下列说法正确的是()A.常温常压下X的单质为气态B.Z的氢化物为离子化合物C.Y和Z形成的化合物的水溶液呈碱性D.W与Y具有相同的最高化合价7.(6分)最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
9. ( 1 )
( 2 )1
2 得到
的过饱和溶液
(3)
;
(4)
;
【解析】( 1 )考查陌生方程式的书写,依据题干信息以及元素种类和原子个数守恒可知,
@石墨烯极为阴
极。
.阴极上发生还原反应,
, 正确;
.在
@石墨烯极
转化为 和
,在石墨烯极
转化为
和 单质,故总反应式为
, 正确;
.在外电路中,电流方向由石墨烯极流向
@石墨烯极,故石墨烯极的电势较
高, 错误;
.
在中性和碱性条件下会沉淀,故溶液需要酸性, 正确;
故选 。
二、非选择题
8. ( 1 )排尽水中的氧气,避免醋酸亚铬损失 ; 分液漏斗 ( 2 )1 2 排尽装置内的空气,避免倒吸,产生气体后续也能将 中液体压进 中
为放热反应,故知升高温度,平衡逆向移动,该方向为
气体分子数增大的方向,故体系压强变大。
4 当 ∞时,
完全反应,则此时体系中存在的
,
在生成
的同时,生成了
的
,设有
的
会参与平衡反应
中,则此时体系剩余的
/
为
,生成
的
,体系总压强为
,解得
,代入公式
即可,故
( 3 )根据信息可知,在三个反应历程中,第二步的反应较慢,第一步的反应能够快
故 错误;
.螺 , 戊烷
的二氯化物中两个氯原子可能位于 号碳原子上、可
能位于 号和 号碳原子上、可能位于 号和 号碳原子上、可能位于 号和
号碳原子上,所以其二氯化物超过 种,故 错误;
.该分子中中间的碳原子上具有甲烷结构特点,甲烷为正四面体结构,所以该分子
中所有 原子不可能共平面,故 正确;
.每个
比螺 , 戊烷多 个氢原子,相当于 个 ,所以生成
.氟元素和氯元素的最高化合价不同,故 错误;
故选 B。
方法二:主族元素 、 、 、 的原子序数依次增加,且均不大于 , 与
形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃,生成物是 ,因此 是
, 是 , 与 同族,则 是 。
、 、 最外层电子数之和为 ,则 的最外层电子数为
,所
以 是 ,据此解答。详根据以上分析可知 、 、 、 分别是 、 、
化,故氯元素和氧元素化合价发生变化,且氧化产物为气体物质,故可知其分
子式为 。
( 2 )1 根据盖斯定律,依托题干中两个给定的热化学方程式即可求算,故待求方
程式的反应热为
。
2
时,
,根据反应
可
知,此时
的压强变化了
,而
的起始压强为
,故此时
的压强为
,根据题干中反应速率的计算公
式带入
的压强可求出速率为
。
3 根据勒夏特列原理可知,升高温度平衡向吸热方向移动,而反应
,
在
的条件下发
生取代得到
,在酸性条件下得到
,最后在与苯乙醇发生酯化即可得到
。
/
、 或 、 、 、 ,则
A.金属钠或钾常温常压下是固态,A错误;
B.
中含有离子键,属于离子化合物,B正确;
C. 和 形成的化合物是氯化钙,其水溶液显中性,C错误;
D. 是最活泼的非金属,没有正价, 元素的最高价是 价,D错误;
故选B。
7. C
【解析】 由题图可知,在石墨烯极,发生的反应为
, 转化为
和 单质,故石墨烯极为阳极,因此
,环戊烯的分子式也为
,故 正确;
.螺 , 戊烷的二氯代物有三种,故 正确;
.螺 , 戊烷中不存在碳碳双键的结构,所有碳原子不可能处于同一平面,故
错误;
.螺 , 戊烷的分子式为
,生成
为
至少需要
氢
气,故 正确;
方法二: .螺 , 戊烷、环戊烯的分子式都为
,环戊烯结构简式为
,螺 , 戊烷、环戊烯分子式相同结构不同,所以二者互为同分异构体,
( 2 )1 考查的是基本方程式书写,溶液由绿色变为亮蓝色,说明铬有 价变为 价,题目也提到,锌是作还原剂,所以难度偏小。
2 考查的也是隔绝氧气,氢气产生可以营造一个还原性环境,并且可以避免 气压差而倒吸,再者就是为后续的液体压进 中埋下伏笔。
( 3 )考查的是学生对于气压差的理解,封紧了封口后由于持续产生氢气,会导致气 压逐渐大于大气压从而导致液体从 转移到 中。实验操作考查的是结晶、 过滤、洗涤、干燥,由题意可得,结晶应该使用冷却结晶,因为产品难溶于冷 水,也是考查考生审题的深刻度,难度中等。
/
( 3 ) 装置持续产生氢气,压强增大,将液体压进 中 ; 冷却结晶 ; 过滤 ( 4 )装置液体上方没有隔绝氧气的措施
【解析】( 1 )考查的是实验操作分析,从题目中的氧气吸收剂可以得知产品是能够与氧气 发生反应,因此煮沸就是排尽氧气,避免后续产率降低;仪器是分液漏斗,特 别让考生注意的是漏斗,长颈漏斗,分液漏斗的区别。
浓硫酸,加热。
( 4 )依次数出碳、氢、氧三种原子的个数,所以 的分子式为
。
( 5 )由 结构可知, 含有的官能团有醚键、羟基,题目要求写的是名称。
( 6 )根据题干给出的条件, 的结构具有对称性,再结合碳原子个数,即可得出结
构简式有两种。
( 7 )结合题目的合成路线,结合题目的合成路线,
先发生取代反应得到来自该方程式为。( 2 )1 依据制备焦亚硫酸钠的反应原理可知,经过一系列的步骤后先得到亚硫酸
氢钠,然后再将制备得到的亚硫酸氢钠脱水即可得到焦亚硫酸钠,故知溶
液
时对应的溶质为亚硫酸氢钠,化学式为
。
2 工艺中加入碳酸钠固体并再次通入二氧化硫气体,根据强酸制弱酸的原
理,酸性:亚硫酸
碳酸根,目的是为了得到亚硫酸氢钠的过
速平衡,说明第一步的逆反应比第二步反应快,且其不影响第一步的平衡,说
明第二步中
与
的碰撞仅部分有效,故 正确;反应过程中的
中间产物有 和
,由于第二步的反应速率最慢,说明该步对应的反应
活化能较高。
11. ( 1 ) ; ( 2 ) 的核电荷数大于 ( 3 )正四面体 ; ; 、 (4) ; ; (5)
,原子核对电子的束缚力强于
,至少需要
,故 错误;
6. B
【解析】 方法一:题干中说明, 与 形成的化合物与浓硫酸反应的产物能腐蚀玻璃,故
其产物为 ,实验室制 的反应为萤石 (
) 与浓硫酸反应,可知 为
氟元素, 为钙元素,从而推出 为钠元素, 为氯元素。
/
.常温常压下钠为固体,故 错误;
.
为离子化合物,故 正确;
.氯化钙的水溶液呈中性,故 错误;
构型为正四面体;在
中,铝和氢形成 个σ键,杂化轨道数为 ,因
此为 杂化;在
中, 和
之间以离子键结合,在
中,铝和氢以σ键结合,因此
中既有离子键又有σ键。
( 4 )第一电离能是
原子失去最外层的一个电子所需能量。根据图像,
气态锂原子变成
气态锂离子需要消耗
能量。因此 原子的
第一电离能为
。
键能是指
气态分子解离为气态原子所需的能量,根据图像, 解离为
故选 。
2. AB
【解析】 .果糖是一种单糖,故 错误; .酶是一类具有高选择催化性能的蛋白质,还存在其他物质,故 错误; .植物油含有不饱和脂肪酸酯,其中的碳碳双键能使溴的四氯化碳溶液褪色,故
正确; .淀粉和纤维素的最终水解产物均为葡萄糖,故 正确;
故选 。
3. D
【解析】 A 选项:在生成和纯化乙酸乙酯的实验过程中,需要有浓硫酸、乙醇和乙酸混合的 发生装置,故 正确; B 选项:生成的乙酸乙酯中含有乙酸和乙醇蒸汽,需要饱和的碳酸钠溶液除杂,故 正确; C 选项:除杂后乙酸乙酯和碳酸钠的混合液需要用分液的操作分离,故 正确; D 选项:在生成和纯化乙酸乙酯的实验过程中,不需要蒸干溶液,故 错误; 故选 D 。
气态氧原子消耗能量为
。因此键键能为
。
晶格能指的是处于气态的离子结合生成固态离子晶体时释放的能量。根据图
像,
和
结合成
晶体释放
能量,因此
的晶格能即为
。
(5)
/
晶胞的半径为
,即,根据图像可以看出,一个晶胞内 的数目为
,均位于晶胞内部; 占据 个面心和 个顶点数目为
,因此晶胞质量为
,晶胞体积为
,因此晶胞密度为
饱和溶液。
(3)
/
阴离子在阳极放电,根据阳极的放电顺序可知,应该是水中的氢氧根离子放
电,发生氧化反应,故知其电极方程式为
;阳极
放电产生的 通过阳离子交换膜向右侧移动至 ,阴极部分中的亚硫酸根
离子与氢离子结合变成亚硫酸氢根离子,故知 室的亚硫酸氢根离子的浓度
增加。
( 4 )根据氧化还原反应中电子守恒,电荷守恒以及原子个数守恒可以得到反应的离
。
12. ( 1 )氯乙酸 ( 2 )取代反应 ( 3 )乙醇 浓硫酸、加热 (4) ( 5 )醚键、羟基 (6) ,
(7)
【解析】( 1 ) 含有的官能团有氯原子、羧基,以羧基为主体命名,所以 的名称为氯
乙酸。
(2)
取代了氯原子,所以反应②的反应类型为取代反应。
( 3 )反应④属于酯化反应,根据生成物逆推得出所需要的试剂是乙醇,反应条件为
子方程式为
;反应中消耗的
为
,故知最终二氧化硫的物质的量为
