1-2-1原子核外电子排布PPT40张
原子核外电子的排布 课件

54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
原子核外电子的排布规律 (1)各电子层最多能容纳___2_n_2__个电子(n为电子层 数)。 (2)最外层电子数不超过___8__个(当K层为最外层时 不超过___2 _个)。 (3)次外层电子数不超过__1_8__个。 (4) 电子总是尽量先排布在能量____最_低__的电子层里, 然后由里向外,依次排布在能量逐步______升_的高电 子层。
第一章 《物质结构 元素周期律》
第二节 《元素周期律》
核外电子排布规律
① 分层排布:一分、别原用子n 核= 1外、电2、子3、的4、排5布、6、7来表示从
内到外的电子层,并分别用符号K、L、M、N、O、P、Q来表 示); ② 在离核较近的区域运动的电子能量较低,在离核较远的 区域运动的电子能量较高,原子核外的电子总是尽可能地
小结: (1)比较微粒半径大小: 三看
一看电子层数
二看核电荷数
三看核外电子数或 最外层电子数
(2)对于同种元素:①阳离子半径<原子半径
②阴离子半径 > 原子半径 (3)对于电子层结构相同的离子:
核电荷数越大,则离子半径越小。 如 O2- > F-> Na+ > Mg2+>Al3+; S2- > Cl- > K+ >Ca2+
0.186 0.160 0.143 0.117 0.110 0.102 0.099 ----
原子序数
原子半径的变化
3~9
逐渐减小
11~17
逐渐减小
结论:随着原子序数的递增,元素原 子半径呈现 周期性 变化。
如何比较简单微粒 半径大小?
原子核外电子排布

钠 Na 2 2 6 1
镁 Mg 2 2 6 2
铝 Al 2 2 6 2 1
硅 Si 2 2 6 2 2
磷 P 22623
硫 S 22624
氯 Cl 2 2 6 2 5
氩 Ar 2 2 6 2 6
(备注:斜体元素为锕系、镧系,初高中理科教师群 100035163,Chol-2NBD 整理)
周原元元
镤 Pa 2 2 6 2 6 10 2 6 10 14 2 6 10 2 2 6 1 2
铀 U 2 2 6 2 6 10 2 6 10 14 2 6 10 3 2 6 1 2
镎 Np 2 2 6 2 6 10 2 6 10 14 2 6 10 4 2 6 1 2
钚 Pu 2 2 6 2 6 10 2 6 10 14 2 6 10 6 2 6
261
2
58 铈 Ce 2 2 6 2 6 10 2 6 10 1 2 6 1
2
59 镨 Pr 2 2 6 2 6 10 2 6 10 3 2 6
2
6(32) 60 钕 Nd 2 2 6 2 6 10 2 6 10 4 2 6
2
61 钷 Pm 2 2 6 2 6 10 2 6 10 5 2 6
2
62 釤 Sm 2 2 6 2 6 10 2 6 10 6 2 6
2
40 锆 Zr 2 2 6 2 6 10 2 6 2
2
41 铌 Nb 2 2 6 2 6 10 2 6 4
1
42 鉬 Mo 2 2 6 2 6 10 2 6 5
1
43 锝 Tc 2 2 6 2 6 10 2 6 5
2
44 钌 Ru 2 2 6 2 6 10 2 6 7
1
1.2.1 原子核外电子排布
元素的金属性、非金属性。
二、元素周期律
1、概念:
元素的性质随着原子序数的递增而呈现周期性 的变化的规律叫做元素周期律。
2、本质:
元素性质的周期性变化规律是元素原子核外 电子排布周期性变化的必然结果。
随堂练习:
1、R元素形成的化合物RH3,其中R的化合价是其 最低负化合价,则R元素最高价氧化物的化学式是:
111
88
77
N(氮) O(氧) F(氟)
70
66
64
Ne(氖) —
11~17 号元素 Na(钠) Mg(镁) Al(铝) Si(硅) P(磷)
原子半
径/pm
186
160
143
117
110
S(硫) 104
Cl(氯) Ar(氩)
99
—
提示:(1)稀有气体元素原子半径的测定依据与其它元素不同,没有可比性。 (2)表中数据的单位是pm(皮米),1pm=10-12m。
1.2.1 原子核外电子排布
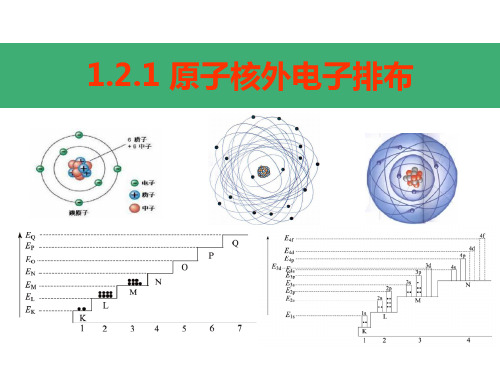
一、原子核外电子排布 原子结构示意图
一、原子核外电子排布
各电子层排布的电子数
电子层(从里到外为K、L、M······层) 核电荷数
原子核
一、原子核外电子排布
1、原子核外电子排布
(1)核外电子按能量高低分层排布(运动)
电子层: 根据电子的能量差异和通常运动区域离核
(能层)
〔观察思考2〕观察下表:原子序数为3~9、11~17的元素的原子 半径。用横坐标表示元素原子核外最外层电子数,以纵坐标表 示原子半径,根据数据表作图,表示出3~9、11~17的元素的 原子最外层电子数与原子半径的函数图像。
3~9号 元素
原子半 径/pm
核外电子的排布课件

一、核外电子排布
1.核外电子排布规律 (1)“一低”——电子首先排布在能量最低的电子层 里。排满能量低的电子层,再排能量高的电子层。
各电子层电子数不超过2n2 (2)“两不超”—最外层电子数不超过8个第一层为最外层时
不超过2个
2. 四点说明 (1)核外电子排布规律是相互联系的,不能孤立 地应用其中的一项。 (2)要熟练掌握1~20号元素的原子结构示意图, 这是顺利解答推断题的基础。 (3)注意原子结构示意图与离子结构示意图间的 区别。 (4)最外电子层中排满8个电子(He为2个)时,这 种电子层结构为相对稳定结构,其他的电子层 结构为相对不稳定结构。不稳定的电子层结构 在一定条件下要变为稳定的电子层结构。
答案: (1)Ar (2)S2- (3)K+ (4)Cl-
名师点睛: 除有规律的归纳 2e-、10e-、18e- 粒子外,还应对常见的核外电子总数及质子总数
均相同的粒子进行归纳,二者均属于热点内容,
归纳如下: ①Na+、NH4+、H3O+ ②F-、OH-、NH2- ③Cl-、HS- ④核外电子数为 10 的分子 ⑤核外电子数为 18 的分子 ⑥N2、CO
所以 A 元素原子的结构示意图为
,B 元
素原子的结构示意图为
,即 A 为氮元
素,B 为镁元素,形成化合物的化学式为 Mg3N2。
答案: D
5.(2010·厦门高一检测)写出元素符号并画出下 列元素的原子结构示意图。
(1)原子核外有2个电子层,核外有10个电子的原 子______________。 (2)质量数为23,中子数为12的原子________。 (3)最外层电子数是次外层电子数3倍的原子__。 解析: (1)核外有10个电子的原子,质子数为10, 是Ne原子。 (2)质量数为23,中子数为12的原子,质子数为23 -12=11,为Na原子。 (3)最外层电子数不能超过8个,所以次外层第1层, 次外层电子数为2,最外层电子数为2×3=6,是 O原子。
原子核外电子层电子排布图

10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10 10
14 14 14 14 14 14 14 14 14 14 14 14 14 14 14 14 14 14 14 14 14 14 14 14
2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 1 2 3 4 5 6 7 8 10 10 10 10 10 10 10
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
氡 钫 镭 锕 钍 镤 铀 镎 钚 镅 锔 锫 锎 锿 镄 钔 锘 铹 * * * * * *
Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Unq Unp Unh Uns Uno Une
2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2
6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6 6
原子核外电子的排布 课件

1
单质与水(或酸)反应
最高价氧化物对应的水化物 碱性强弱
①常温或加热下遇水 Al _无__明__显__现__象__
②与酸反应__剧__烈_
Al(OH)3:_两__性__氢___氧__化__物_
结论
Na、Mg、Al的金属性逐渐_减___弱_
②硅、磷、硫、氯的非金属性的递变规律
Cl、S、P、Si
HClO4>H2SO4>H3PO4>H2SiO3
第1课时 原子核外电子的排布 元素周期律
一、原子核外电子的排布 什么是电子层?原子核外电子排布的原则是什么? 1.电子层 (1)电子层的含义。 多电子原子里,电子分别在__能__量__不__同__的区域内运动,人们把 不同的区域简化为不连续的壳层,称之为电子层。
(2)电子层表示方法。
电子层n 1 2
【典例3】(2012·大纲版全国卷)元素X形成的离子与钙离子的 核外电子排布相同,且X的离子半径小于负二价硫离子的半径。 X元素为( ) A.Al B.P C.Ar D.K 【思路点拨】解答该题要注意以下三点: (1)Ca2+、P3-、K+均为18e-结构; (2)Al3+为10e-结构,Ar是稀有气体元素; (3)相同核外电子排布的离子随核电荷数递增,离子半径递减。
的核外电子数一定不等于其核电荷数,D错误。
二、元素周期表中元素性质的变化规律
原子半径
从同周期 (从左往右)
减小
主要化合价
金属性
非金属性
单质
氧化性 还原性
+1→+7 -4→-1 减弱 增强
增强
减弱
同主族 (从上到下)
增大
相似(最高正价相同)
核外电子排布
C它有3个电子层
D.它的最外层有2个电子 2、右图为硫原子的结构示意图。 (1)硫原子核内质子数为 16 (2)硫离子的符号为 S ; ;
(3)硫元素属于 金属元素 素”)
(填“金属元素”或“非金属元
3、 1998年中国十大科技成果之一是合成氮化镓纳米 材料,已知镓(Ga)的原子结构示意图如下图(甲) 31 所示,则x的值为________ ,镓元素的化学性质与下列 B 哪种元素的化学性质最相似________ (在A、B、C图 中选择,填字母);下列所示的四种元素最本质的区 质子数不同 别是_________________________ 。
铵根离子碳酸根离子来自12Mg2 82
+16
2 8 6
S
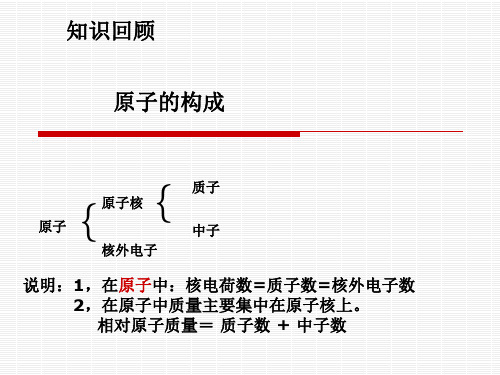
原子中,质子数=电子数
1、在原子中,质子数和电子数有何关系 ?
Mg2+
+12 2 8
S2- +16 2 8
8
2、在离子中,质子数和电子数又有何关系?
阳离子中,质子数>电子数 阴离子中,质子数<电子数
1、如右图是某原子结构示意图,有关它的说法错误的是 ( ) A.它的核内有12个质子 B.它属于非金属元素
He
二
Li Be B C N O F Ne
三
Na Mg Al Si P S Cl Ar
四
K Ca
周 期 一 二
1——20号元素的原子核外电子的排布
H He
Li
Be
B
C
N
O
F
Ne
三
Na Mg Al Si P S Cl Ar
非金属元素:原 子最外层 电子个 稀有气体元素: 四 数一般大于或等 原子最外层一般 于 4 (易得到电 K Ca 子) 为8个电子 金属元素:原子最外层电子个 (氦是2个电子) 数一般少于4 ( 易失去电子)
原子核外电子排布

原子核外电子排布1 氢H 12 氦He 23 锂Li 2 14 铍Be 2 25 硼 B 2 36 碳 C 2 47 氮 N 2 58 氧 O 2 69 氟 F 2 7。
10 氖 Ne 2 811 钠 Na 2 8 112 镁 Mg 2 8 213 铝 Al 2 8 314 硅 Si 2 8 415 磷 P 2 8 516 硫 S 2 8 617 氯 Cl 2 8 718 氩 Ar 2 8 8%19 钾 K 2 8 8 120 钙 Ca 2 8 8 221 钪 Sc 2 8 9 222 钛 Ti 2 8 10 223 钒 V 2 8 11 224 铬 Cr 2 8 13 125 锰 Mn 2 8 13 226 铁 Fe 2 8 14 227 钴 Co 2 8 15 228 镍 Ni 2 8 16 229 铜 Cu 2 8 18 1&30 锌 Zn 2 8 18 231 镓 Ga 2 8 18 332 锗 Ge 2 8 18 433 砷 As 2 8 18 534 硒 Se 2 8 18 635 溴 Br 2 8 18 736 氪 Kr 2 8 18 837 铷 Rb 2 8 18 8 138 锶 Sr 2 8 18 8 239 钇 Y 2 8 18 9 2)40 锆 Zr 2 8 18 10 241 铌 Nb 2 8 18 12 142 钼 Mo 2 8 18 13 143 锝 Tc 2 8 18 13 244 钌 Ru 2 8 18 15 145 铑 Rh 2 8 18 16 146 钯 Pd 2 8 18 1847 银 Ag 2 8 18 18 148 镉 Cd 2 8 18 18 249 铟 In 2 8 18 18 350 锡 Sn 2 8 18 18 4)51 锑 Sb 2 8 18 18 552 碲 Te 2 8 18 18 653 碘 I 2 8 18 18 754 氙 Xe 2 8 18 18 855 铯 Cs 2 8 18 18 8 156 钡 Ba 2 8 18 18 8 257 镧 La 2 8 18 18 9 2 〖镧系〗58 铈 Ce 2 8 18 19 9 2 〖镧系〗59 镨 Pr 2 8 18 20 9 2 〖镧系〗60 钕 Nd 2 8 18 21 9 2 〖镧系〗—61 钷 Pm 2 8 18 22 9 2 〖镧系〗62 钐 Sm 2 8 18 23 9 2 〖镧系〗63 铕 Eu 2 8 18 24 9 2 〖镧系〗64 钆 Gd 2 8 18 25 9 2 〖镧系〗65 铽 Tb 2 8 18 26 9 2 〖镧系〗66 镝 Dy 2 8 18 27 9 2 〖镧系〗67 钬 Ho 2 8 18 28 9 2 〖镧系〗68 铒 Er 2 8 18 29 9 2 〖镧系〗69 铥 Tm 2 8 18 30 9 2 〖镧系〗70 镱 Yb 2 8 18 31 9 2 〖镧系〗71 镥 Lu 2 8 18 32 9 2 〖镧系〗、72 铪 Hf 2 8 18 32 10 273 钽 Ta 2 8 18 32 11 274 钨 W 2 8 18 32 12 275 铼 Re 2 8 18 32 13 276 锇 Os 2 8 18 32 14 277 铱 Ir 2 8 18 32 15 278 铂 Pt 2 8 18 32 17 179 金 Au 2 8 18 32 18 180 汞 Hg 2 8 18 32 18 281 铊 Tl 2 8 18 32 18 382 铅 Pb 2 8 18 32 18 4-83 铋 Bi 2 8 18 32 18 584 钋 Po 2 8 18 32 18 685 砹 At 2 8 18 32 18 786 氡 Rn 2 8 18 32 18 887 钫 Fr 2 8 18 32 18 8 188 镭 Ra 2 8 18 32 18 8 289 锕 Ac 2 8 18 32 18 9 2 〖锕系〗90 钍 Th 2 8 18 32 18 10 2 〖锕系〗91 镤 Pa 2 8 18 32 20 9 2 〖锕系〗92 铀 U 2 8 18 32 21 9 2 〖锕系〗》93 镎 Np 2 8 18 32 22 9 2 〖锕系〗94 钚 Pu 2 8 18 32 24 8 2 〖锕系〗95 镅 Am 2 8 18 32 25 8 2 〖锕系〗96 锔 Cm 2 8 18 32 25 9 2 〖锕系〗97 锫 Bk 2 8 18 32 26 9 2 〖锕系〗98 锎 Cf 2 8 18 32 28 8 2 〖锕系〗99 锿 Es 2 8 18 32 29 8 2 〖锕系〗100 镄 Fm 2 8 18 32 30 8 2 〖锕系〗101 钔 Md 2 8 18 32 31 8 2 〖锕系〗102 锘 No 2 8 18 32 32 8 2 〖锕系〗103 铹 Lr 2 8 18 32 32 9 2 〖锕系〗:104 卢* Rf 2 8 18 32 32 10 2105 杜* Db 2 8 18 32 32 11 2106 喜* Sg 2 8 18 32 32 12 2107 波* Bh 2 8 18 32 32 13 2108 黑* Hs 2 8 18 32 32 14 2109 麦* Mt 2 8 18 32 32 15 2110 * Uun 2 8 18 32 32 16 2111 * Uuu 2 8 18 32 32 17 2112 * Uub 2 8 18 32 32 18 2113 * Uut 2 8 18 32 32 18 3114 * Uuq 2 8 18 32 32 18 4115 * Uup 2 8 18 32 32 18 5 116 * Uuh 2 8 18 32 32 18 6 117 * Uus 2 8 18 32 32 18 7 118 * Uuo 2 8 18 32 32 18 8。
