原子核外电子排布2
1-36核外电子排布式

[1]H氢1s1[2]He氦1s2[3]Li锂1s2 2s1 [4]Be铍1s2 2s2 [5]B硼1s2 2s2 2p1 [6]C碳1s2 2s2 2p2 [7]N氮1s2 2s2 2p3[8]O氧1s2 2s2 2p4[9]F氟1s2 2s2 2p5 [10]Ne氖1s2 2s2 2p6 [11]Na钠1s2 2s2 2p6 3s1 [12]Mg镁1s2 2s2 2p6 3s2 [13]Al铝1s2 2s2 2p6 3s2 3p1 [14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3 [16]S硫1s2 2s2 2p6 3s2 3p4 [17]Cl氯1s2 2s2 2p6 3s2 3p5 [18]Ar氩1s2 2s2 2p6 3s2 3p6 [19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s21s2 2s2 2p6 3s2 3p6 3d2 4s2 [23]V 钒1s2 2s2 2p6 3s2 3p6 3d3 4s2 *[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s21s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 [34]Se硒1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 [35]Br溴1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5[36]Kr氪1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。
1.2.1原子核外电子的排布课后作业2

原子核外电子的排布一、选择题1.下列叙述中,正确的是()A.在多电子的原子里,能量高的电子通常在离核近的区域内运动B.核外电子总是先排在能量低的电子层上,例如只有排满了M层后才排N层C.某原子M层上电子数为L层电子数的4倍D.某离子的核电荷数与最外层电子数相等2.关于原子结构的叙述正确的是()A.所有的原子核都是由质子和中子构成的B.原子的最外层电子数不超过8C.稀有气体原子的最外层电子数均为8D.原子的次外层电子数都是83.下列各原子结构示意图中所表示的核外电子排布正确的是()4.已知W粒子的结构示意图为,下列关于它的说法不正确的是()A.y=2B.若x=18,则z=8C.若x=14,则其氢化物的化学式为H2WD.若x=17,则其最高价氧化物的化学式为W2O75.下列说法中,肯定错误的是()A.某原子K层上只有1个电子B.某原子M层上电子数为L层上电子数的4倍C.某离子M层上和L层上的电子数均为K层的4倍D.某原子的核电荷数与最外层电子数相等6.下列化学符号表示同一种元素的是()①3517X②3717X③④A.①③B.①②③C.②③D.①②③④7.已知最外层电子数相同的原子具有相似的化学性质。
氧原子的核外电子分层排布示意图为,下列原子中,与氧原子化学性质相似的是()8.下列叙述中,正确的是()A.核外电子排布完全相同的两种微粒,其化学性质一定相同B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布C.核外电子排布相同的两原子一定属于同种元素D.任一阴离子的核外电子排布一定与其上一周期稀有气体元素原子的核外电子排布相同9.某短周期元素的原子最外层电子数是次外层电子数的3倍,那么该原子()A.有3个电子层B.有2个电子层C.最外层电子数是8D.核电荷数是1010.下列说法中,正确的是()A.原子最外层电子少于3个的元素均是金属元素B.原子核外能量越低的电子离核越远,能量越高的电子离核越近C.两个简单微粒的电子层排布完全相同,则它们一定是同一种元素D.在短周期元素中,原子最外层电子数等于电子层数的元素是H、Be、Al11.已知元素X、Y的核电荷数分别是a和b,它们的离子X m+和Y n-的核外电子排布相同,则下列关系式中正确的是()A.a=b+m+nB.a=b-m+nC.a=b+m-nD.a=b-m-n12.短周期元素A和B,其中A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两种元素形成的化合物的化学式可能表示为()A.B3A2B.AB2C.A3B2D.BA213.短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D 元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则这4种元素原子序数关系中正确的是()A.C>D>B>AB.D>B>A>CC.A>D>C>BD.B>A>C>D二、非选择题14.根据下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:(1)五种粒子中,属于原子的是________,属于离子的是_________。
原子核外电子排布

③ 1s 2s
2p
29
1s 1 氢 2 氦 3 4 5 6 10 13 14 18 19 20 锂 铍 硼 碳 氖 铝 硅 氩 钾 钙 H He Li Be B C Ne Al Si Ar K Ca Sc 1 2 2 2 2 2 2 2 2 2 2 2 2
2s
2p
3s
3p
3d
4s
每个电子层最多可容纳的电子数为 2n2
K
轨道数 电子数
L
M
N
1 2
4 8
9 18
16 32
8
2、能量最低原理
体系的能量越低越稳定
9
2、能量最低原理
电子排布时
总是先占据能量较低的原子轨道,
当能量较低的原子轨道占满后,
电子再依次进入能量较高的原子轨道
怎样判断原子轨道能量的高低呢?
10
(1) 原子轨道的能量主要是由电子层 和电子亚层决定的
16
(2) 电子在原子轨道中的排布顺序
电子排布式:
22s22p63s23p5 Cl 原子: 1s 17
所有能级均写出,体现排布全貌;
书写格式: ①元素符号; ②轨道符号(带电子层数) ③电子个数(右上角)
17
N:1s2 2s2 2p3 Z = 26 Fe:1s2 2s2 2p6 3s2 3p6 3d6 4s2
Fe3+ [Ar] 3d 5
21
22
(2) 电子在原子轨道中的排布顺序
若要表示电子自旋方向,可用原子轨道图式表示:
轨道表示式:
17Cl:
1s
2s
2p
3s
3p
23
电子结构式
25
课题二第二课时核外电子排布

第2课时
原子核外电子的排布
蚂蚁
体育场(原子)
如果把原子比作一个体育场,那么原子核只相当 于体育场中的一只蚂蚁。可见:原子核很小,原 子核外面的空间很大,电子在里面作高速运动
原子核外电子运动的特征
原子核外电子的运动有自己的特点,没有 固定的轨道,但却有经常出现的区域
【思考】电子在核外的空间里做高速的运动。它
[例1]六种粒子结构示意图分别为:
(1)A、B、C、D、E、F共表示 元素。 (2)表示原子的粒子是 下同)。 (3)表示离子的粒子是 ACF BDE
四
种 (填序号, 。
[例2]铜是由 铜元素 组成 铜原子 构成的;水 的,由 是由 氢元素和氧元素 组成的, 由 水分子 构成的;氯化钠 是由 氯元素和钠元素组成的, 由 钠离子和氯离子构成的。
(1)“相对原子质量”是一个比值; (2)“相对原子质量”单位为“ 1 ”,可省略。 质子、中子的相对质量约为:1 氢原子的相对原子质量约为:1 氧原子的相对原子质量约为:16
相对原子质量的近似值
原子种类 氢 碳 氧 质子数 1 6 8 中子数 0 6 8 核外电子数 1 6 8 相对原子质量 1 12 16
B
4、“嫦蛾一号”的任务之一是探测月球上的氦-3资源, He-3的原子结构示意图为 +2
x ,图中x为(
B
)。
A.1
B. 2
C. 3
D. 4
5、下列原子结构示意图所表示的元素,化学性
质最稳定的是(
+10
A
A )。
+12 2 8 2
C
2 8
+11 2 8 1
B
+17 2 8 7
原子核外电子排布

钠 Na 2 2 6 1
镁 Mg 2 2 6 2
铝 Al 2 2 6 2 1
硅 Si 2 2 6 2 2
磷 P 22623
硫 S 22624
氯 Cl 2 2 6 2 5
氩 Ar 2 2 6 2 6
(备注:斜体元素为锕系、镧系,初高中理科教师群 100035163,Chol-2NBD 整理)
周原元元
镤 Pa 2 2 6 2 6 10 2 6 10 14 2 6 10 2 2 6 1 2
铀 U 2 2 6 2 6 10 2 6 10 14 2 6 10 3 2 6 1 2
镎 Np 2 2 6 2 6 10 2 6 10 14 2 6 10 4 2 6 1 2
钚 Pu 2 2 6 2 6 10 2 6 10 14 2 6 10 6 2 6
261
2
58 铈 Ce 2 2 6 2 6 10 2 6 10 1 2 6 1
2
59 镨 Pr 2 2 6 2 6 10 2 6 10 3 2 6
2
6(32) 60 钕 Nd 2 2 6 2 6 10 2 6 10 4 2 6
2
61 钷 Pm 2 2 6 2 6 10 2 6 10 5 2 6
2
62 釤 Sm 2 2 6 2 6 10 2 6 10 6 2 6
2
40 锆 Zr 2 2 6 2 6 10 2 6 2
2
41 铌 Nb 2 2 6 2 6 10 2 6 4
1
42 鉬 Mo 2 2 6 2 6 10 2 6 5
1
43 锝 Tc 2 2 6 2 6 10 2 6 5
2
44 钌 Ru 2 2 6 2 6 10 2 6 7
1
原子核外电子的排布

+17 2 8 7
该层电子数 电子层
第一章 物质结构 元素周期律
第二节 元素周期律
原子核外电子的排布
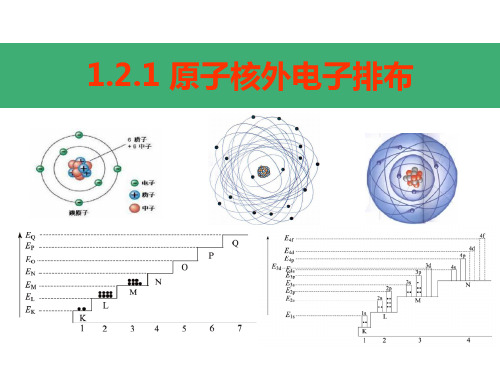
一、原子核外电子的排布
1、分层排布:分别用n = 1、2、3、4、5、6、7 来表示从内到外的电子层,并分别用符号K、L、 M、N、O、P、Q来表示);
2、在离核较近的区域运动的电子能量较低,在 离核较远的区域运动的电子能量较高,原子核 外的电子总是尽可能地先从内层排起;
1 K 2 3 4 5 6 7 L M N O P Q
由内到外,能量逐渐升高
3、电子排布的规律 (1) 电子总是先占据能量低的电子层 (2) 每层最多填充电子数 2n2 (3) 最外层电子数不能超过 8个,次外层电子数不 能超过 18个,倒数第三层不能超过32个
4、核外电子排布的表示方法
Cl
核电荷数
核外电子排布规律总结

核外电子排布规律总结原子核外电子排布规律①能量最低原理:电子层划分为KvLvMvOvPv对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:⑴离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10 电子粒子:CH4、N3、NH,、NH3、NH4、O2、OH、H, O H3O、F、HF、Ne Na、Mg2、Al 3等。
②18 电子粒子:SiH4、P3、Pli、S2、HS、H2S、Cl 、HCI、Ar、K、Ca2、PH^ 等。
特殊情况:F2、H2O2、C2H6、CI^OH③核外电子总数及质子总数均相同的阳离子有:Na、NH、H3O等;阴离子有:F、OH、NH, ;HS 、CI 等。
前18号元素原子结构的特殊性:(1)原子核中无中子的原子:;H(2)最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg He(3)最外层电子总数等于次外层电子数的元素:Be Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2 的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的U A、川A族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6 7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即I A、U A 族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即川A〜%A族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。
1.2.1 原子核外电子排布
元素的金属性、非金属性。
二、元素周期律
1、概念:
元素的性质随着原子序数的递增而呈现周期性 的变化的规律叫做元素周期律。
2、本质:
元素性质的周期性变化规律是元素原子核外 电子排布周期性变化的必然结果。
随堂练习:
1、R元素形成的化合物RH3,其中R的化合价是其 最低负化合价,则R元素最高价氧化物的化学式是:
111
88
77
N(氮) O(氧) F(氟)
70
66
64
Ne(氖) —
11~17 号元素 Na(钠) Mg(镁) Al(铝) Si(硅) P(磷)
原子半
径/pm
186
160
143
117
110
S(硫) 104
Cl(氯) Ar(氩)
99
—
提示:(1)稀有气体元素原子半径的测定依据与其它元素不同,没有可比性。 (2)表中数据的单位是pm(皮米),1pm=10-12m。
1.2.1 原子核外电子排布
一、原子核外电子排布 原子结构示意图
一、原子核外电子排布
各电子层排布的电子数
电子层(从里到外为K、L、M······层) 核电荷数
原子核
一、原子核外电子排布
1、原子核外电子排布
(1)核外电子按能量高低分层排布(运动)
电子层: 根据电子的能量差异和通常运动区域离核
(能层)
〔观察思考2〕观察下表:原子序数为3~9、11~17的元素的原子 半径。用横坐标表示元素原子核外最外层电子数,以纵坐标表 示原子半径,根据数据表作图,表示出3~9、11~17的元素的 原子最外层电子数与原子半径的函数图像。
3~9号 元素
原子半 径/pm
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
形成的化合物的化学式•D为:
• A. A2B3
B. BA2
C. AB4
D.B3A2
•精品课件
!
•精品课件
!
• 1.某元素原子核外L层电子数是其它层电子数之和的2
倍,则该元素的核电荷数为•A:
• A.6
B.8
C C.12
D.16
• 2.两种元素原子的核外电子层数之比与最外层电子数 之比相等,则在核电荷数为1~10的元素中。满足上述 关系的元素共有•:B
• A.1对
B.2对
C.3对
D.4对
• 3.A元素原子的L层比B元素原子的L层少3个电子,B原 子核外电子总数比A原子核外电子总数多5个,则A与B
•
机会的多少。
•过程:给原子拍照。
•结果:很像在原子核外有一层疏密不等的“云”
理解电子云
注意:每一个小黑点 只代表电子在该处出 现一次,并不代表有 一个电子。
一个点没有多大意义 ,众多点的疏密不同 才有意义。
核外电子分层排布
电子按能量高低在核外分层排布。
称有气体元素原子电子层排布
排布规律
•B.电子云示意图中的小黑点表示一个电子
•C. 次外层电子数一定是2或8
•D.最外层只有一个电子的原子不一定是碱金属元素的原子
课堂练习2
1.根据下列叙述,写出元素名称并画出原子结构示意图 。
• (硅12)8 A元素原子核外M层电子数是L层电子数的1/2; 4 ________•___
(2)硼B元2 3素原子的最外层电子数是次外层电子数的 1.5倍;______
原子核外电子排布2
•3.元素的相对原子质量
•元素的相对原子质量等于各同位素原子的相对原 子质量与其原子个数百分比(丰度)的乘积之和 。即:M=M1×a%+M2×b%+M3×c%+…
•例:氧元素有三种同位素原子:16O、17O、18O,从下
列数据可计算出氧元素的相对原子质量。
• 符号
•在自然界中各同位素 同位素相对原子质量 原子所占的原子个数
百分比
•16O
15.9949
99.759%
•17O
16.9991
0.037%
• 18O
17.9992
0.204%
•4.元素的近似相对原子质量
•元素的近似相对原子质量等于各同位素原子的质 量数与其原子个数百分比的乘积之和。
•即M=A1×a%+A2×b%+A3×c%+…
•例:氧元素有三种同位素原子:16O、17O、18O,从下 列数据可计算出氧元素的近似相对原子质量。
• 符号
同位素相对原子质量 •在自然界中各同位素 原子所占的原子个数 百分比
•16O
15.9949
99.759%
•17O
16.9991
0.037%
• 18O
17同
电子云
•电子云:是用统计的方法对核外电子运动规律 所
•
作的一种描述。
•描述方法:用点的密度大小表示电子在某处出 现
原子结构示意图1
原子结构示意图2
课堂练习1
•1.下列原子结构示意图中,正确的是(•B )
•A
•B
•C
•D
.
.
.
.
•2.某元素原子的原子核外有三个电子层,最外层有4个电子,
该原子核内的质子数为( •A)
•A.14
B.15 C.16
D.17
•3.下列叙述正确的是(•D)
•A.电子在原子核外作高速圆周运动
•氖(238)C元素的次外层电子数是最外层电子数的1/4; ________
2.X和Y是原子序数小于18的元素,X原子比Y原子多1 个电子层;X原子的最外层中只有1个电子;Y原子的最 外层电子层中有7•N个a电子。这两种元素形成的化合物的 化学式是_______F___________.
补充练习1
•电子总是尽先排布在能量最低的电子层里 每。个电子层最多只能排布2n2个电子。 K层为最外层时,最多只能容纳2个电子。 其它各层为最外层时,最多只能容纳8个电子。 次外层最多不超过18个电子。
•1→ 2 → 3→ 4→ 5 → •6K→ L → M→N → O → P •2→ 8 →18→32→50→ 2n2
