1.1.4原子的核外电子排布图
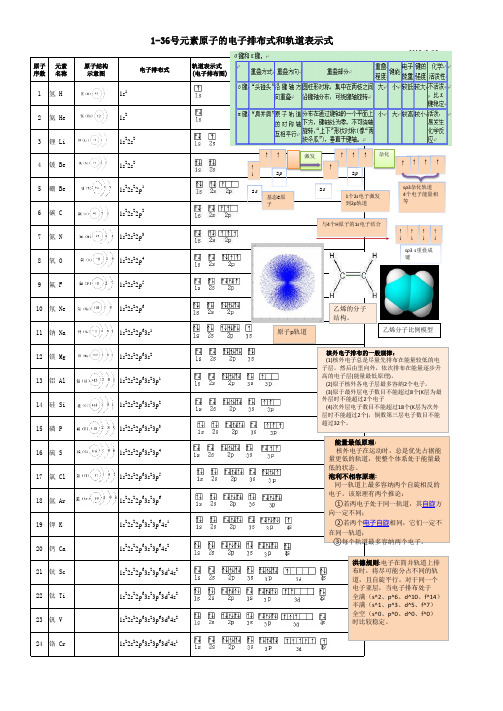
1-36核外电子排布式

[1]H氢1s1[2]He氦1s2[3]Li锂1s2 2s1 [4]Be铍1s2 2s2 [5]B硼1s2 2s2 2p1 [6]C碳1s2 2s2 2p2 [7]N氮1s2 2s2 2p3[8]O氧1s2 2s2 2p4[9]F氟1s2 2s2 2p5 [10]Ne氖1s2 2s2 2p6 [11]Na钠1s2 2s2 2p6 3s1 [12]Mg镁1s2 2s2 2p6 3s2 [13]Al铝1s2 2s2 2p6 3s2 3p1 [14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3 [16]S硫1s2 2s2 2p6 3s2 3p4 [17]Cl氯1s2 2s2 2p6 3s2 3p5 [18]Ar氩1s2 2s2 2p6 3s2 3p6 [19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s21s2 2s2 2p6 3s2 3p6 3d2 4s2 [23]V 钒1s2 2s2 2p6 3s2 3p6 3d3 4s2 *[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s21s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 [34]Se硒1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 [35]Br溴1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5[36]Kr氪1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。
核外电子排布、原子结构示意图、电子式、8电子稳定结构

原子的核外电子排布1.原子结构行星模型告诉我们,核外电子在原子核外的外周运动,那么原子的核外电子是怎样排布在原子核外的呢?下图是1~20号元素核外电子的排布图,仔细观察图像,回答下列问题:注:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出。
(1)第一层最多排_______个电子,第二层最多排________个电子,第三层最多排______个电子。
规律:第n层最多容纳的电子数为______________(用含n的代数式表示)。
(2)最外层最多排_______个电子。
(3)第二层电子的能量比第一层电子的能量_________(填“大”或“小”,提示:从原子核对电子的作用思考)。
2.电子层的表示方法及能量变化:3.核外电子的排布规律:(1)能量最低原则:核外电子总是先排布在能量______的电子层里,然后再按照由______向______的顺序依次排布在能量逐渐升高的电子层里。
(2)电子分层排布的原则:①第n层最多容纳的电子数为______。
②最外层不超过________个(K层为最外层时,不超过_____个)。
4.原子结构示意图:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出,如:5.阴阳离子的形成:(1)当原子_________(填“得到”或“失去”)电子时便形成阴离子,如N3-、O2-、F-。
(2)当原子_________(填“得到”或“失去”)电子时便形成阳离子,如Na+、Mg2+、Al3+。
规律:a.当原子的最外层电子数大于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。
b.当原子的最外层电子数小于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。
6.“8e”稳定结构:___________________________________________。
1-36号元素轨道图
dz2
价键法(VB法)价键理论一: 1、要点: ⑴、共价键的形成条件:①、先决条件: 原子具有未成对电子;②、配对电子参与 成键的原子轨道要满足对称匹配、能量相 近以及最大重叠的原则;③、两原子具有 成单的自旋相反的电子配对,服从保里不 相容原理。 ⑵、共价键的本质:是由于原子相互接近 时轨道重叠,原子间通过共用自旋相反的 电子使能量降低而成键。 ⑶、共价键的特征:①、饱和性,一个原 子有几个未成对电子(包括激发后形成的 未成对电子),便和几个自旋相反的电子 配对成键;而未成对电子数是有限的,故 形成化学键的数目是有限的。②、根据原 子轨道最大重叠原理,原子轨道沿其角度 分布最大值方向重叠,即共价键具有一定 的方向性。 ⑷、共价键的类型:单键、双键和叁键。
1-36号元素原子的电子排布式和轨道表示式
原子 元素 序数 名称
1 氢H
原子结构 示意图
电子排布式
1s1
轨道表示式 (电子排布图)
2013/9/12
2 氦 He
1s2
3 锂 Li 4 铍 Be 5 硼 Be 6 碳C 7 氮N 8 氧O
1s22s2 1s22s2 1s22s22p1 1s22s22p2 1s22s22p3 1s22s22p4
电离能:气态电中性基态原子失 去一个电子,转化为气态基态正离
子所需要的最低能量叫第一电离能。 符号:“I1”,单位:Kj/mol^-1。 “气态”、“电中性”、“基态” 是保证最低能量的条件。
[规律] 1.总体上金属元素第一电离能较 小非金属元素第一电离能较大. 2.同周期元素第一电离能从左到 右有增大的趋势 3.同主族元素第一电离能从上到 下逐渐减小
35 溴 Br
1s22s22p63s23p63d104s24p5
原子核外电子排布

钠 Na 2 2 6 1
镁 Mg 2 2 6 2
铝 Al 2 2 6 2 1
硅 Si 2 2 6 2 2
磷 P 22623
硫 S 22624
氯 Cl 2 2 6 2 5
氩 Ar 2 2 6 2 6
(备注:斜体元素为锕系、镧系,初高中理科教师群 100035163,Chol-2NBD 整理)
周原元元
镤 Pa 2 2 6 2 6 10 2 6 10 14 2 6 10 2 2 6 1 2
铀 U 2 2 6 2 6 10 2 6 10 14 2 6 10 3 2 6 1 2
镎 Np 2 2 6 2 6 10 2 6 10 14 2 6 10 4 2 6 1 2
钚 Pu 2 2 6 2 6 10 2 6 10 14 2 6 10 6 2 6
261
2
58 铈 Ce 2 2 6 2 6 10 2 6 10 1 2 6 1
2
59 镨 Pr 2 2 6 2 6 10 2 6 10 3 2 6
2
6(32) 60 钕 Nd 2 2 6 2 6 10 2 6 10 4 2 6
2
61 钷 Pm 2 2 6 2 6 10 2 6 10 5 2 6
2
62 釤 Sm 2 2 6 2 6 10 2 6 10 6 2 6
2
40 锆 Zr 2 2 6 2 6 10 2 6 2
2
41 铌 Nb 2 2 6 2 6 10 2 6 4
1
42 鉬 Mo 2 2 6 2 6 10 2 6 5
1
43 锝 Tc 2 2 6 2 6 10 2 6 5
2
44 钌 Ru 2 2 6 2 6 10 2 6 7
1
核外电子分层排布示意图

(1)x表示该元素原子核内的质子,数 该粒子有 3 个电 子层,y与粒子的 化学性质 关系非常密切。
(2)当x-y=10,该粒子为 原子 别)。
(填类
(3)y=8时,该粒子带有2个单位的负电荷,该
粒子的符号为 S2-
。
(4)当y=1的中性原子与y=7的中性原子化合 时,形成的化合物属于 离子 化合物。
非金属元 一般多于等于 易得电子,形成 不稳定
素
4个
阴离子
决定元素化学性质的是:最外层电子数
钠+氯气
点燃
氯化钠
钠与氯气反应形成氯化钠
二、离子的形成
1、离子:带电的原子或原子团 阳离子
离子 阴离子
离子符号:
2、离子化合物:由阴阳离子相互化合而形成的 化合物,如NaCl
离子与原子的区别和联系
粒子种类
9.某原子结构示意图可表示为
,回答下列问题:
(1)结构示意图中,x表示质子数; y表示 最外层电子。数
(2)当x=16时,y= 6 ; 当y=8时,x= 18 。
10.将H、Li、Na、Mg、Al排成下图形式,根据空行的原子 结构可以得出如下规律:
(1)纵行中,三种元素的原子在结构上的相同点
是最外层电子数相同,不同点是 电子层数不同
最外层最多容纳8个电子
原子核
原子结构示意图
质子数(核电荷数)
要点:
圆圈标核电,
正号写在前,
电子数
弧线呈扇面, 数字一条线。
电子层
3、元素性质与元素最外层电子数的关系
元素分类 最外层电子数 得失电子倾向 化学性质
稀有气体 8个(He为2个) 不易得失、相对 稳定
元素
稳定
核外电子排布及离子

D、
3、钠的相对原子质量为23,它失去一个电子层,发生改变的是
离子:带电的原子或原子团
带正电荷的离子叫阳离子
金属阳离子比对应的金属原子核外电子层少一层
核电核数=质子数﹥核外电子数
e-
+17 2 8 7 得到1个电子
+17 2 8 8
Cl
e-
+8 2 6
O
得到2个电子
Cl-
+8 2 8
O2-
带负电荷的离子叫阴离子,它与对应的原子有相同的电子层数。
核电核数=质子数﹤核外电子数
⑹ 属于原子的是_A_、__B_、__C_、__F属于稀有气体原子的是_A__、_B__
离子化合物的形成 氯化钠的形成
点燃
钠+氯气→氯化钠
点燃
Na+Cl2→NaCl
由阴阳离子相互作用形成的化合物叫离子化合物
一般由活泼的金属与活泼的非金属形成。
e-
+11 2 8 1
失去1个电子
Na
+11 2 8 Na+
氧原子结构示意图
原子核
第一层(K层) 第二层(L层)
+8 2 6
电子数
质子数为8 (原子 核带8个单位正电 荷即核电荷数为8)
镁原子结构示意图
+12 2 8 2
1、质子数是多少? 12 2、几个电子层? 3 3、第一层几个电子? 2 4、最外层几个电子? 2
+1 1 H
+3 2 1
Li
+6 2 4
一、学习目标
1.知道原子核外的电子是分层排布的,知道原子结构 的表示方法,会画1-18号元素的原子结构示意图。
核外电子排布与元素周期表

P S 110 104
K 227
Rb 248 Cs 265
Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As 197 161 145 132 125 124 124 125 125 128 133 122 122 121
Se 117
Br 114Байду номын сангаас
Kr 198
Xe 217
Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I 215 181 160 143 136 136 133 135 138 144 149 163 141 141 137 133 Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po 217 188 159 143 137 137 134 136 136 144 160 170 175 155 153
Au
Hg Tl
[Xe]4f145d106s1
[Xe]4f145d106s2 [Xe]4f145d106s26p1
82
83 84
Pb
Bi Po
[Xe]4f145d106s26p2
[Xe]4f145d106s26p3 [Xe]4f145d106s26p4
85
86
At
Rn
[Xe]4f145d106s26p5
(四)
31
32 33 34 35 36
Ga
Ce As Se Br Kr
[Ar]3d104s24p1
[Ar]3d104s24p2 [Ar]3d104s24p3 [Ar]3d104s24p4 [Ar]3dl04s24p5 [Ar]3d104s24p6
37 38 39 40
1-36核外电子排布式

[1]H氢1s1 [2]He氦1s2 [3]Li锂1s2 2s1[4]Be铍1s2 2s2[5]B硼1s2 2s2 2p1 [6]C碳1s2 2s2 2p2 [7]N氮1s2 2s2 2p3 [8]O氧1s2 2s2 2p4 [9]F氟1s2 2s2 2p5 [10]Ne氖1s2 2s2 2p6 [11]Na钠1s2 2s2 2p6 3s11s2 2s2 2p6 3s2[13]Al铝1s2 2s2 2p6 3s2 3p1[14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3[16]S硫1s2 2s2 2p6 3s2 3p4[17]Cl氯1s2 2s2 2p6 3s2 3p5[18]Ar氩1s2 2s2 2p6 3s2 3p6[19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s2 [22]Ti钛1s2 2s2 2p6 3s2 3p6 3d2 4s21s2 2s2 2p6 3s2 3p6 3d3 4s2*[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s2*[29]Cu铜1s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p31s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 [35]Br溴1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 [36]Kr氪1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E )如下图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
和规则
洪特规则
二、原子核 外电子排布 的表示式
电子排布式 电子排布图
思考:回忆 s p d f 能级分别最多容纳电子个数?
2.原子轨道
(1)不同能层的同种能级的原子轨道形状相同,只 是半径不同。能层序数n越大,原子轨道的半径 越大。 (2)s能级只有1个原子轨道。p能级有3个原子轨道, 它们互相垂直,分别以px、py、pz表示。 (3)原子轨道数与能层序数(n)的关系是原子轨道 为n2个。 (4)原子轨道能量高低
④Cr:1s22s22p63s23p63d44s2 ⑤Fe:1s22s22p63s23p63d64s2 ⑥Mg2+:1s22s22p6
8、以下是表示铁原子的3种不同化学用语。
未成对电子数?
结构示意图
电子排布式
电子排布图(轨道 表示式)
铁
原 子
1s22s22p63s23p 63d64s2
请你通过比较、归纳,分别说出3种不同化学用语所能 反映的粒子结构信息。
的基态原子核外有____2____个未成对电子,共有 ___1_4____种运动状态的电子, 有____5____种不同
能级的电子。基态Si原子中,电子占据的最高能层
符号为____M____,该能层具有的原子轨道数为 ___9_____,电子数为____4____。
铁原子的电子排布图 未成对电子个数?
B.碳原子由激发态变为基态
C.碳原子要从外界环境中吸收能量
D.碳原子要向外界环境释放能量
6
按要求填空。
未成对电子数?
(1)25Mn的电子排布式及电子排布图 _________1_s_2_2_s_22_p_6_3_s_2_3_p_63_d__54_s_2___________。
(2)29Cu的价电子排布式 ___________3_d_1_0_4_s1___________________。
泡利原理
↑↓
4s ↑↓ ↑↓ ↑↓
↑↓
3p
3s ↑↓ ↑↓ ↑↓
↑↓
2p
2s
↑↓
1s
↑↓ ↑ ↑ ↑ ↑
3d 洪特规则
能量最低原理
未成对电子数?
4.其中最能准确表示基态锰原子核外电子运动状
态的是( )
C
↑↓ ↑↓↑↓↑↓ ↑↓↑↓ ↑
↑↓ ↑↓↑↓↑↓
↑↓
↑↓
A
↑↑
↑↓↑↓↑↓ ↑ ↑ ↑ ↑ ↑
↑↑
↑↓↑↓↑↓
↑↑
↑↑
B
↑↑↑↑↑ ↑↓
↑↓↑↓↑↓
↑↓
↑↓↑↓↑↓ ↑↓
↑↓
C
↑↑↑↓↓ ↑↓
↑↓↑↓↑↓ ↑↓
↑↓↑↓↑↓ ↑↓
↑↓
D
5.当碳原子的核外电子排布由 ↑↓ ↑↓ ↑ ↑
1s 2s
2p
转变为
Hale Waihona Puke ↑↓ ↑3s 3p↑ ↑ ↑ 时,下列说法正确的是 ( A C )
3d
A.碳原子由基态变为激发态
相同能层
不同能层
1.下列对核外电子运动状态的描述正确的是
( D)
A.电子的运动与行星的运动相似,围绕原子 核在固定的轨道上高速旋转
B.能层数为3时,有3s、3p、3d、3f四个轨 道
C.氢原子中只有一个电子,故氢原子只有一 个轨道
D.在同一能级上运动的电子,其运动状态肯 定不同
2.下列有关电子云和原子轨道的说法正确的
是( D )
A.原子核外的电子像云雾一样笼罩在原子核 周围,故称电子云
B.s轨道呈球形,处在该轨道上的电子只能 在球壳内运动
C.p轨道呈哑铃形,在空间有两个伸展方向
D.与s电子原子轨道相同,p电子原子轨道的 平均半径随能层的增大而增大
3. 下列元素原子的电子排布式各违背了哪一规律?
(1)6C 1s22s22p2p2p
(1)洪特规则
(2)21Sc 1s22s22p63s23p63d3 (2)能量最低原理
(3)22Ti 1s22s22p63s23p10
(3)泡利原理
【解析】 从电子排布遵循的原则入手,看是否符
合能量最低原理、泡利原理、洪特规则及其特例。
2)Si的基态原子核外电子排布式1s为22_s_2_2_p_6_3_s_2,3pS2i
总结:
方法导引
解答基态原子电子排布问题的一般思路:
能量最低原则 确定原子序数 泡利不相容原理
电子排布 洪特规则
能级排布
总结:
构造原理: 1s;2s 2p;3s 3p;4s 3d 4p; 规律 5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d
一、原子核
能量最低原则
外电子排布 遵循的原理
泡利不相容原理
(3)35Br-的离子结构示意图 _____________________________________________
___________________________。
(4)7N的电子排布图 _____________________________________________
4 (5)基态铝原子核外电子云有________种不同的伸展方 13 向,共有____5____种不同能级的电子,有________种
不同运动状态的电子。
7.下列原子或离子的电子排布式或排布图正确 的是_①__⑤__⑥___(填序号,下同),违反能量最低 原理的是______②______,违反洪特规则的是
__③__④____,违反泡利原理的是__⑦______。
①Ca2+:1s22s22p63s23p6 ②F-:1s22s23p6
结构示意图:能直观地反映核内的质子数和核外的电子层数 及各能层上的电子数。
电子排布式:能直观地反映核外电子的能层、能级和各能级 上的电子数。
电子排布图:能反映各轨道的能量的高低及各轨道上的电子 分布情况,自旋方向。
作业:
1.分层训练P59-60 2.预习创设P7-8
