卤素含氧酸的稳定性及其盐氧化还原性的比较
(完整版)大学化学后7章答案

(完整版)⼤学化学后7章答案5.2 习题及详解⼀.判断题1.铝、铬⾦属表⾯的氧化膜具有连续结构并有⾼度热稳定性,故可做耐⾼温的合⾦元素。
(√)2.在Δr G -T图中,直线位置越低,Δf G 越负,则反应速率越快。
(×)3.Mg 是活泼⾦属,但由于常温下不与冷⽔反应,所以不容易腐蚀。
(×)4.Na 与H 2O 反应时,⽔是氧化剂。
(√)5.298K 时,钛可与氧、氮、硫、氧等⾮⾦属⽣成稳定化合物,故在炼钢时加⼊钛以除去这些杂质。
(×) 6.某溶液中可同时含有Na +、[Al(OH)4]- 和Cr 2O 72–。
(×)7.MnO 4–的还原产物只与还原剂有关。
(×)8.反应Zn(s)+Cu 2+(aq)→Zn 2+(aq)+Cu(s)的发⽣可⽤电离能说明。
(×)⼆.选择题1.下列元素在常温时不能与氧⽓(空⽓)作⽤的是(B )A . LiB . SnC . ScD .Mn2.常温下,在⽔中能稳定存在的⾦属是(D )A .CeB . CaC . CrD .Ni3.下列⾦属中,能与⽔蒸⽓作⽤⽣成相应氧化物的是(B )A .BaB .FeC .HgD . Pb4.过渡元素的下列性质中错误的是(A )A .过渡元素的⽔合离⼦都有颜⾊B .过渡元素的离⼦易形成配离⼦C .过渡元素有可变的氧化数D .过渡元素的价电⼦包括ns 和(n-1)d 电⼦5.第⼀过渡系元素的单质⽐第⼆、第三过渡系活泼,是因为(D )A .第⼀过渡系元素的原⼦半径⽐第⼆、第三过渡系⼩B .第⼆、第三过渡系元素的单质的外层电⼦数⽐第⼀过渡系多C .第⼀过渡系元素的离⼦最外层d轨道屏蔽作⽤⽐第⼆、第三过渡系的⼩D .第⼆、第三过渡系⽐第⼀过渡系元素原⼦的核电荷增加较多,且半径相近6.易于形成配离⼦的⾦属元素位于周期系中的(D )A .p 区B .s 区和p 区C .s 区和f 区D .d 区和 ds 区7.钢铁⼚炼钢时,在钢⽔中加⼊少量钛铁,是因为(A )A .钛铁可除去钢中的⾮⾦属杂质B .钛铁具有抗腐蚀性C .钛铁密度⼩D .钛铁机械强度⼤8.在酸性溶液中,下列各对物质能共存的是(C )A .SO 32- 、 MnO 4-B . CrO 2- 、 Sc 3+C .MnO 4- 、 Cr 2O 72-D . CrO 3 、 C 2H 5OH9.贮氢合⾦是两种特定⾦属的合⾦,其中⼀种可⼤量吸进氢⽓的⾦属是(D )A . s 区⾦属B .d 区⾦属C .ds 区⾦属D .稀⼟⾦属10.需要保存在煤油中的⾦属是(A )(A )Ce (B) Ca (C) Al (D) Hg θm θm三.填空1.将⾦属按化学活泼性分类,活泼⾦属元素在_ s 区和IIIB _____ 区,中等活泼⾦属元素在_ d ,ds ,P _____ 区,不活泼⾦属元素在__ d ,ds _____ 区。
(整理)3卤素的氧化物、含氧酸及其盐.
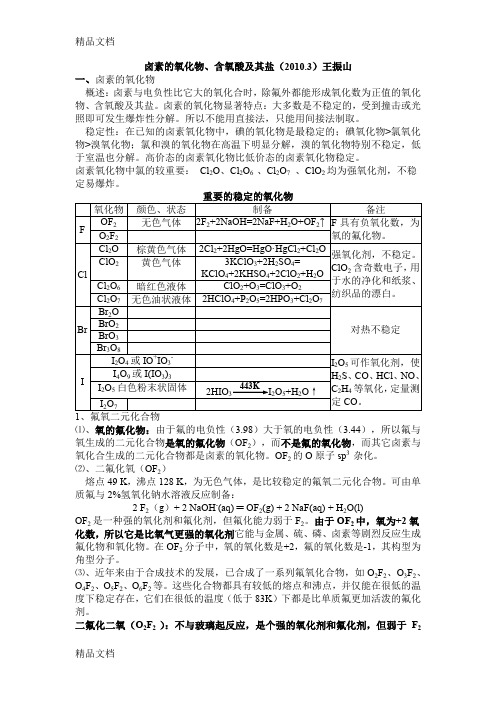
卤素的氧化物、含氧酸及其盐(2010.3)王振山一、卤素的氧化物概述:卤素与电负性比它大的氧化合时,除氟外都能形成氧化数为正值的氧化物、含氧酸及其盐。
卤素的氧化物显著特点:大多数是不稳定的,受到撞击或光照即可发生爆炸性分解。
所以不能用直接法,只能用间接法制取。
稳定性:在已知的卤素氧化物中,碘的氧化物是最稳定的;碘氧化物>氯氧化物>溴氧化物;氯和溴的氧化物在高温下明显分解,溴的氧化物特别不稳定,低于室温也分解。
高价态的卤素氧化物比低价态的卤素氧化物稳定。
卤素氧化物中氯的较重要:Cl2O、Cl2O6 、Cl2O7、ClO2均为强氧化剂,不稳定易爆炸。
⑴、氧的氟化物:由于氟的电负性(3.98)大于氧的电负性(3.44),所以氟与氧生成的二元化合物是氧的氟化物(OF2),而不是氟的氧化物,而其它卤素与氧化合生成的二元化合物都是卤素的氧化物。
OF2的O原子sp3杂化。
⑵、二氟化氧(OF2)熔点49 K,沸点128 K,为无色气体,是比较稳定的氟氧二元化合物。
可由单质氟与2%氢氧化钠水溶液反应制备:2 F2(g)+ 2 NaOH-(aq) ═ OF2(g) + 2 NaF(aq) + H2O(l)OF2是一种强的氧化剂和氟化剂,但氟化能力弱于F2。
由于OF2中,氧为+2氧化数,所以它是比氧气更强的氧化剂它能与金属、硫、磷、卤素等剧烈反应生成氟化物和氧化物。
在OF2分子中,氧的氧化数是+2,氟的氧化数是-1,其构型为角型分子。
⑶、近年来由于合成技术的发展,已合成了一系列氟氧化合物,如O2F2、O3F2、O4F2、O5F2、O6F2等。
这些化合物都具有较低的熔点和沸点,并仅能在很低的温度下稳定存在,它们在很低的温度(低于83K)下都是比单质氟更加活泼的氟化剂。
二氟化二氧(O2F2 ):不与玻璃起反应,是个强的氧化剂和氟化剂,但弱于F2本身:比OF2、ClF3有更强的氟化作用,能在OF2、ClF3不能完成的反应中将金属钚和钚的化合物氧化:Pu(s) + 3O2F2(g) →PuF6(g) + 3O2(g) 该反应用来从废核燃料中以挥发性PuF6的形式除去强放射性的金属Pu。
第12-16章 p区元素习题

第12-16章P区元素习题目录一判断题;二选择题;三填空题;四完成方程式;五计算并回答问题一判断题 (返回目录)1 硼在自然界主要以含氧化合物的形式存在。
()2 在硼与氢形成的一系列共价型氢化物中,最简单的是BH3。
()3 硼酸是三元酸。
()4 硼是非金属元素,但它的电负性比氢小。
()5 由于B-O键键能大,所以硼的含氧化合物很稳定。
()6 硼砂的化学式为Na2B2O7。
()7 B2H6为平面形分子。
()8 硼是缺电子原子,在乙硼烷中含有配位键。
()9 三卤化硼熔点的高低次序为BF3<BCl3<BBr3<BI3。
()10 三卤化硼沸点的高低次序为BF3>BCl3>BBr3>BI3。
()11 地壳中丰度最大的金属元素是铝。
()12 Al2O3是两性氧化物,因而各种晶型的Al2O3既可溶于酸,又可溶于碱。
()13 只有在强酸性溶液中才有Al(H2O)63+存在。
()14 在气相中三氯化铝以双聚分子Al2Cl6的形式存在。
()15 AlX3都是共价型化合物。
()16 KAl(SO4)2·12H2O与KCr(SO4)2·12H2O属于同分异构体。
()17 在氯化氢气流中加热金属铝可制得无水AlCl3。
()19 因AlCl3分子中Al为缺电子原子,所以AlCl3中有多中心键。
()20 碳酸盐的溶解度均比酸式碳酸盐的溶解度小。
()21 Na2CO3比NaHCO3的溶解度大,同理,CaCO3比Ca(HCO3)2的溶解度也大。
()22 硅在地壳中的含量仅次于氧。
()23 分子筛是人工合成的硅铝酸盐,具有吸附和催化作用。
()24 活性炭具有吸附作用,它是颗粒状的石墨。
()25 金刚石比石墨更稳定,即使在纯氧气中,金刚石也不能燃烧。
()26 一般情况下,CO2不能助燃,但是镁在二氧化碳气体中能燃烧。
()27 高纯度的硅和锗是良好的半导体。
()28 金刚石与石墨是同素异形体,由金刚石转变为石墨的△r H>0。
卤素的氧化物、含氧酸及其盐

卤素的氧化物、含氧酸及其盐(2010.3)王振山一、卤素的氧化物概述:卤素与电负性比它大的氧化合时,除氟外都能形成氧化数为正值的氧化物、含氧酸及其盐。
卤素的氧化物显著特点:大多数是不稳定的,受到撞击或光照即可发生爆炸性分解。
所以不能用直接法,只能用间接法制取。
稳定性:在已知的卤素氧化物中,碘的氧化物是最稳定的;碘氧化物>氯氧化物>溴氧化物;氯和溴的氧化物在高温下明显分解,溴的氧化物特别不稳定,低于室温也分解。
高价态的卤素氧化物比低价态的卤素氧化物稳定。
卤素氧化物中氯的较重要:Cl2O、Cl2O6 、Cl2O7、ClO2均为强氧化剂,不稳定易爆炸。
⑴、氧的氟化物:由于氟的电负性(3.98)大于氧的电负性(3.44),所以氟与氧生成的二元化合物是氧的氟化物(OF2),而不是氟的氧化物,而其它卤素与氧化合生成的二元化合物都是卤素的氧化物。
OF2的O原子sp3杂化。
⑵、二氟化氧(OF2)熔点49 K,沸点128 K,为无色气体,是比较稳定的氟氧二元化合物。
可由单质氟与2%氢氧化钠水溶液反应制备:2 F2(g)+ 2 NaOH-(aq) ═ OF2(g) + 2 NaF(aq) + H2O(l)OF2是一种强的氧化剂和氟化剂,但氟化能力弱于F2。
由于OF2中,氧为+2氧化数,所以它是比氧气更强的氧化剂它能与金属、硫、磷、卤素等剧烈反应生成氟化物和氧化物。
在OF2分子中,氧的氧化数是+2,氟的氧化数是-1,其构型为角型分子。
⑶、近年来由于合成技术的发展,已合成了一系列氟氧化合物,如O2F2、O3F2、O4F2、O5F2、O6F2等。
这些化合物都具有较低的熔点和沸点,并仅能在很低的温度下稳定存在,它们在很低的温度(低于83K)下都是比单质氟更加活泼的氟化剂。
二氟化二氧(O2F2 ):不与玻璃起反应,是个强的氧化剂和氟化剂,但弱于F2本身:比OF2、ClF3有更强的氟化作用,能在OF2、ClF3不能完成的反应中将金属钚和钚的化合物氧化:Pu(s) + 3O2F2(g) →PuF6(g) + 3O2(g) 该反应用来从废核燃料中以挥发性PuF6的形式除去强放射性的金属Pu。
卤素的含氧酸及其盐

卤素的含氧酸及其盐Cl、Br、I具有不同价态的含氧酸。
X: 采取SP3杂化:O的2P电子与卤素3d空轨道间形成d-pπ键。
由于稳定性原因,只有常见的氯的含氧酸研究得多。
一、次卤酸1. 化学性质(1) 酸性因为随半径增大,分子中 H— O—X,X—O 结合力减小,X 对 H+斥力变小,导致酸性减小。
(2) 热稳定性HXO都不稳定,仅存在于水溶液中,从Cl到I稳定性减小,分解方式:脱水分解:由上式可知,ClO是HClO的酸酐。
BrO-室温下发生歧化分解,只有在273K2-盐。
可见XO-的歧时才有BrO- 存在, 323 ~ 353K时,BrO-完全转变成BrO3化速率与温度有关,温度升高,歧化速率增大。
IO-歧化速率更快,溶液中不存在次碘酸盐,HIO几乎不存在。
(3) 氧化性HXO不稳定,表明HXO的氧化性很强。
XO-盐比HXO酸稳定性高,所以经常用其盐在酸性介质中做氧化剂。
2.HXO的制备1)次氯酸酐Cl2O溶于水制得HClO步骤:将Cl2通到新制干燥的HgO表面,加热制得Cl2O从体系中除去HCl可使平衡右移,可采用下法。
在Cl2水中加入新生成的HgO或碳酸盐减压蒸馏得到HClO。
工业上采用电解冷的稀NaCl溶液的方法。
同时搅拌电解液,使产生的氯气与NaOH充分反应制得次氯酸钠减压蒸馏得HClO。
将阳极产生的Cl2通入阴极区NaOH中。
二、亚卤酸及其盐1.性质亚卤酸中仅存在HClO2,酸性大于HClO,Ka=5.0HClO2不稳定,ClO2-在溶液中较稳定,具有强氧化性,NaClO2盐较稳定,加热,撞击爆炸分解,在溶液中受热分解。
2. 制备方法1)过滤除去BaSO4可制得纯净HClO2,但HClO2不稳定,很快分解。
可见ClO2不是HClO2的酸酐,ClO2冷凝时为红色液体。
2) ClO2与碱作用可得到亚氯酸盐和氯酸盐。
首先制取ClO2,其方法用SO2还原NaClO33) Na2O2(H2O2)与ClO2作用制备纯NaClO2。
十招比较氧化性还原性强弱

十招比较氧化性、还原性强弱氧化性、还原性的强弱即物质得、失电子能力强弱。
得电子能力强的物质氧化性强,失电子能力强的物质还原性强,且氧化性、还原性的强弱只与该物质得失电子的难易程度有关,而与得失电子数目的多少无关。
氧化性和还原性的相对强弱是物质的本性,但也与外界的诸多因素有关,我们一般比较氧化性和还原性时往往针对的是物质在外界因素相近的情况。
中学常见有如下比较方法:(1)直接比较:如果两种待比较的物质能够直接发生氧化还原反应,充当氧化剂的物质比充当还原剂的物质的氧化性要强。
如需比较硫和氧气的氧化性强弱时,直接根据硫在氧气中燃烧生成二氧化硫的反应,可以判断氧气的氧化性比硫的氧化性要强。
(2)根据物质所含元素化合价的高低判断:对于同种元素的不同价态而言,一般价态越高,其氧化性就越强,价态越低,还原性就越强。
如:氧化性 FeCl3 >FeCl 2、 KMnO 4> K 2MnO 4 >MnO2 >Mn 2+;这里需注意的是:一,必须是指不同物质中的同种元素;二,存在一组特殊物质——卤素含氧酸。
例如高氯酸、氯酸、亚氯酸、次氯酸的氧化性顺序却恰好相反,次氯酸氧化性最强,高氯酸氧化性最弱。
(3)根据产物中化合价的变化情况判断:几种氧化剂和同种还原剂发生反应,氧化产物中所含元素化合价升高的越多,对应的氧化剂氧化性越强。
例如:氯气和硫分别可以和铁发生反应,分别生成氯化铁和硫化亚铁。
氯化铁中铁元素的化合价为 +3 价、硫化亚铁中铁的化合价为 +2 价,由此可以判断:氯气的氧化性比硫的氧化性强。
(4)可根据氧化还原规律比较:在氧化还原反应中:氧化性:氧化剂> 氧化产物;还原性:还原剂 >还原产物。
运用这个规律时应当注意,该规律一般适用于溶液中的氧化还原反应,如果在高温或者加热时的氧化还原反应,有可能不符合这个规律。
例如:在溶液中,铁和盐酸反应生成氢气,此时,铁是还原剂、氢气是还原产物,得到结论:还原性Fe>H2;而在加热时,氢气与氧化铁反应可得到单质铁,此时氢气是还原剂,铁是还原产物,得到结论:还原性H2> Fe o那么到底如何比较氢气和铁的还原性强弱呢?正是由于该规律的适用条件,我们才能确定:一般来说,铁的还原性大于氢气。
无机化学p区元素习题

P区元素习题目录一判断题;二选择题;三填空题;四完成方程式;五计算并回答问题一判断题 (返回目录)1 硼在自然界主要以含氧化合物的形式存在。
()2 在硼与氢形成的一系列共价型氢化物中,最简单的是BH3。
()3 硼酸是三元酸。
()4 硼是非金属元素,但它的电负性比氢小。
()5 由于B-O键键能大,所以硼的含氧化合物很稳定。
()6 硼砂的化学式为Na2B2O7。
()7 B2H6为平面形分子。
()8 硼是缺电子原子,在乙硼烷中含有配位键。
()9 三卤化硼熔点的高低次序为BF3<BCl3<BBr3<BI3。
()10 三卤化硼沸点的高低次序为BF3>BCl3>BBr3>BI3。
()11 地壳中丰度最大的金属元素是铝。
()12 Al2O3是两性氧化物,因而各种晶型的Al2O3既可溶于酸,又可溶于碱。
()13 只有在强酸性溶液中才有Al(H2O)63+存在。
()14 在气相中三氯化铝以双聚分子Al2Cl6的形式存在。
()15 AlX3都是共价型化合物。
()16 KAl(SO4)2·12H2O与KCr(SO4)2·12H2O属于同分异构体。
()17 在氯化氢气流中加热金属铝可制得无水AlCl3。
()19 因AlCl3分子中Al为缺电子原子,所以AlCl3中有多中心键。
()20 碳酸盐的溶解度均比酸式碳酸盐的溶解度小。
()21 Na2CO3比NaHCO3的溶解度大,同理,CaCO3比Ca(HCO3)2的溶解度也大。
()22 硅在地壳中的含量仅次于氧。
()23 分子筛是人工合成的硅铝酸盐,具有吸附和催化作用。
()24 活性炭具有吸附作用,它是颗粒状的石墨。
()25 金刚石比石墨更稳定,即使在纯氧气中,金刚石也不能燃烧。
()26 一般情况下,CO2不能助燃,但是镁在二氧化碳气体中能燃烧。
()27 高纯度的硅和锗是良好的半导体。
()28 金刚石与石墨是同素异形体,由金刚石转变为石墨的△r H>0。
从卤素键能来理解稳定性和活泼性

从卤素键能来理解稳定性和活泼性化学上常涉及“活泼性”和“稳定性”这两个非常重要的概念,例如:“金属(或非金属)的活泼性”;“气态氢化物的稳定性”、“酸的稳定性”等等。
在必修课的学习中我们没有进行仔细区分,但是选修3关于共价键参数中给了一系列键能数据,特别是卤素单质的键能数据,不追究还真就糊涂了。
从上面的键能数据可知,F的键能反常的小,这个反常的原因可以这样简单理解。
因为2F的半径特别小,电负性特别大,导致原子核靠得很近,核间排斥力增大,反而是化学键不够稳定,所以键能特别小。
通常而言,很活泼的物质稳定性就差,很稳定的物质活泼性就差。
但是“活泼性”和“稳定性”两者所研究的对象往往是有所区别的。
“活泼性”通常是指物质的得或失电子的过程,例如:“碱金属是活泼的金属”,“卤素是活泼的非金属”。
稳定性分为两种情况:一是化学稳定性,;二是热稳定性。
化学稳定性通常是指物质因水解、氧化(或还原)而是否变质的化学过程。
热稳定性是指物质在常温下或受热时是否分解的化学过程。
以下就是一些物质热稳定性的判断规律:1.一般而言,单质的热稳定性与构成单质的化学键牢固程度正相关;而化学键牢固程度又与键能正相关。
具体来说:单质稳定性是指分子内原子间的键能大,化学键不易断裂;所以F2的稳定性不如氯气。
活泼性是指分子发生化学反应的容易与否。
不过单质的稳定性很少单独使用,不能单纯的因为稳定性高低来判断反应活性。
因为单质参与反应的过程实际分两个步骤,一是吸收键断裂所需的能量,将分子分解为原子(体现键能——稳定性),二是将不同原子重新结合形成新物质(体现非金属性)。
由于一般反应中供应的能量都很大,很少存在能量不够一个分子反应的情况,当所供应的能量都足够的时候,毫无疑问由非金属性强弱决定反应的容易与否。
意思是非金属性越强,反应活性越高。
例如:对于卤素来说,虽然其键能递减(除F2,因为F半径很小,斥力很大则使得键能反常减小),分子越来越不稳定,断裂成原子越来越容易。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
卤素含氧酸的稳定性及其盐氧化还原性的比较
姓名:杨颖聪指导教师:桑亚丽
赤峰学院化学系09级化学本科班
引言
恩格斯说过:“科学的发生和发展过程,归根结底是由生产所决定的。
”化学正像其他学科一样,是人类活动实践的产物。
那么,化学研究的是什么呢?简单地说,化学就是研究物质的组成、结构、性质和变化的科学。
下面,就卤素含氧酸的稳定性及其盐氧化还原性做如下讨论:
一、卤素及其含氧酸(盐)的结构特征
1、卤素原子的结构特征
元素周期系第ⅦA族元素包括氟、氯、溴、碘和砹五种元素,总称为卤素。
卤族元素都是典型的非金属,其价层电子构型均为ns2np5,它们很容易得到一个电子形成卤离子,或与另一个原子形成共价键,所以卤素原子都能以-1氧化态形式存在[1]。
除氟外,在一定的条件下,氯、溴、碘的外层ns np成对电子受激发可跃迁到nd轨道,nd轨道也参与成键,故可呈现+Ⅰ、+Ⅲ、+Ⅴ、+Ⅶ氧化态,这些氧化态突出地表现在氯、溴、碘的含氧化合物或含氧酸根中,如:+1: HXO (次卤酸)、+3: HXO₂(亚卤酸)、+5: HXO₃(卤酸)、+7: HXO₄(高卤酸)。
2.卤素含氧酸(盐)的结构特征:
含氧酸是酸根中含有氧原子的酸。
非金属元素的含氧酸的酸根,即含氧阴离子,属于
多原子离子。
在这样的离子中,中心成键原子与氧原子之间除了形成σ键以外,还可能形成
π键,不过由于中心原子的电子构型不同,形成的π键类型不完全一样[2]。
但是,在这些
含氧酸的结构中,都含有X─O─H键,有的亦含有X─O键等。
二、卤素含氧酸(盐)的稳定性
1、影响含氧酸(盐)热稳定性的因素:
含氧酸(盐)的热稳定性与含氧酸根离子的变形性和阳离子的极化作用有关,组成盐的
阳离子的离子热越大,且阴离子的变形性越大,则极化作用越强,越易于分解;其次,含氧
酸盐分解的焓变大小也是其影响热稳定性的主要因素。
一般来讲,分解焓变越大,盐的热稳
定性越高【3】。
2、含氧酸(盐)的稳定性规律:
绝大多数含氧酸的热稳定性差,受热脱水生成对应的酸酐。
酸不稳定,其对应的盐也不稳定;酸较稳定,其对应的盐也较稳定;同一种酸的盐,热稳定性:正盐>酸式盐>酸;同一酸根的盐的热稳定性顺序是:碱金属盐>过渡金属盐>铵盐;同一成酸元素,其高价含氧酸比低价含氧酸稳定,其相应含氧酸盐的稳定性顺序也是如此。
三、卤素含氧酸(盐)的氧化还原性
1、氧化性与介质酸度:
在氧化还原反应中,介质的酸度越高,则含氧酸的氧化性越强。
因为一方面酸度能影响电极电势,氢离子参与电极反应,且与电对中的氧化型位于电极反应的同一侧,从能斯特方程中可以看出,氢离子浓度越高,φ越正,含氧酸的氧化性越强;另一方面,在某些反应中,反应速度与氢离子浓度有一定的关系,例如BrO3-氧化I-的反应,速度对氢离子浓度为二级反应:
V=K[BrO3-][I-][H+]
氢离子主要通过质子化含氧酸阴离子起作用,使中心原子与氧原子之间的电子密度下降,活化含氧酸根,转变O2-为OH-,继而成为水。
因此,当酸度增大,含氧酸成为更强氧化剂的同时,它的反应速率也增大,动力学与热力学因素二者结合,使强氧化剂的氧化反应迅速发生。
2、氧化性与氧化还原反应中非氧化还原过程的能量效应:
在实际的氧化还原反应过程中常伴随有一些非氧化还原过程的发生,如水的生成、溶剂化和去溶剂化作用、沉淀的生成以及缔合等,这些过程的能量效应有时在总的能量效应中占有很大比重。
如果这些过程放出的净能量越多,或者更确切地说是降低自由能越多,则总反应进行趋势越大,即含氧酸的氧化性越强。
我们知道一种含氧酸作同样氧化态的变化时,在酸性溶液中的氧化性比在碱性溶液中强,例如:
ClO4-+ 8 H++ 8е- Cl- + 4H2O ; φθ=1.34v
ClO4-+ 4H2O + 8е- Cl- + 8OH- ; φθ=0.512 v
在总的氧化还原反应中,如果非氧化还原过程降低的自由能越多,将促使总反应的自发进行,即增强了含氧酸盐的氧化性。
3、氧化性和分子的稳定性:
一般来说,如果含氧酸分子中的中心原子R多变价,分子又不稳定,该含氧酸(盐)就有氧化性,而且分子越不稳定,其氧化性越强。
含氧酸分子的稳定性与分子中R-O键的强度和键的数目有关[4]。
键的数目越多,R-O键的强度越大,要断裂这些键,使高氧化态的
4、影响含氧酸(盐)的氧化能力的主要因素:
中心原子结合电子的能力。
含氧酸(盐)的氧化能力是指处于高氧化态的中心原子在它转变为低氧化态过程中获得电子的能力,这种能力与它的电负性、原子半径及氧化态等因素有关。
若中心原子的原子半径小、电负性大,获得电子的能力强,其含氧酸(盐)的氧化性也就强,反之,氧化性则弱。
同一主族的元素,从上到下电负性减小,原子半径增大,低氧化态含氧酸(盐)的氧化性依次递减,如,HClO >HBrO > HIO。
5、卤素含氧酸(盐)的氧化还原性强弱规律:
(1)、无论在酸性还是碱性条件下,卤素离子X-都是卤素的热力学的稳定状态;
(2)、卤素各氧化态的含氧酸及其盐的氧化能力在酸性条件下都比碱性条件下强;
(3)、同一卤素不同价态的含氧酸及其盐氧化性一般随卤素原子氧化数的升高依次减弱(指还原同一低价态X-或X₂而言),此结论对于氯无论在酸性还是碱性条件都符合,而溴和碘规律性差,多成锯齿形变化,同一氧化态不同卤素含氧酸及其盐氧化能力从氯到碘一般是减弱的,但对于高溴酸和溴酸却反常,它们都具有很强的氧化性,分别比高氯酸和氯酸的氧化性强。
四、对氯的含氧酸(盐)的氧化性的解释
氯作为一种重要的元素,它的不同氧化态的含氧酸有HClO、HClO2、HClO3、HClO4四种。
在水溶液中,它们的氧化性强弱可用标准电极电势Eθ来衡量,查有关的Eθ可知,在碱性介质中,其氧化性强度次序为ClO->ClO2->ClO3->ClO4-,在酸性介质中,其
氧化性强度次序为HClO2> HClO>HClO3>HClO4,因此,氯的含氧酸的氧化性不论在酸性介质中还是在碱性介质中,一般是随着氧化态升高,氧化性减弱[5]。
但是,这种变化趋势在碱性介质中是很有规律的,但在酸性介质中却表现出“不规则”现象,即HClO2氧化性反而比HClO强。
讨论在不同介质中氯的含氧酸的氧化性变化规律。
以Cl-O键的强度对含氧酸氧化性的影响为例,讨论氯的含氧酸的氧化性变化规律:在碱性介质中,HClO、HClO2是弱酸,但它们与强酸HClO3、HClO4一样,均以氯的含氧酸根形式存在。
因此,在不同氯的含氧酸根中Cl- O的强度、键数是决定其氧化性强
度的重要因素,在ClO-、ClO2-、ClO3-、ClO4-中,Cl- O键数分别为1、2、3、4。
又由于中心原子Cl用sp3杂化轨道中的孤对电子与氧原子的空轨道(腾出一个p轨道)形成σ键的同时,氧原子上的孤对电子与中心原子Cl的空d轨道形成了d-pπ键(反馈键),增加了键的强度,按ClO-、ClO2-、ClO3-、ClO4-顺序Cl-O键数增多,Cl- O键d-p 反馈键数也增多,键也愈强。
表-1列出了氯的四种不同氧化态含氧酸根中Cl- O键的键长和键能[5.6]。
由表-1数据可见,从ClO-到ClO4-,由于Cl与O原子之间形成了d-pπ键,Cl- O键的键长依次缩短,其键能依次增大,因此,破坏ClO4-结构消耗的能量最少,故在碱性介质中,从ClO-到ClO4-,其氧化性依次减弱,表现出很强的规律性。
五、卤素含氧酸及其盐的氧化性与其热稳定性之间的关系
卤素含氧酸及其盐的氧化性与热稳定性之间有一定的联系,一般来说,热稳定性越小的越易分解并引起中心原子X的氧化值降低,从而使氧化性增强[。
卤素的含氧酸与其相应盐比较,由于与酸根结合的H+半径特别小,对氧原子的极化能力比含氧酸盐中的金属离子(M +)强,因此在一定程度上削弱了H—O基与X的结合力,从而使含氧酸的热稳定性减弱,氧化性增强。
参考文献
[1]、华东化工学院无机化学教研组编,无机化学教学参考书.北京:高等教育出版社,1983.193~217
[2]、北京师范大学等编.无机化学(下册).第三版,北京:高等教育出版社,1992.644 [3]、无机化学教研室.无机化学[M].北京:高等教育出版社.(第四版).2003:617-621. [4]、杨频,高教恢编著。
性能—结构—化学键。
北京:高等教育出版社,1987. 252 [5]、黄佩丽.无机化学规律初探[M]. 北京:北京师范大学出版社,1983.119
[6]、[美]J.J拉戈斯基,现代无机化学(下册)[M]. 北京:高等教育出版社,1983.590。
