[理学]第四讲:热力学第一定律
热力学第一定律简述

热力学第一定律简述《热力学第一定律》是物理学中非常重要的一条定律,被称为“热力学三大定律”之一。
这一定律由德国物理学家弗里德里希蝴蝶(Friedrich Hermann von Helmholtz)提出,它宣称,任何动力学变化的改变都伴随着势能的变化,即动能的变化可以转换为热能。
由于势能变化和热能变化的相互关系,热力学得以成立。
热力学第一定律,也称为Helmholtz定律,其简单来说是:“在完全可定义的力学过程中,可以计算出全部热力学计算量,而这些热力学计算量完全相等。
”换句话说,在完全可定义的力学过程中,可以计算出所有变化的总能量。
这一定律表明,总能量在这一过程中是守恒的,它是描述热力学过程的基础。
热力学第一定律的由来也可以追溯到17世纪,时至今日它仍是物理学中最基础的原理之一。
英国物理学家叔本华(Isaac Newton)曾指出,他试图将物理学和化学联系起来,从而发展出动力学和热力学,他说:“能量是守恒的,但不是保持不变的”。
他的观点表明,能量守恒的概念形成了热力学的基础。
热力学第一定律的另一种表述是这样的:“在物理可定义的过程中,总能量不会减少或增加,因为能量是守恒的。
”这个定律有几个重要的含义:它意味着能量在物理过程中可以在形式上转换,但总量是不变的;它也意味着,在热力学过程中,能量在过程中只能转换,不能新增或减少。
热力学第一定律有其他重要的推论,例如热力学第二定律,它表明,生物体在维持热力平衡时,存在着温度差和能量流动,因此温度和熵也是能量守恒的载体。
它表明,动物体能量的改变本质上是由温度差引起的,这也是动物体维持生命的重要原理。
热力学第一定律的意义重大,它得到了广泛的应用,它对所有自然现象的解释都有着重要的作用。
它使热力学成为真正可用的工具,使得可以准确地预测物理系统的热力行为,从而为诸如热物理学、动力学等研究领域带来了重要的贡献。
热力学第一定律的发现使物理学的发展变得更加完整,为人类文明的发展做出了重要的贡献。
热力学第一定律

热力学第一定律热力学是一门研究能量转换与传递规律的学科,它主要研究热现象与其他物理现象之间的相互关系。
热力学第一定律,也称作能量守恒定律,是热力学的基本原理之一。
本文将介绍热力学第一定律的基本概念和应用。
一、热力学第一定律的概念热力学第一定律是能量守恒定律在热学领域的表述。
它指出:在一个孤立系统中,总能量的变化等于系统所接受的热量与所做的功之和。
这个定律可以用以下公式表示:ΔE = Q - W其中,ΔE表示系统内能的变化,Q表示系统所接受的热量,W表示系统所做的功。
二、热力学第一定律的应用1. 热力学循环热力学循环是指一系列经历几个步骤的热能转换过程,最后回到初始状态的过程。
根据热力学第一定律,一个理想的热力学循环的净输入输出功为零,即总输入热量等于总输出功。
这一定律被广泛应用于热能转换设备的设计和研究中。
2. 热机效率热机效率是衡量热能转化的性能指标,是指输出功与输入热量之比。
根据热力学第一定律,对于一个正循环热机,其效率可以通过以下公式计算:η = 1 - Qc / Qh其中,η表示热机效率,Qc表示效率造成的能量损失,Qh表示输入的热量。
3. 热力学过程热力学过程是一个系统经历的状态变化过程,根据热力学第一定律,对于一个孤立系统来说,其内能的变化等于系统所接受的热量和所做的功之和。
这一定律不仅适用于准静态过程,也适用于非准静态过程,为热力学过程的分析提供了基础。
4. 热力学平衡热力学平衡是指在一个封闭系统中,各部分之间没有能量的净交换,即系统内外没有能量的流动。
根据热力学第一定律,当一个系统达到热力学平衡时,系统内能的变化为零,即ΔE = 0。
热力学平衡在热力学研究中起着重要的作用。
三、总结热力学第一定律是热力学的基本原理之一,它描述了系统能量转换与传递的规律。
在热力学循环、热机效率、热力学过程和热力学平衡等方面都有广泛的应用。
热力学第一定律的核心是能量守恒定律,对于热学领域的研究具有重要意义。
热力学知识:介绍热力学第一定律

热力学知识:介绍热力学第一定律热力学是许多领域的基础知识,热力学第一定律是其中最基础的
定律之一。
热力学第一定律是热力学中最基本的定律之一,也被称作“能量守恒定律”,因为它表达了热力学中的能量守恒原则。
热力学第一定律可以用如下方式表述:“能量不能创造或者消失,在一个系统中,能量的总量是始终不变的,只能由一种形式转化为另
一种形式,如机械能,电能,热能等。
”
这个定律的实质是表明,在一个孤立系统中,系统的本质是能量
守恒的。
在一个孤立系统中,任何能量的转化都需要考虑所有能量形
式的变化和转化,比如机械能转化为热能的过程。
系统的总能量是守
恒的,无论是转化的内能、热能、电能,还是动能,都会守恒。
我们可以用一个简单的实例来解释这个定律:一杯水在微波炉里
被加热,水的温度开始上升。
这个过程中,微波炉所提供的能量转化
成了水的热能,这是一种能量的转化。
这个转化是基于热力学第一定
律的基本原理。
当涉及到孤立系统时,这个定律显得更为重要,一个孤立系统没
有外部能量的输入或输出。
在这种情况下,系统内部的能量无法创造
或消失,必须转化为其他形式。
我们的宇宙可以被视为一个孤立系统,其中所有事物的能量守恒。
总的来说,热力学第一定律是热力学最基础的定律之一,表达了
能量守恒原则,由于所有物理系统都需要符合这个原则,因此具有普
适性,而且是热力学或其他物理领域中所有基本原理和定律的基础。
物理化学热力学第一定律

物理化学热力学第一定律
热力学第一定律就是不同形式的能量在传递与转换过程中守恒的定律,表达式为△U=Q+W。
表述形式:热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。
该定律经过迈耳、焦耳等多位物理学家验证。
热力学第一定律就是涉及热现象领域内的能量守恒和转化定律。
十九世纪中期,在长期生产实践和大量科学实验的基础上,它才以科学定律的形式被确立起来。
埃瓦特对煤的燃烧所产生的热量和由此提供的“机械动力”之间的关系作了研究,建立了定量联系。
[理学]第四讲:热力学第一定律
![[理学]第四讲:热力学第一定律](https://img.taocdn.com/s3/m/c6f599ee5ff7ba0d4a7302768e9951e79b896936.png)
于p(环)。
2021/12/28
23
第二十三页,共116页。
3.恒容过程 :系统状态发生变化时,系统的体积始终不变。
4.绝热过程(adiabatic process,adia.):系统状态变化时与环境无热交换。
5.循环过程(cyclic process):当系统由始态经历一系列具体途径后又
回到原来状态的过程。
循环过程的特点: 系统所有状态函数变化量均为零
但变化过程中,系统与环境交换的功与热却往往不为零。
2021/12/28
24
第二十四页,共116页。
例 1:等 T 过程:理气的等温膨胀过程
(298K, 5Pθ, 1dm3 ) 298K (298K, Pθ, 5dm3 )
2. 力平衡(mechanical equilibrium):(无刚性壁时)系统内
各部分的压力相等,即处于力平衡。
3. 相平衡(phase equilibrium):当系统不止一相时,达平衡后各
相的组成和数量不随时间而改变,即处于相平衡。
4. 化学平衡(chemical equilibrium):有化学反应时,达
2021/12/28
3
第三页,共116页。
§4-1 热力学概论
一. 概论 1. 热力学是物理学的一个分支 共有三条基本定律。第一定律能量转化过程
中的数量守恒;第二定律能量转化过程中进
行的方向和限度;第三定律低温下物质运动
状态,并为各种物质的热力学函数的计算提
供科学方法。 4 第四页,共116页。
2. 热力学应用于研究化学——化学热力学 把热力学中的基本原理用来研究化学现象
热力学第一定律(高中物理教学课件)完整版
2.应用热力学第一定律解题的一般步骤: ①根据符号法则列出各已知量(W、Q、ΔU)的正 负; ②根据方程ΔU=W+Q求出未知量; ③再根据未知量结果的正负来确定吸放热情况、 做功情况或内能变化情况
二.热力学第一定律的应用
3. 气体状态变化的几种特殊情况:
①绝热过程:Q=0,则ΔU=W,不发生热传递,系统内 能的变化只与做功有关(分绝热膨胀和绝热压缩) ②等温过程: ΔU=0,则W=-Q,气体内能不变,外 界对气体做的功与气体吸收的热量等值异号(分等温膨 胀和等温压缩) ③等容过程:W=0,则ΔU=Q,气体不做功,系统内能 的变化只与热传递有关(分升温升压和降温降压) ④等压过程:等压膨胀,温度升高,内能增加,对外做 功,气体吸热;等压压缩,温度降低,内能减少,对内 做功,气体放热
解:根据热力学第一定律:U W Q 2.5105 J 1.2105 J Q
Q 1.3105 J, 气体向外界放热1.3105 J的功
二.热力学第一定律的应用
1.判断气体是否做功的方法: 一般情况下看气体的体积是否变化. ①若气体体积增大,表明气体对外界做功,W<0 ②若气体体积减小,表明外界对气体做功,W>0
例13. (多选)如图是某喷水壶。未喷水时阀门闭合,压 下压杆可向瓶内储气室充气;多次充气后按下按柄打开
阀门,水会自动经导管从喷嘴处喷出。储气室内气体可
热力学第一定律

1.热力学第一定律热力学第一定律的主要内容,就是能量守恒原理。
能量可以在一物体与其他物体之间传递,可以从一种形式转化成另一种形式,但是不能无中生有,也不能自行消失。
而不同形式的能量在相互转化时永远是数量相当的。
这一原理,在现在看来似乎是顺理成章的,但他的建立却经历了许多失败和教训。
一百多年前西方工业革命,发明了蒸汽机,人们对改进蒸汽机产生了浓厚的兴趣。
总想造成不供能量或者少供能量而多做功的机器,曾兴起过制造“第一类永动机”的热潮。
所谓第一类永动机就是不需供给热量,不需消耗燃料而能不断循环做工的机器。
设计方案之多,但是成千上万份的设计中,没有一个能实现的。
人们从这类经验中逐渐认识到,能量是不能无中生有的,自生自灭的。
第一类永动机是不可能制成的,这就是能量守恒原理。
到了1840年,由焦耳和迈尔作了大量试验,测量了热和功转换过程中,消耗多少功会得到多少热,证明了热和机械功的转换具有严格的不变的当量关系。
想得到1J的机械功,一定要消耗0.239卡热,得到1卡热,一定要消耗4.184J的功,这就是著名的热功当量。
1cal = 4.1840J热功当量的测定试验,给能量守恒原理提供了科学依据,使这一原理得到了更为普遍的承认,牢牢的确立起来。
至今,无论是微观世界中物质的运动,还是宏观世界中的物质变化都无一例外的符合能量守恒原理。
把这一原理运用到宏观的热力学体系,就形成了热力学第一定律。
2.热力学第二定律能量守恒和转化定律就是热力学第一定律,或者说热力学第一定律是能量守恒和转化定律在热力学上的表现。
它指明热是物质运动的一种形式,物质系统从外界吸收的热量等于这个能的增加量和它对外所作的功的总和。
也就是说想制造一种不消耗任何能量就能永远作功的机器,即“第一种永动机”,是不可能的。
人们继续研究热机效率问题,试图从单一热源吸取能量去制作会永远作功的机器,这种机器并不违背能量守恒定律,只需将热源降温而利用其能量推动机器不断运转。
热力学第一定律 课件

(3)若过程的始末状态物体的内能不变,即 ΔU=0,则 W+Q=0 或 W=-Q,
外界对物体做的功等于物体放出的热量。
4.判断是否做功的方法
一般情况下外界对物体做功与否,需看物体的体积是否变化。
(1)若物体体积增大,表明物体对外界做功,W<0;
(2)若物体体积变小,表明外界对物体做功,W>0。
为另一种形式,或者从一个物体转移到别的物体,在转化或转移的过程中,能
量的总量保持不变。
2.意义
(1)能量守恒定律告诉我们,各种形式的能量可以相互转化。
(2)各种互不相关的物理现象——力学的、热学的、电学的、磁学的、
光学的、化学的、生物学的等可以用能量守恒定律联系在一起。
三、永动机不可能制成
1.第一类永动机:人们设想中的不需要任何动力或燃料,却能不断地对
提示前者能制成而后者不能制成。这是因为可以用太阳能、电能等
能源代替石油能源制造出太阳能汽车、电动汽车等,但是不消耗任何能量
的汽车不可能制成,因为它违背能量守恒定律。
2.热力学第一定律与能量守恒定律是什么关系?
提示能量守恒定律是各种形式的能相互转化或转移的过程,总能量保
持不变,它包括各个领域,其范围广泛。热力学第一定律是物体内能与其他
(2)突破了人们关于物质运动的认识范围,从本质上表明了各种运动形
式之间相互转化的可能性。能量守恒定律比机械能守恒定律更普遍,它是物
理学中解决问题的重要思维方法。能量守恒定律与细胞学说、生物进化论
并称 19 世纪自然科学中三大发现,其重要意义由此可见。
(3)具有重大实践意义,即彻底粉碎了永动机的幻想。
外做功的机器。
2.第一类永动机不可制成的原因:违背了能量守恒定律。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
pV= nRT
(道尔顿)分压定律 (1801)
内容:总压力等于分压力之和。
p = p1+p2+…+pN = pi
注意:
——分压力(partial pressure) :温度为 T时组分 i单独占据总 体积 V时所具有的压力。定义此压力为混合气体中i组分的 分压力(注意不同教材关于分压力有不同的定义)
2019/1/6 5
3. 典型事例,说明化学热力学的应用
a. 熔炉炼铁:Fe3O4 + 4CO → 3Fe + 4CO2
b. 人造金刚石: C(石墨)→C(金刚石) 由热力学知道 P>15000P° 时,才有可能;
今天已实现了这个转变(60000P°,1000℃, 催化剂)
二. 热力学研究方法的特点和局限性
2019/1/6 27
——分压定律是气体遵守IG定律的必然结果
p = nRT/V = n1RT/V+n2RT/V+…+nNRT/V =niRT/V = p1+p2+…+pN = pi
——分压定律的另一形式: yi——i组分的摩尔分数(mole fraction)(气体混合物的 摩尔分数常用yi表示,液体混合物的摩尔分数,则常用xi 表示)该式是分压定律的另一种形式。
可能有物质或能量交换)的有限部分物质。
说明:
——系统与环境之间可以有实际的界面,也可以没有实际的界 面。 例:一钢瓶氧气: ——研究其中全部气体:有界面(内壁)。 ——研究其中部分气体:只有想象的界面。 ——按系统与环境之间是否有能量交换与物质交换,可把系统分
2019/1/6 10
1. 隔离(孤立)系统(isolated system) :与环境之间既
安
2019/1/6
8
学习要点:
吃透基本概念;特别注意条件。
最重要的基本概念:
状态函数;可逆过程
2019/1/6
9
§4.2 热力学基本概念及术语
4.2.1 系统与环境 定义:
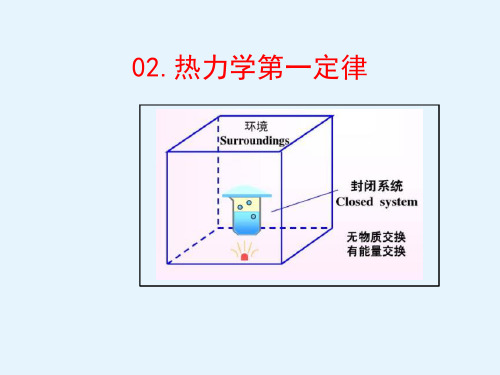
——系统(体系,物系,system,sys.):研究的对象; ——环境(surroundings,surr.) 系统之外,与系统密切相关(即
2. 封闭系统(closed system):与环境之间只可能有能量交换而
无物质交换。(物化多用)
3. 敞开(开放)系统(open system):与环境之间既有能量
交换,又有物质交换。
能量交换 隔离系统 封闭系统 敞开系统
2019/1/6
物质交换
11
2019/1/6
12
2019/1/6
但变化过程中,系统与环境交换的功与热却往往不为零。
2019/1/6
24
例 1:等 T 过程:理气的等温膨胀过程
(298K, 5P , 1dm )
θ 3
(298K, Pθ , 5dm3 )
298 K
例 2:等 P 过程:理气的等压膨胀过程 (298K, P , V1 ) (373K, P , V 2) 3)按不同变化分类
状态函数的特点:
——定态有定值(与其历史和达到该状态的历程无关); ——其微分是全微分;如dp、dV、dT等; ——系统由始态1变化到末态2所引起状态函数的变化值
2019/1/6 17 仅与系统的始态、末态有关,与变化的具体历程无
状态函数的特征
状态一定,其值一定; 殊途同归,变化为等; 周而复始,变化为零; 相互联系,相互制约 单值函数,连续可微分 具有全微分性 。
基本数据计算包括相变和化学变化在内的各种过程的 rHm。
2019/1/6 2
§4.1 序言
物理化学(理论化学)的研究内容:
——结构化学(量子化学); ——化学热力学; ——化学动力学。 热力学(thermodynamics):研究能量相互转换过程中应遵循规律 的科学;应用于化学即为化学热力学。 ——特点: (1)研究对象的宏观性质,只适用于有极大量粒子的系统,不适 用于个别或少数粒子。 (2)没有时间概念,不考虑发生的原因以及所经过的历程。这些 都是热力学的优点,但同时也带来了它的局限性(不能解决速度 和机理问题)。 ——基础理论:第一、二、(三)定律。 ——应用:化学平衡、相平衡、电化学(大部分)、表面与胶体 2019/1/6 3 化学。
2019/1/6
23
3.恒容过程 :系统状态发生变化时,系统的体积始终不变。
4.绝热过程(adiabatic process,adia.):系统状态变化时与环境无热
交换。
5.循环过程(cyclic process):当系统由始态经历一系列具体途径
后又回到原来状态的过程。 循环过程的特点:
系统所有状态函数变化量均为零
达平衡后,系统的组成不随时间而改变,即处于化学平衡。
2019/1/6
21
4.2.5 过程与途径
定义 :系统状态发生的任何变化皆称为过程(process)。实
现这一变化的具体步骤称为途径(path)。
常见的特定过程: 1.恒温过程:系统状态变化时,温度始终不变,且等于环境
温度的过程,T(系)= T (环)=常数。 (如仅是系统的始态温度等于终态温度且等于环境温度,但具 体变化过程中并非为常数,则此过程称等温过程。
2019/1/6 28
pi = y i p思考题1.“根源自分压定律: p pB
B
,压力具有加和性,因此压力
是广度性质”。这一结论正确否,为什么?
2019/1/6
29
4.2.6 热与功
1、热(heat) 定义
系统与环境之间存在温度差而引起的能量交换,以Q表示。
单位:J; or kJ 说明:
定义:描述(决定)系统状态的物理量。 分类: ——微观性质:分子的极性、偶极矩等(热力学不考虑)。 ——宏观性质:温度T、压力p、体积V、密度、粘度 、表面
2019/1/6
16
4.2.3
定义:
状态与状态函数
——状态:系统所有宏观性质的综和体现。
——状态函数:系统所有宏观性质皆为状态函数。
2019/1/6 30
2. 功(work) 定义 : 除热之外,系统与与环境间以其它形式交换的能量均
称为功,以符号W表示。
单位: J; or kJ 说明:
W
——规定:系统得功,W为正;对环境作功,W为负。 ——功的本质:功是系统与环境间因粒子的有序运动而交换 的能量。 ——注意:功是途径函数,不是状态函数的变化量(增量) ,微 小过程的功用符号W表示。 ——功的类型:W=W(体)+W’ 体积功W(体):由于系统体积变化而与环境交换的功; 非体积功W’:除体积功之外的功。例:电功、表面功。
2019/1/6 6
热力学研究方法的特点和局限性
1. 热力学方法的特点 研究大量粒子的宏观体系的宏观性质 之 间 的关系及变化规律, 不考虑微观粒子的微观结构 不涉及反应的速度和机理
2019/1/6
7
2. 优点和局限性
1)热力学只研究体系的始终态 根据始终态的性质而得到可靠的 结果;不考虑变化中的细节;不考虑 物质内部的结构因素 2) 不考虑时间因素 3)不考虑粒子的个别行为
§4-1 热力学概论 一. 概论 1. 热力学是物理学的一个分支
共有三条基本定律。第一定律能量转化过程 中的数量守恒;第二定律能量转化过程中进 行的方向和限度;第三定律低温下物质运动 状态,并为各种物质的热力学函数的计算提 供科学方法。
4
2. 热力学应用于研究化学——化学热力学
把热力学中的基本原理用来研究化学现象 及与化学有关的物理现象——化学热力学。 化学变化中的能量的转变,反应的热效应 ——热力学第一定律的应用。 化学变化的方向和限度——热力学第二定 律的应用。
θ θ
P
a)状态变化:组成,聚集态不变 b)相变化:组成不变,聚集态发生变化 c)化学变化:组成变,发生化学反应
2019/1/6 25
理想气体状态方程
在压力不太高和温度不太低时研究气体(gas)的体积、压力和温 度之间的关系,可以得到理想气体状态方程式:
(4.1) 式中p—压力(Pa),V—体积(m3),n—物质的量(mol),T—热 力学温度(K,T/K = 273.15+t / C ), R—摩尔气体常数(8.314J· mol -1· K-1)。 推论:物质的量n与质量m、摩尔质量M的关系为: n =m/M 故 结合密度的定义 = m/V 可得 =nM/V=pM/RT (4.2) 它反映了理想气体密度 随p、T变化的规律
第4章 热力学第一定律
本章要求
本章以能量守衡为基础,介绍热力学的基本概念。 本章学习的主要要求为: 1.初步了解热力学的研究方法及其特点,明确热力学第一定 律的实质并能应用于处理各种物理、化学过程。
2. 掌握 热力学基本概念:系统与环境,过程与途径,状态与 状态函数,可逆过程,功与热,热力学能,焓,平衡态,标准态, 反应进度等。
13
体系 环境 界面 a CH3OH CH3OH(g) g-l 界面 (l) +空气+冰浴 (真实) 空气+甲醇气 b CH3OH
(g + l)
空气+冰浴
界面(虚构)
2019/1/6
14
2.在一个绝热容器中盛有水,水中浸有电热丝,通电加热,如将 下列不同对象看作是系统,则分别为何种系统: (1)以液态水为系统; (2)绝热箱中的所有水为系统; (3)以绝热箱中的所有水和电热丝为系统; (4)以绝热箱中的水、电热丝及外接电源为系统。
的各部分温度相等,即处于热平衡。
2. 力平衡(mechanical equilibrium):(无刚性壁时)系
统内各部分的压力相等,即处于力平衡。
