材料结构基础
材料科学基础_第2章_固体材料的结构

4
共价键
原子间不产生电子的转移,借共用电子对产生的力结合, 如金刚石,单质硅,SiC 特点: 1.饱和性:电子必须由(8-N)个邻近原子共有;
2.具有方向性:氧化硅四面体中硅氧键为109°
3. 脆性:外力作用,原子间发生相对位移,键将被 破坏
配位数与致密度 配位数 CN=12 致密度 k=0.74
25
体心立方结构(特征)
体心立方晶格密排面
26
ቤተ መጻሕፍቲ ባይዱ
体心立方晶格(间隙及堆垛方式)
间隙: 也是两种,为八面体和四面体间隙, 八面体间隙位于晶胞六面体每个面的中心和每个棱的 中心由一个面上四个角和相邻两个晶胞体心共6个原围成, 即数量为6。大小为rB=0.154R(在<100>) 或rB=0.633R (在<110>) 。
配位数: CN=8 致密度: k=0.68
31
密排六方晶格原子位置
32
密排六方晶格晶胞原子数
33
密排六方晶格密排面
34
密排六方晶格原子配位数
35
密排六方晶格(间隙及堆垛方式)
• 间隙: 较为复杂,如图2.34 八面体间隙rB=0.414R 有 6 个 四面体间隙rB=0.225R 有 12 个
图1 Cl和Na离子保持r0的距离
图2 NaCl 晶体
9
•
分子键(范德华力)
以若静电吸引的方式使分子或原子团连接在一起的。
特点:除高分子外,键的结合不如化学键牢固,无饱和性, 无方向性。
氢键: 分子间特殊作用力
表达为:X—H—Y 特点:具有饱和性和方 向性,可存在于分子内 或分子间。氢键主要存 在于高分子材料内。
材料科学基础第二章+材料的结构

a
b
(200)、(333)等是否存在? 具有公因子的晶面不存在
过坐标原点O
c
a
O
b
O’
截距 -1 1/4 (01-4)
c
a (100)
b
c
a
(200) b
(3)晶面族和晶向族
(hkl)与[uvw]分别表示的是一组平行的晶向和晶面。
[110]
(100)
简单立方(12) 体心立方(13) 面心立方(14)
Fe, Cr, Cu, Ag, V
14种Bravais点阵
1. 三斜Triclinic :简单三斜(1)
a b c, 90o
2. 单斜Monoclinic : 简单单斜(2) 底心单斜(3)
a b c, 90o
dhkl2[(h/a)2+(k/b)2+(l/c)2] =cos2+cos2+cos2 直角坐标系
cos2+cos2+cos2 =1
对于常见晶系,晶面间距dhkl为:
dhkl dhkl dhkl
1 (h)2 (k )2 ( l )2 abc
abc 90
abc 90
简单六方(8)
简单菱方(9) 简单四方(10) 体心四方(11)
Mg, Zn
Cd, Ni, As 90%以上的 金属具有立
As, Sb, Bi 方晶系和六 方晶系
-Sn, TiO2
abc 90
Draw the plane (100)
c
a (100)
b
材料科学基础-固体的结构
hu+kv+lw=0
此关系称为晶带定理。满足该关系的(hkl)晶面都属于以
[uvw]为晶带轴的晶带。
[uvw]
整理课件
32
第二章 固体结构
利用晶带定理:
①已知两个不平行的晶面(h1k1l1)和(h2k2l2),求出其晶带 轴[uvw]。
u : v : w ( k 1 l 2 k 2 l 1 ) : ( l 1 h 2 l 2 h 1 ) : ( h 1 k 2 h 2 k 1 )
整理课件
16
第二章 固体结构
整理课件
17
第二章 固体结构
整理课件
18
第二章 固体结构
整理课件
19
第二章 固体结构
整理课件
20
第二章 固体结构
整理课件
21
第二章 固体结构
整理课件
22
第二章 固体结构
晶面族:原子排列规律、面间距完全相同,仅空间位向 关系不同的一组晶面(等价晶面),以{h k l}表示。
如六个柱面分别为: ( 1 0 0 ),(0 1 0 ),(1 1 0 ),(1 0 0 ),(0 1 0 ),( 1 1 0 ) c
(1 1 0)
(100)
a2
a1 [100 ]
[110 ]
整理课件
25
第二章 固体结构
根据六方晶系的对称特点,通常采用a1, a2, a3和c四个晶轴确
定六方晶系的晶面指数和晶向指数。
具有相同空间点阵的不同晶体结构
晶体结构相似而具有空间点阵不同
整理课件
13
第二章 固体结构
二、晶向指数和晶面指数
(Miller Indices of Crystallographic Direction and Planes) 1、晶向与晶向指数
固体材料的结构基础知识

〔3〕金属键
14
金属键的意义及其特点: 〔1〕由金属正离子和自由电子之间相互作用而形成
的结合称为金属键 〔2〕金属键中的电子处于共用化状态,将原子维持
在一起的电子并不固定在一定的位置上,所以,没有 饱和性和明显的方向性. 〔3〕金属键结合的金属材料具有良好的导电性能、 导热性能.此外,金属键的结合能比离子晶体和共价 晶体低一些,但是过渡族金属的结合能则要大些.各 种金属键的结合能存在着较大的差异,因此各种金 属的强度、熔点等相差较大.
则为范德华键或氢键.
18
1.2.2 键合的本质及其性能 (1) 原子间斥力和引力
19
原子间距<r0> : 两原子在某距离下吸引力和排斥力相等,此时,该
两原子便被稳定在此相对位置上,这一距离r0称为 原子的平衡距离,简称原子间距. 结合能〔E〕:
原子在平衡距离下的作用能称为原子的结合能. 结合能的大小相当于把两原子分开所需要作的 功,E越大,原子的结合也就越稳定. 一般而言: 离子键、共价健的E值最大;金属键的次之;而 范德华的E最小.
6
1.1.2 元素周期表及其性能的周期变化
7
几个概念: 〔1〕原子的电离能 指气态原子在最低能态失去电子时所需要的能量. 元素的电离能越小,则越容易失去电子而成为正离 子. 〔2〕电子的亲和能 指气态原子获得一个电子时所放出的能量.元素的 电子亲和能越大,则越容易获得电子形成负离子. 〔3〕原子的电负性 原子在形成价键时吸引电子的能力,用以比较各种 原子形成负离子或正离子的倾向.两元素的电负性 差越大,所形成的键的极性就越强.
增大而增高.
主要参数 ,电子的能量随n的
〔2〕 L〔次量子数〕:反映轨道的形状,由s、 p、d、f四个量
1-2材料的微观结构基础

a)模型
b)晶胞
2.2 典型金属的晶体结构
2)面心立方晶格(FCC或fcc) eg: Cu、Al、Ni、Au、Ag、γ-Fe…… 晶格常数:a=b=c,α=β=γ=90°
a)模型
b)晶胞
2.2 典型金属的晶体结构
3)密排六方晶格(HCP或hcp) eg: Mg、 Zn、Be、石墨、α-Ti…… 晶格常数:a≠c,c/a≈1.633。
2)金属化合物
定义:组成合金的组元由相当程度的金 属键结合并具有金属特性的化合物。 如碳钢中的渗碳体(Fe3C)。
金属化合物
金属化合物的特性: 高熔点、高硬度、高脆性、塑性很差。 弥散强化:若使金属化合物呈细小颗粒 状以 弥散形式均匀分布于固溶体的基 体上,使合金的强度、硬度、耐磨性明 显提高。
图2-3 ΔT对N和G的影响
2.晶体中的原子排列
2.1 有关晶体结构的基本概念
晶格:描述原子在晶体中规 则排列方式的空间几何图形。 原子→几何点,用线连起来 形成的空间几何框架。
原 子 模 型
晶 格
基本概念
晶胞:晶格中反映晶体特征 的最基本的几何单元。
晶 胞
2.2 典型金属的晶体结构
1)体心立方晶格(BCC或bcc) Cr、W、Mo、V、α-Fe…… 晶格常数:a=b=c,α=β=γ=90°
a)模型
b)晶胞
2.3 同素异晶转变
定义:Fe、Co、Ti等伴随着外界条件(温度 和压力)的变化,物质在固态时所发生的晶体 结构的转变。 1、纯铁的同素异晶转变 纯铁在1538℃结晶为δ-Fe,具有BCC晶格结 构,随温度降低,发生如下变化: δ-Fe
体心 1394℃
γ-Fe
面心
912℃
3 复合材料结构设计基础

J 0 i Fi Z
' 2 i
2
组合梁各层正应力为
Wi J 0 / Z i'
M M
i Z i' Ei i E J Wi 式中 M---该截面处的弯矩。 0 0 梁内剪应力可采用同样的方法处理。在 R 处的剪应力 r
Pcr 2 EJ F l 2 F
若 J i 2 F 其中 i ----压杆截面的最小惯性半径。则: 2E 2E cr 2 2 l i 式中 ----柔度或长细比
cr 将大于 B 当 小到一定值时, ( B 为材料的强度极限),这时 2 杆件的计算就应由材料的强度控制。即 cr ≤ B 故 E
* K1 N * / N y1 x1
K1
(5) 确定各定向层层数 各层的总厚度:
100% 10%,
* * K 2 N xy / N 1 x1
K2
100% 10%
hx : hy : hxy 1 : K1 : 2K 2 h hx hy hxy n nx n y nxy
(2)细长承压杆件 按稳定性条件设计,其稳定性条件为 P P 式中 P ---使用载荷 P ----许用载荷
2 EJ Pcr l 2
式中
E ----杆轴方向的弹性模量;
若引入临界应力 cr 的概念,则 cr
----长度系数;
J ----横截面的最小惯性矩; l ----压杆长度;
N x : N y : N xy 1 : K1 : K 2
* * * K1 N * y / N x , K 2 N xy / N x
无机材料结构基础复习题

一、晶体外形中可能出现的独立宏观对称要素有几个?分别是哪几个?八个。
1. 对称中心( C )2.对称面( P )3.对称轴(L1L2L3L4L6 )4.倒转轴( Li4 ) 5映转轴( Ls4= Li4 )二、 晶族、晶系、对称型的数目分别是 _3_、__7 、_32_ 。
三、1.一个立方晶系晶胞中,一晶面在晶轴X 、Y 、Z 上的截距分别为2a 、1/2a 、2/3a ,求此晶面的晶面指数。
(143)2、一个四方晶系晶体的晶面,在X 、Y 、Z 轴上的截距分别为3a 、4a 、6c ,求该晶面的晶面指数。
(432)3、六方柱某晶面与X 、Y 轴正端等长相截,与Z 轴平行,采用四轴定向,写出晶面符号。
(11*0)4、可能表示与a 轴垂直的晶面符号有( B )A 、(112)B 、(100)C 、(010)D 、(001)E 、(111)5、下面表示与a 轴平行的晶面符号有( C )A 、(111)B 、(110)C 、(011)D 、(110)E 、(100)6、(211)晶面表示了晶面在晶轴上的截距为( B )A 、2a, b, cB 、a,2b ,2cC 、a,b,cD 、2a,b,2cE 、2a,2b,c7、(312)晶面表示了晶面在晶轴上的截距分别为— — —。
2a,6b,3c8、请写出单斜、六方、四方和等轴四个晶系的对称特点和晶体常数。
四、求位于晶带[rst]和晶带[uvw]相交处的晶面(hkl )因为 hr+ks+lt=0,hu+kv+lw=0可用行列式表示例:求位于[010]和[001]两晶带相交处的晶面 (hkl) (100) h=l ×l-0×0=1,k =0×0-1×0=0,l =0×0-0×0=03、已知晶面(hkl)和(mnp)在同一晶带上,求位于此晶带上介于此两晶面之间的另一晶面的符号。
[rst] 1010*******⨯⨯⨯解:hr+ks+lt=0 mr+ns+pt=0则(h+m)r+(k+n)s+(l+p)t=0即此晶带上介于(hkl)和(mnp)晶面间的另一晶面的指数为(h+m)、(k+n)和(1+p)1、晶体中对称轴的轴次n受晶体点阵结构的制约,仅限于n=_1,2,3,4,6___;晶体宏观外形中的对称元素进行一切可能的组合,可得到—32—个晶体学点群;分属于( 7 )个晶系,这些晶系共有( 14 )种空间点阵形式;晶体微观结构中对称要素组合可得到( 230 )个空间群。
第1章 材料结构的基本知识

一、离子键
1、定义
由于正、负离子间的库仑引力而形成。
氯化钠是典型的离子键 结合,钠原子将其3s态电 子转移至氯原子的3d态上, 这样两者都达到稳定的电 子结构,正的钠离子与负 的氯离子相互吸引,稳定 地结合在一起(图1-4)
当IA、IIA族金属和ⅦA、ⅥA族的非金 属原子结合时,金属原子的外层电子很可 能转移至非金属原子外壳层上、使两者都 得到稳定的电子结构,从而降低了体系的 能量; 此时金属原子和非金属原子分别形成正 离子与负离子,正、负离子间相互吸引, 使原子结合在一起,这就是离子键。
© 2003 Brooks/Cole Publishing / Thomson Learning™
2、特点
1)正负离子相间排列,正负电 荷数相等;
2)键能最高,结合力很大; 3)性能: 硬度高、强度大; 热膨胀系数小,在常温下的 导电性很差;
脆性较大。
3、典型材料:陶瓷材料。
二、共价键
图1-3 原子间结合力
根据物理学,力(F)和能量(E)之间的转 换关系:
dE F dx
E Fdx
0
x
在作用力等于零的平衡距离下能量应该
达到最低值,表明在该距离下体系处于稳
定状态。
当两个原子无限远时, 原子间不发生作用,作用 能可视为零。 当距离在吸引力作用下 靠近时,体系的位能逐渐 下降,到达平衡距离时, 位能最低; 当原子距离进一步接近, 就必须克服反向排斥力, 使作用能重新升高。 平衡距离下的作用能定 义为原子的结合能E0。
2、性能
它没有饱和性和方向性;
良好的导电性、导热性、正的
电阻温度系数;
具有良好的塑性。
3、典型材料:各种金属。
四、范德瓦尔键
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
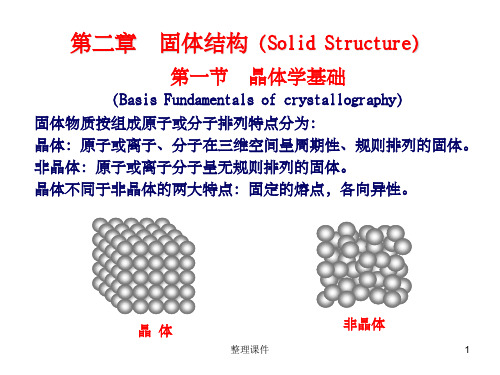
第一节 固体结构
三种结构: 1 晶体结构 2 无定形结构 3 液晶结构
一 晶体结构
1 什么是晶体? 晶体是在三维空间上由原子按一定排列的 空间结构重复单元组成的。 2 什么是空间点阵? 把原子作为一个点,把这些点在空间的 排列用线连接起来, 所形成的网络。在空间 点阵中的每个点周围的原子都是相同的原 子。
2 高分子的远程结构 指高分子链的尺寸和状态(构象),分子 链中键的旋转和旋转的状态宏观地表现为 高分子链的柔性。
晶态结构 非晶态结构
聚集态结构
取向态结构
多相结构
液晶结构 聚集态结构指高分子材料整体的内部结构
3 聚集态结构 凝聚态 (1)分子间的作用力(内聚能密度) (2)结晶结构(结晶度很难达到100%) 四种模型 (3)非晶结构(高分子链全部处于无规 无序状态)四种模型 (4)取向结构 (5)液晶结构 (6)多相结构
3 什么是晶胞? 在空间点阵中选取一个能够代表整体 的简单单元,这个单元叫晶胞。晶胞的形 状和大小用三个矢量a﹑b﹑c 表示,以一 个晶胞的角为原点,则a﹑b﹑c与坐标的 夹角为α﹑β﹑γ (晶格常数)
4 什么是晶面指数? 晶面指数即晶胞某一个晶面在三维坐标 轴上的坐标。由于晶体在不同方向上有不 同的物理化学性质,因此采用晶面指数表 示晶面。
二 高分子的链结构和聚集态结构
一级结构(近程结构)
链结构
二级结构(远程结构) 链结构指单个高分子的结构和形态,包括高分 子的化学组成,链的形状(构象)
1 高分子的近程结构包括: (1)结构单元的化学组成
(2)结构单元键接方式 (3)结构单元空间构型
(4)支化(接枝)与交联
(5)结构单元空间排序
(a)
•
[体心立方晶格]:体心立方晶格的晶胞是一个立方体, 立方体的八个顶角和立方体的中心各有一个原子。具有体 心立方晶格的金属有:α-Fe(温度低于912℃的铁)、铬 (Cr)、钨(W)、钼(Mo)、钒(V)、β-Ti(温度在 883~1668℃的钛)等。
• [面心立方晶格]:面心立方晶子在三维空间上排
列没有规律性和周期性,呈杂乱堆积的状 态,包括:无机玻璃﹑凝胶﹑非晶态半导 体﹑无定形碳﹑合金玻璃等。
• 玻璃的特殊性:
玻璃有玻璃态转化温度Tg, 而其它非晶态 固体没有。在温度低于Tg之前,玻璃是固 态的,在Tg之后,玻璃从固态变为过冷液 态然后变为液态。因此,无定型结构也叫 非晶态,分为玻璃态和非玻璃态两种。
方体的八个顶角和六个面的中心各有一个原子。属于面心 立方的金属有:γ-Fe(温度在912~1394℃的铁)、铝 (Al)、铜(Cu)、银(Ag)、金(Au)、镍(Ni) 等。
• [密排六方晶格]: 密排六方晶格的晶胞是一个上下底面为
正六边形的六柱体,在六柱体的十二个顶角和上、下底面 的中心各有一个原子,六柱体的中间还有三个原子。具有 密排六方晶格的金属有:镁(Mg)、锌(Zn)、α-Ti(温 度低于883℃的钛)、镉(Cd)、铍(Be)等。
三 液晶结构
• 一些物质的结晶结构受热熔融或被溶剂溶
解之后,表现上虽然失去了固态物质的刚 性,变成了具有流动性的液态物质,但结 构上依然保存着一维或二维有序排列,从 而在物理性质上呈现各向异性,形成一种 兼有部分晶体和液体的性质的过渡状态, 这种中介态为液晶态。
第二节 高分子材料结构
一 高分子结构特点 1 高分子的链式结构(均聚物﹑共聚物) 2 高分子链的柔性(内旋转自由度﹑构象) 3 高分子的多分散性(分子量与分子链长不 是单一的) 4 高分子凝聚态结构的复杂性 5 高分子的交联网状结构(交联点)
