粘液表皮癌
黏液表皮样癌(mucoepidermoid carcinoma,MEC)

黏液表皮样癌(mucoepidermoid carcinoma,MEC)黏液表皮样癌是最常见的涎腺肿瘤,在大、小涎腺发生率相似。
MEC 有3种类型细胞组成:黏液细胞通常较大和类似杯状,经常衬覆于囊壁;非角化表皮样细胞,甚至可能看起来是鳞状上皮;中间细胞则更像基底样或立方细胞。
非典型性少见,表皮样/鳞状细胞倾向类似于正常黏膜上皮。
临床上,使用FISH检测MAML2重排对几种情况有帮助。
在低级别MEC病例中,鉴别诊断需考虑良性肿瘤如Wathin瘤的化生性变型,或更罕见的疾病,如淋巴腺瘤。
在这种情况下,对MAML2重排的检测可以确认MEC的诊断。
在MEC 嗜酸细胞亚型的这种特殊情形中,MAML2 的FISH检测非常有用,因为其中突出的嗜酸细胞形态学可以掩盖表皮样表型,并类似WT、嗜酸细胞囊腺瘤或AciCC。
虽然在许多情况下出现p63阳性反应提示MEC,但对MAML2重排的检测可确认MEC。
尽管许多需与良性肿瘤(WT或嗜酸细胞囊腺瘤)鉴别的嗜酸细胞MEC 是低级别和转移风险较低,但恶性嗜酸细胞MEC由于复发风险较高,对其的诊断诊断仍很重要。
在瘤谱的另一端,高级别MEC可以类似各种其他高级别癌。
在这种情况下MAML2重排的确定对MEC具有诊断性,而且可能很重要,因为在腮腺部位能排除转移的可能性。
高级别MEC中的MAML2重排少见,因此没有重排也不能排除MEC的诊断。
鉴别诊断需要考虑下列肿瘤,包括SDC、腺鳞癌、甚至鳞状细胞癌;一般而言,所有这些肿瘤都比高级别MEC预后更差。
SDC通常由雄激素受体(AR)阳性而p63阴性,与MEC形成对照,后者通常为AR阴性,并至少具有p63的局灶阳性。
腺鳞癌和鳞状细胞癌一般认为源自表面上皮,与MEC对比,后者没有表面原位癌成分。
多灶角化的存在有利于鳞状细胞癌的诊断而非MEC。
MAML2基因断裂探针黏液表皮样癌有特征性的 t(11;19)易位,导致形成 MAML2-CRTC1 融合蛋白。
粘液表皮样癌是最常见的唾液腺恶性肿瘤

粘液表皮样癌是最常见的唾液腺恶性肿瘤。
我们和其他人的研究共同表明,CRTC1-MAML2基因融合是临床病理学中常见的肿瘤特征之一。
最近,在对粘液表皮样癌的研究中,科学家们报道了一种罕见的新型CRTC3-MAML2基因融合。
这种新型的基因融合的发生频率和临床病理学意义尚不明朗。
科学家们对101例粘液表皮样癌和89例非粘液表皮样癌的唾液标本进行了分析,并对被福尔马林固定和石蜡镶嵌过的标本进行了RNA提取。
CRTC又分为分为CRTC1、CRTC2和CRTC3三种,我们对CRTC1-NAML2、CRTC2-NAML2和CRTC3-NAML2分别进行了RT-PCR检测,并从病人的临床记录中获得了其临床病理学数据。
在101例粘液表皮样癌病例中,分别有34例和6例表现出CRTC1-NAML2和CRTC3-NAML2阳性。
而在89例粘液表皮样癌病例中,则没有以上任何一种基因融合显示为阳性。
在以往的病例分析中,我们知道CRTC1-NAML2和CRTC3-NAML2是相互排斥的,而CRTC2-NAML2则尚未被检测到。
我们证实了CRTC1-NAML2阳性的粘液表皮样癌的临场病理学特征表现为惰性过程(indolent course)。
而CRTC3-NAML2阳性的粘液表皮样癌的临场病理学特征则表现为进行肿瘤切除术后所有临场病例表现为低级的临床阶段(less-advanced clinic stage)、负节点新陈代谢过程(negative nodal metastasis)、无高阶肿瘤组织学(high-grade tumor histology)、无肿瘤再生或肿瘤相关死亡。
值得注意的是,CRTC3-NAML2患者的平均年龄(36岁)要远低于CRTC1-NAML2患者(55岁)和阴性患者(58岁)。
综上所述,CRTC3-NAML2融合的发生概率被发现要高于较早研究的结果,对于存在CRTC3-NAML2融合的粘液表皮样癌常会伴随某些特定的临床病理学特征,且发病人群的平均年龄要远低于CRTC1-NAML2型或阴性粘液表皮样癌。
黏液表皮样癌分级标准

黏液表皮样癌的分级标准主要基于细胞的分化程度,可以将其分为三个级别:
1.一级(高分化型):当黏液细胞分化占50%以上时,被划分为一级黏液表皮样癌,此时表皮样癌细胞分化良好,中间细胞较少,无核异形,有丝分裂极少或没有。
2.二级(中分化型):如果黏液细胞分化在10%以下,且在50%以上,被划分为二级黏液表皮样癌,此时常较多实性和细胞间变,偶有神经侵犯。
3.三级(低分化型):当黏液细胞分化低于10%时,被划分为三级黏液表皮样癌,此时肿瘤系中间细胞或表皮样细胞形成的实性团块,瘤细胞间变明显,可见核异形及较多的有丝分裂像,肿瘤呈浸润性生长,质地均匀,完全无包膜,切面呈灰白色,或形成大小不等囊腔,内含拉丝状黏稠液体或血液,淋巴结转移率较高,且可出现血行性转移。
此外,另一种黏液表皮样癌分级方法是通过特定的组织学特征进行评分,如囊腔比例、神经侵犯、坏死、核分裂等,然后根据总分进行分级,低级别为0-4分,中级别为5-6分,高级别为7分以上。
这些分级标准有助于医生评估疾病的严重程度,制定合适的治疗方案,并预测患者的预后。
但请注意,具体的分级标准可能会因不同的医疗机构或专家建议而略有差异。
因此,
在制定具体的治疗方案时,应根据患者的具体情况和医生的建议来确定。
粘液表皮样癌的诊断与鉴别诊断

粘液表皮样癌的诊断与鉴别诊断
*导读:粘液表皮样癌以高分化型居多,一般生长缓慢,有时在临床上不易与多形性腺瘤相鉴别,但不同的是发生于腮腺的粘液表皮样癌形态不规则或呈扁平状,质地较硬,活动度较差。
……
粘液表皮样癌以高分化型居多,一般生长缓慢,有时在临床上不易与多形性腺瘤相鉴别,但不同的是发生于腮腺的粘液表皮样癌形态不规则或呈扁平状,质地较硬,活动度较差。
发生于口腔小涎腺者,肿瘤所在区域粘膜下成淡蓝色是粘液表皮样癌的临床特点之一;穿刺有血性分泌物或粘液分泌的新生物,应高度警惕粘液表皮样癌的可能。
磨牙后区粘液表皮样癌需与冠周炎鉴别。
组织病理学诊断时,如果存在表皮样细胞及粘液细胞,诊断多无困难。
然而,并非所有的粘
液表皮样癌都具有这一典型特点,需与其鉴别的常见肿瘤有:(1)鳞状细胞癌粘液细胞很少的粘液表皮样癌需与分化较低的
鳞状细胞癌鉴别,此时常需作阿辛蓝或PAS粘液染色,如为阳性,常可诊断为粘液表皮样癌。
(2)多形性腺瘤许多多形性腺瘤含表皮样细胞,也可产生上皮性粘液。
但这种粘液一般位于导管腔内偶尔也可见细胞内粘液。
最重要的鉴别在于粘液表皮样癌中无粘液软骨样基质,其间质多为纤维结缔组织。
(3)含透明细胞的肿瘤如果在成片的表皮样细胞中出现局灶性透明细胞,则这些细胞常系中间细胞转变而来,可诊断为粘液表皮样癌。
几乎整个肿瘤出现透明细胞时,则需与腺泡细胞癌、肌上皮癌及转移性肾透明细胞癌区别。
抗淀粉酶、S-100蛋白、肌动蛋白抗体免疫组化染色、脂肪染色等方法有助于鉴别。
肺原发性黏液表皮样癌(pulmo...

肺原发性黏液表皮样癌(pulmo...粘液表皮样癌(mucoepidermoid carcinoma, MEC)是由不同比例的表皮样细胞、粘液细胞和中间细胞组成的恶性肿瘤,黏液表皮样癌主要发生在涎腺,其中约一半(53%)发生在大涎腺,其中腮腺占45%,颌下腺为7%,舌下腺为1%。
口腔内最常见的发生部位是腭和颊黏膜。
在肺内也可以发生与涎腺肿瘤相似的上皮性肿瘤,原发于肺部的较为少见,肺原发性黏液表皮样癌(pulmonary mucoepidermoid carcinoma,PMEC)是一种罕见的肿瘤(如图1)。
由smetana等人1952年首次报道,一般认为起源于气管及支气管浆液腺和黏液腺的Kulchitsky细胞。
PMEC占支气管肿瘤的1%-5%,全部肺肿瘤0.1%-0.2%。
融合蛋白MECT1-MAML2被认为是唾液腺和 PMEC中的致病性遗传事件。
有研究发现88%的PMEC与MECT1-MAML2融合转录相关,并且MAML2基因重排的存在可以支持PMEC的诊断。
t(11;19) (12;P13)融合蛋白MECT1-MAML2被认为是涎腺和支气管肺黏液表皮样癌的驱动基因事件。
也可发生在皮肤、乳腺和宫颈等部位。
大约6%的病例存在CRTC3-MAML2基因融合,而非MECT1-MAML2基因融合。
有研究表明,存在基因融合的黏液表皮样癌预后更好。
图1:肿瘤位于支气管粘膜下,肿瘤细胞巢状分布,部分细胞内有粘液,可见片状肿瘤性坏死。
临床特征:PMEC可发生于任何年龄段,但患者总体发病年龄较轻,国内文献报道平均年龄在40岁左右,青少年患者也屡见不鲜。
通常认为发病无性别差异,有研究显示大于40岁男性以低级别多见,而高级别多见于年轻女性。
PEMC大体可分为四型: 腔内息肉型、腔内外肿块型、管壁全层浸润型、外周型,而腔内息肉型最多见。
CT检查是一种无创且有效的方法。
Kim等人总结以下征象:①肿瘤长径与所属肺叶或肺段气道平行;②常伴远端肺叶的阻塞性肺炎或肺不张;③“空气新月征”,即病灶部分阻塞气道所形成周围含气的空腔。
肺粘液表皮样癌1例报告
肺粘液表皮样癌1例报告肺粘液表皮样癌(pulmonary mucoepidermoid caicinoma PMEC)是一种起源于气管、支气管粘膜下腺体Kulchitsky细胞的罕见的肺部恶性肿瘤,占所有肺癌的0.1-0.2%[1]。
PMEC的发病率无明显性别差异,发病年龄4-78岁不等, 成年人多见, 平均为28.5岁[2]。
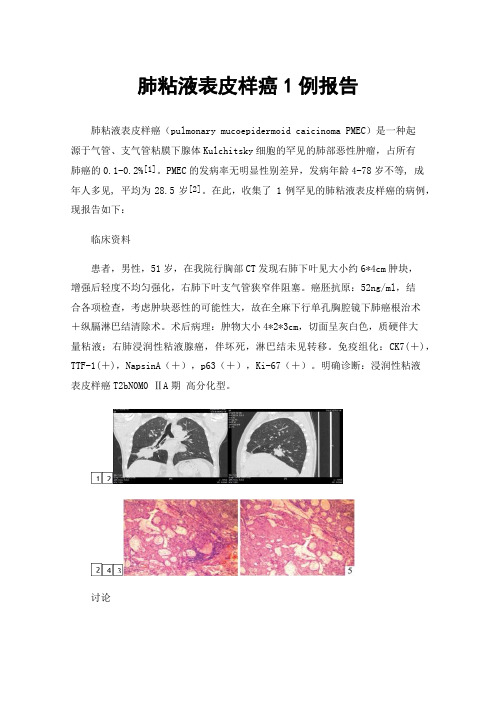
在此,收集了 1例罕见的肺粘液表皮样癌的病例,现报告如下:临床资料患者,男性,51岁,在我院行胸部CT发现右肺下叶见大小约6*4cm肿块,增强后轻度不均匀强化,右肺下叶支气管狭窄伴阻塞。
癌胚抗原:52ng/ml,结合各项检查,考虑肿块恶性的可能性大,故在全麻下行单孔胸腔镜下肺癌根治术+纵膈淋巴结清除术。
术后病理:肿物大小4*2*3cm,切面呈灰白色,质硬伴大量粘液;右肺浸润性粘液腺癌,伴坏死,淋巴结未见转移。
免疫组化:CK7(+),TTF-1(+),NapsinA(+),p63(+),Ki-67(+)。
明确诊断:浸润性粘液表皮样癌T2bN0M0 ⅡA期高分化型。
讨论PMEC是一种源于支气管的恶性肿瘤,主要由分泌黏液细胞,表皮样细胞和未特殊分化中间细胞组成[3],病理上分为高分化黏液样癌和低分化黏液样癌,Ki-67指数可作为高分化和低分化的鉴别指标[4],指数越高,低分化的可能性越大,恶性的可能性越高。
高分化黏液表皮样癌是以黏液细胞为主,细胞异型性不明显,肿瘤多无坏死区域,可见钙化,行手术切除,预后良好;低分化黏液表皮样癌较少见,以中间细胞为主,异型细胞核分裂像和坏死表现及区域淋巴结转移为特征,可远处转移,手术切除,预后不佳。
免疫组化:P63、Ki-67, NapsinA、CK7和TTF-1及FISH检测MAML2可以识别PMEC,其中普遍认为t(11;19)(q21;p13)染色体易位形成的MAML2与粘液表皮样癌的发生相关,且具有高度特异性[10-11],因此成为了PMEC研究方向,并用于MAML2阳性的患者的靶向治疗。
粘液表皮样癌

粘液表皮样癌*导读:粘液表皮样癌(mucoepidermoidcarcinoma)也称粘液表皮样肿瘤(mucoepidermoidtumor),在涎腺肿瘤中占5%~10%。
Stewart等根据其临床特点和组织学特征将其称为粘液表皮样肿瘤,并又分为良性及恶性两类。
……【概述】粘液表皮样癌(mucoepidermoid carcinoma)也称粘液表皮样肿瘤(mucoepidermoid tumor),在涎腺肿瘤中占5%~10%。
Stewart 等根据其临床特点和组织学特征将其称为粘液表皮样肿瘤,并又分为良性及恶性两类。
WHO也曾采用粘液表皮样瘤的名称,但以后许多学者认为这种命名分类并不恰当,认为此肿瘤全部为恶性,应称为粘液表皮样癌,并根据癌细胞分化程度的高低和生物学行为,将其分为低度恶性和高度恶性粘液表皮样癌。
WHO1990年修订的涎腺肿瘤的命名及分类已采用这种分类方法。
虽然“粘液表皮样”一词并不完全合适,但基本上反映了肿瘤的主要成分为粘液样细胞和表皮样细胞。
粘液表皮样癌来源于腺管的上皮细胞。
【诊断】一般需经术冰冻切片检查后方能确诊。
发生在腮腺者,腮腺造影可见侵蚀性破坏,导管缺损或中断,远端导管出现部分或完全不充盈,管壁不光滑,也可能出现分支导管破坏,碘油外漏等恶性肿瘤表现。
CT检查可见边界不清楚的肿块,腮腺腺体破坏或被挤压移位。
【治疗措施】粘液表皮样癌原发灶的处理主要是区域性根治性切除。
为防止复发,手术应在距肿瘤1cm以外的正常组织内进行肿瘤切除。
腮腺高分化粘液表皮样癌首次手术治疗者,不管病期如何,一般采用保留面神经的腮腺全切除术;低分化型浸润面神经的机会较多,如面神经受累,应行牺牲面神经的腮腺全切术,如果及的面神经长度较大,可以在切除一段神经后做神经移植。
发生在颌下腺的粘液表皮样癌,应行颌下三角清扫术。
发生在腭部者,应做部分上颌骨切除术。
如肿瘤已侵犯周围组织,应做扩大切除术。
粘液表皮样癌的区域淋巴结转移率较低,除低分化型可考虑选择性颈淋巴清扫术,高分化者一般不做选择性颈淋巴清扫术。
黏液表皮样癌(mucoepidermoid carcinoma,MEC)

黏液表皮样癌(mucoepidermoid carcinoma,MEC)黏液表皮样癌是最常见的涎腺肿瘤,在大、小涎腺发生率相似。
MEC 有3种类型细胞组成:黏液细胞通常较大和类似杯状,经常衬覆于囊壁;非角化表皮样细胞,甚至可能看起来是鳞状上皮;中间细胞则更像基底样或立方细胞。
非典型性少见,表皮样/鳞状细胞倾向类似于正常黏膜上皮。
临床上,使用FISH检测MAML2重排对几种情况有帮助。
在低级别MEC病例中,鉴别诊断需考虑良性肿瘤如Wathin瘤的化生性变型,或更罕见的疾病,如淋巴腺瘤。
在这种情况下,对MAML2重排的检测可以确认MEC的诊断。
在MEC 嗜酸细胞亚型的这种特殊情形中,MAML2 的FISH检测非常有用,因为其中突出的嗜酸细胞形态学可以掩盖表皮样表型,并类似WT、嗜酸细胞囊腺瘤或AciCC。
虽然在许多情况下出现p63阳性反应提示MEC,但对MAML2重排的检测可确认MEC。
尽管许多需与良性肿瘤(WT或嗜酸细胞囊腺瘤)鉴别的嗜酸细胞MEC 是低级别和转移风险较低,但恶性嗜酸细胞MEC由于复发风险较高,对其的诊断诊断仍很重要。
在瘤谱的另一端,高级别MEC可以类似各种其他高级别癌。
在这种情况下MAML2重排的确定对MEC具有诊断性,而且可能很重要,因为在腮腺部位能排除转移的可能性。
高级别MEC中的MAML2重排少见,因此没有重排也不能排除MEC的诊断。
鉴别诊断需要考虑下列肿瘤,包括SDC、腺鳞癌、甚至鳞状细胞癌;一般而言,所有这些肿瘤都比高级别MEC预后更差。
SDC通常由雄激素受体(AR)阳性而p63阴性,与MEC形成对照,后者通常为AR阴性,并至少具有p63的局灶阳性。
腺鳞癌和鳞状细胞癌一般认为源自表面上皮,与MEC对比,后者没有表面原位癌成分。
多灶角化的存在有利于鳞状细胞癌的诊断而非MEC。
MAML2基因断裂探针黏液表皮样癌有特征性的 t(11;19)易位,导致形成 MAML2-CRTC1 融合蛋白。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
黏液表皮癌
【治疗措施】
粘液表皮样癌原发灶的处理主要是区域性根治性切除。
为防止复发,手术应在距肿瘤
1cm以外的正常组织内进行肿瘤切除。
腮腺高分化粘液表皮样癌首次手术治疗者,不管病期如何,一般采用保留面神经的腮腺全切除术;低分化型浸润面神经的机会较多,如面神经受累,应行牺牲面神经的腮腺全切术,如果及的面神经长度较大,可以在切除一段神经后做神经移植。
发生在颌下腺的粘液表皮样癌,应行颌下三角清扫术。
发生在腭部者,应做部分上颌骨切除术。
如肿瘤已侵犯周围组织,应做扩大切除术。
粘液表皮样癌的区域淋巴结转移率较低,除低分化型可考虑选择性颈淋巴清扫术,高分化者一般不做选择性颈淋巴清扫术。
Perzik等强调,只有在切除原发肿瘤时确定颈淋巴结有转移者,才做颈淋巴结清扫术。
粘液表皮样癌对放射治疗不敏感,但对低分化型术后可配合使用放射治疗,有可能提高疗效或减少复发。
【预后措施】
粘液表皮样癌预后良好。
Bhaskar报告144例,复发者占12.5%,5年生存率为88.5%。
肿瘤细胞的分化程度与预后密切相关。
Kosenfeld报告高分化型的5年、10年生存率均为100%,而低分化型的5年、10年生存率则分别为39%和11%。
Spiro等报告367例,其中高分化型5年、10年及15年生存率分别为92%、90%及82%;低分化型则分别为49%、42%及33%。
原发于腮腺及小涎腺者较发生于颌下腺者为好。
林国础等报告189例,局部复发率为13.57%,5年、10年、15年生存率分别为91.66%、89.87%、66.61%。
