专题6-§3-2化学电源 同步练习-2020-2021学年高一化学苏教版(2019)必修第二册
苏教版高中化学必修2化学电源 同步练习

化学电源同步练习一、单项选择题1. 随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是A.利用电池外壳的金属材料B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染C.不使电池中渗泄的电解液腐蚀其他物品D.回收其中石墨电极2.蓄电池是一种可以反复充电、放电的装置,有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2,其中NiO2充当的是A.电解池阳极B.电解池阴极C.电池正极D.电池负极3. 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行(2001年广东、河南高考题第13题) 充电Cd(OH)2 + 2Ni(OH)2Cd + 2NiO(OH) + 2H2O放电由此可知,该电池放电时的负极材料是A.Cd(OH)2 B. Ni(OH)2 C. Cd D. NiO(OH)4. 电子表和电子计算机的电源通常用微型银一锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液。
电极总反应式为:Ag2O+H2O+Zn=Zn(OH)2+2Ag。
下列叙述正确的是A.Zn是正极,Ag2O是负极B.Zn是负极,Ag2O是正极C.工作时负极区溶液的pH增大D.工作时电子由Ag2O极经外电路流向Zn极5.埋在地下的输油管,在下列各种情况下,被腐蚀速率最慢的是A. 在含元素较多的酸性土壤中B. 在潮湿疏松透气的土壤中C. 在干燥致密不透气的土壤中D. 在含碳粒较多潮湿透气的土壤中6.氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镍电池.氢镍电池的总反应是:1/2H2+NiO(OH)Ni(OH)2。
根据此反应判断,下列说法正确的是A. 电池放电时,电池负极周围溶液的pH不断增大B. 电池放电时,镍元素被氧化C. 电池放电时,氢元素被还原D. 电池放电时,H2是负极二、填充题7.常用干电池是用锌板围成的圆筒作正极,内充糊状的ZnCl2和NH4Cl。
(最新)高中化学苏教版必修2课时作业:3.2化学电源 Word版含答案

最新精品资料·化学第2课时化学电源一、原电池工作原理的应用1.加快氧化还原反应速率如实验室用Zn和稀H2SO4(或稀HCl)反应制H2,常用粗锌,它产生H2的速率快。
原因是粗锌中的杂质和锌、稀H2SO4形成________,加快了反应,使产生H2的速率加快。
2.比较金属的活动性强弱原电池中,一般活动性强的金属为________极,活动性弱的金属为________极。
例如有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活动性________。
3.设计原电池已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般________为负极材料(或在负极上被________),________(电解质溶液中的阳离子)在正极上被还原。
例如,利用Cu+2AgNO3===Cu(NO3)2+2Ag的氧化还原反应可设计成如图所示的原电池,该原电池的电极反应式为:负极(Cu):____________________________(氧化反应)正极(C):________________________(还原反应)4.化学电源人们利用原电池原理,将________能直接转化为________能,制作了多种电池。
如干电池、蓄电池、充电电池、高能燃料电池等,以满足不同的需要。
在现代生活、生产和科学技术的发展中,电池发挥着重要的作用,大至宇宙火箭、人造卫星、飞机、轮船,小至电脑、电话、电子手表、心脏起搏器等,都离不开各种各样的电池。
二、发展中的化学电源1.干电池普通锌锰干电池电池组成:____________作负极;位于中央的顶盖带有______________作正极;电解质是____________糊。
负极反应为____________。
2.充电电池充电电池是一种________。
充电放电可循环进行,至一定周期后终止。
最早也是使用最广泛的是铅蓄电池,________是Pb,________是PbO2,电解质是________。
2020-2021学年度高一化学必修2苏教版专题6化学反应与能量变化检测【有答案】

专题6化学反应与能量变化检测(时间:90分钟满分:100分)一、选择题(本题包括12小题,每小题2分,共24分,每小题只有一个选项符合题意) 1.绿色能源是指使用不会对环境造成污染的能源,下列属于绿色能源的是()①太阳能②风能③潮汐能④煤⑤天然气⑥石油A.①②③B.③④C.④⑥D.①②⑤2.混合动力汽车配有电动、汽油双引擎。
在减速时,自动捕捉减少的动能;在高速行驶时,启用双引擎,动力更强劲。
下列有关混合动力汽车的说法不正确的是()A.减速制动时动能转化为电能储存在电池中B.高速行驶时电池电能转化为汽车部分动力C.通过发电机电动机互变循环减少汽车油耗D.双动力汽车工作时不会产生废气污染环境3.下列有关化学反应速率和限度的说法中不正确的是()A.已知工业合成氨的正反应方向放热,所以升温正反应速率减小,逆反应速率增大B.实验室用H2O2分解制备O2,加入MnO2后,反应速率明显加快C.2SO2+O22SO3反应中,SO2的转化率不能达到100%D.实验室用碳酸钙和盐酸反应制取CO2,相同质量的粉末状碳酸钙比块状反应要快4.把在空气中久置的铝片5.0 g投入盛有50 mL 0.1 mol·L-1盐酸的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系可用如图所示的坐标曲线来表示,下列推论错误的是()A.O→a不产生氢气是因为表面的氧化物隔离了铝和稀盐酸B.b→c段产生氢气的速率增加较快的主要原因之一是温度升高C.t=c时,反应处于平衡状态D.t>c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降5.根据如图所示示意图,下列说法不正确的是()A.反应C(s)+H2O(g)===CO(g)+H2(g),能量增加(b-a) kJ·mol-1B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量C.1 mol C(s)和1 mol H2O(l)反应生成1 mol CO(g)和1 mol H2(g)吸收的热量为131.3 kJ D.1 mol C(s)、2 mol H、1 mol O转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ6.X(g)+3Y(g)2Z(g)ΔH=-92 kJ·mol-1,将1 mol X和3 mol Y通入2 L的恒容密闭容器中进行反应,10 min时测得Y的物质的量为2.4 mol。
苏教版高一化学必修2_《化学能转化为电能、化学电源》同步测试

第三单元化学能与电能的转化第一课时化学能转化为电能化学电源同步检测一、选择题(本题包括5小题,每小题4分,共20分)1.下列有关电池的说法不.正确的是()A.手机上用的锂离子电池属于二次电池B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极C.氢氧燃料电池可把化学能转化为电能D.锌锰干电池中,锌电极是负极2.(2012·新课标全国卷)①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。
①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。
据此判断这四种金属活动性由大到小的顺序是()A.①③②④B.①③④②C.③④②①D.③①②④3.[双选题]Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线连接成原电池,此电池工作时,下列叙述中正确的是()A.Mg比Al活泼,Mg失去电子被氧化成Mg2+B.负极反应式为Al-3e-+4OH-===AlO-2+2H2OC.镁电极发生还原反应D.Al是电池正极,开始工作时溶液中会立即有白色沉淀析出4.汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O,根据此反应判断下列叙述中正确的是() A.PbO2是电池的负极B.负极的电极反应式为:Pb+SO2-4-2e-===PbSO4[:]C.PbO2得电子,被氧化D.电池放电时,溶液酸性增强5.被称之为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,而在其另一边镀二氧化锰)作为传导体。
在纸内的离子“流过”水和氧化锌组成的电解液。
电池总反应为:Zn+2MnO2+H2O===ZnO+2MnO(OH),下列说法正确的是()A.该电池的正极为锌B.该电池反应中二氧化锰起催化剂作用C.当0.1 mol Zn完全溶解时,转移电子个数为1.204×1024D.电池正极反应式为:2MnO2+2e-+2H2O===2MnO(OH)+2OH-二、非选择题(本题包括3小题,共30分)6.(10分)氯铝电池是一种新型的燃料电池,电解质溶液是KOH(aq)。
苏教版高一化学必修第二册(2020版)_《化学电源》课时作业

6.3.2化学电源1.废电池处理不当不仅造成浪费,还会对环境造成严重污染,对人体健康也存在极大的危害。
有同学想将其变废为宝,以下他的想法你认为不正确的是()A.把锌皮取下洗净用于实验室制取氢气B.碳棒取出洗净用作电极C.把铜帽取下洗净回收利用D.电池内部填有NH4Cl等化学物质,将废电池中的黑色糊状物作化肥用2.下列关于化学电源的说法正确的是()A.干电池放电之后还能再充电B.充电电池在放电和充电时都将化学能转化为电能C.充电电池可以无限制地反复放电、充电D.氢氧燃料电池是一种环境友好型电池3.茫茫黑夜中,航标灯为航海员指明了方向。
航标灯的电源必须长效、稳定。
我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。
在这种电池中()①铝合金是负极②海水是电解质溶液③铝合金电极发生还原反应A.①②B.②③C.①③D.①②③4.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4溶液,电池放电时的反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,下列对电池放电时的分析正确的是()A.Pb为正极被氧化B.电子从PbO2流向外电路C.SO2-4向PbO2处移动D.电解质溶液pH不断增大5.LED产品的使用为城市增添色彩。
下图是氢氧燃料电池驱动LED发光的一种装置示意图。
下列有关叙述正确的是()A.a处通入氧气,b处通入氢气B.通入H2的电极发生反应:H2-2e-===2H+C.通入O2的电极为电池的正极D.该装置将化学能最终转化为电能6.镍镉(Ni-Cd)可充电电池可以发生反应:Cd(OH)2+2Ni(OH)2Cd+2NiO(OH)+2H2O,由此可知,该电池的负极材料是()A.Cd B.NiO(OH)C.Cd(OH)2D.Ni(OH)27.(双选)如图是甲醇(CH3OH)燃料电池的化学原理示意图,下列判断不正确的是()A.电极A为电池负极B.电极B表面上发生氧化反应C.工作一段时间溶液pH保持不变D.燃料电池工作时不会出现火焰8.关于电解池的叙述不正确的是()A.与电源正极相连的是电解池的阳极B.电解质溶液中的阳离子向阴极移动C.在电解池的阳极发生氧化反应D.电子从电源的负极沿导线流入电解池的阴极,再经电解质溶液流入电解池的阳极9.如图是电解CuCl2溶液的装置,其中c、d为石墨电极。
6.3.2化学电源学案-2020-2021学年苏教版(2019)高一化学必修二

波峰中学高中化学必修二导学案姓名班级编制时间编号 11 审核课题:化学电源1、下列对化学电源的叙述,正确的是( )A.化学电源比火力发电对化学能的利用率高B.化学电源所提供的电能居于人类社会现阶段总耗电量的首位C.化学电源均是安全、无污染的D.化学电源即为可充电电池2、电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献。
下列有关电池的叙述正确的是( )A.锌锰干电池工作一段时间后碳棒变细B.氢氧燃料电池可将热能直接转变为电能C.氢氧燃料电池工作时氢气在负极被氧化D.太阳能电池的主要材料是高纯度的二氧化硅3、下列说法中正确的是( )①燃料电池的反应物可不储存在电池的内部②锌锰干电池是一次电池,铅蓄电池是二次电池③锂电池是新一代可充电电池④燃料电池作为汽车驱动能源已研发成功A.②③④B.①②③④C.①②③ D.①③④4、我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应:4Al+3O2+6H2O===4Al(OH)3。
下列说法不正确的是( )A.正极反应式:2H2O+O2+4e-===4OH-B.电池工作时,电流由铝电极沿导线流向铂电极C.以网状的铂为正极,可增大与氧气的接触面积D.该电池通常只需要更换铝板就可继续使用5、一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。
该电池负极发生的反应是( )A.CH3OH(g)+O2(g)===H2O(l)+CO2(g)+2H+(aq)+2e-B.O2(g)+4H+(aq)+4e-===2H2O(l)C.CH3OH(g)+H2O(l)===CO2(g)+6H+(aq)+6e-D.O2(g)+2H2O(l)+4e-===4OH-(aq)6、研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。
该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。
2020-2021学年高中苏教版化学必修第二册教师用书:专题6 第3单元 第2课时 化学电源
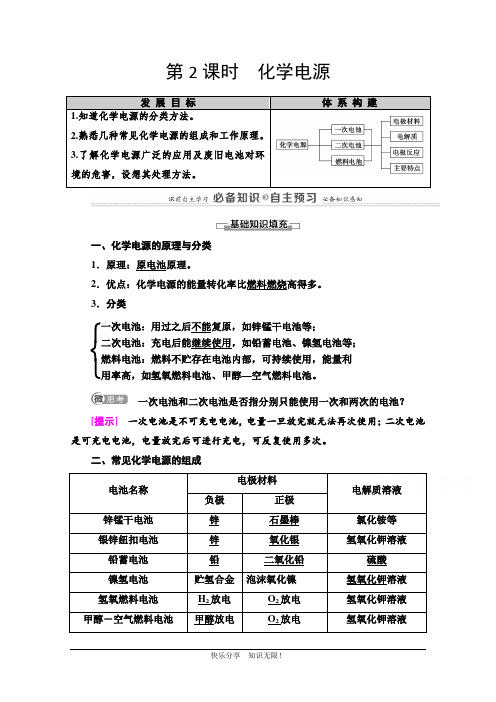
第2课时化学电源发展目标体系构建1.知道化学电源的分类方法。
2.熟悉几种常见化学电源的组成和工作原理。
3.了解化学电源广泛的应用及废旧电池对环境的危害,设想其处理方法。
一、化学电源的原理与分类1.原理:原电池原理。
2.优点:化学电源的能量转化率比燃料燃烧高得多。
3.分类⎩⎨⎧一次电池:用过之后不能复原,如锌锰干电池等;二次电池:充电后能继续使用,如铅蓄电池、镍氢电池等;燃料电池:燃料不贮存在电池内部,可持续使用,能量利用率高,如氢氧燃料电池、甲醇—空气燃料电池。
一次电池和二次电池是否指分别只能使用一次和两次的电池?[提示]一次电池是不可充电电池,电量一旦放完就无法再次使用;二次电池是可充电电池,电量放完后可进行充电,可反复使用多次。
二、常见化学电源的组成电池名称电极材料电解质溶液负极正极锌锰干电池锌石墨棒氯化铵等银锌纽扣电池锌氧化银氢氧化钾溶液铅蓄电池铅二氧化铅硫酸镍氢电池贮氢合金泡沫氧化镍氢氧化钾溶液氢氧燃料电池H2放电O2放电氢氧化钾溶液甲醇-空气燃料电池甲醇放电O2放电氢氧化钾溶液什么是燃料电池?燃料电池中燃料需要燃烧吗?[提示]燃料电池是通过燃料与氧化剂分别在两个电极上发生氧化还原反应,将化学能直接转化为电能的装置,燃料不需要燃烧。
三、电解池1.电解池是将电能转化为化学能的装置。
2.实例:电解水制得氢气和氧气;电解饱和食盐水制备烧碱、氯气和氢气。
1.判断正误(正确的打“√”,错误的打“×”)(1)太阳能电池不属于原电池。
(√)(2)二次电池充电时,充电器的正极接二次电池的正极。
(√)(3)铅蓄电池放电时的负极发生还原反应。
(×)(4)Zn具有还原性和导电性,可用作锌锰干电池的负极材料。
(√)2.下列有关电池的说法中不正确的是()A.手机上用的锂离子电池属于二次电池B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极C.甲醇燃料电池可把化学能转化为电能D.锌锰干电池中,锌电极是负极B[手机上用的锂离子电池是可充电电池,A正确;铜锌原电池中,Cu为正极,Zn为负极,外电路中电子由负极流向正极,B错误;甲醇燃料电池是将甲醇内部的化学能转化为电能的装置,C正确;锌锰干电池中,Zn为负极,D正确。
2020版高考化学苏教版大一轮温习精练专题六第2课时原电池化学电源

课时2原电池化学电源一、选择题1.(2017·洛阳期末)以下有关电池的说法不正确的选项是( )A.太阳能电池的要紧材料是高纯度的二氧化硅B.铜锌原电池工作时,电子沿外电路从锌电极流向铜电极C.氢氧燃料电池工作时,氢气在负极被氧化D.原电池中必然发生了氧化还原反映解析太阳能电池的要紧材料是高纯度的晶体硅,A项错误;铜锌原电池工作时,电子沿外电路由负极(锌)流向正极(铜),B项正确;氢氧燃料电池工作时,氢气在负极失去电子被氧化,C 项正确;由原电池的工作原理可知原电池中必然发生了氧化还原反映,D项正确。
答案A2.以下示用意中能组成原电池的是( )解析Cu、C与稀硫酸不反映,A装置不能组成原电池;Al与氢氧化钠溶液发生氧化还原反映,B装置能组成原电池;C装置中的“导线”不是盐桥,不能组成原电池;D装置中缺少盐桥。
答案 B3.以下事实不能用原电池原理说明的是()A.将镁粉、铁粉和食盐一块加到水中迅速反映放热B.铁被钝化处置后不易侵蚀C.纯锌与稀硫酸反映时,滴入少量CuSO4溶液后反映速度加速D.镀层破损后,镀锌铁比镀锡铁更耐用解析将镁粉、铁粉和食盐一块加到水中,组成原电池装置,金属镁是负极,镁和水的反映是放热反映,形成原电池能够加速化学反映速度,能用原电池原理说明,A不符合题意;铁被钝化后,在金属表面会形成一层致密的金属氧化膜,爱惜内部金属不易被侵蚀,不能用原电池原理说明,B符合题意;纯锌与稀硫酸反映时,滴入少量CuSO4溶液后,金属锌能够和硫酸铜反映置换出铜,Zn、Cu、硫酸会组成原电池装置,Zn为负极,使得Zn和硫酸的反映速度加速,能用原电池原理说明,C不符合题意;镀层破损后,镀锌铁和潮湿空气形成的原电池中,金属Zn为负极,Fe为正极,Fe被爱惜,镀锡铁和潮湿空气形成的原电池中,金属Fe为负极,Sn 为正极,Fe被侵蚀速度加速,镀锌铁比镀锡铁更耐用,能用原电池原理说明,D不符合题意。
答案 B4.某小组进行电化学研究,甲同窗设计如图的原电池装置,乙同窗利用甲设计的装置及提供的药品与材料,不能完成的实验是()A.使甲同窗的正极变成负极B.设计一个新的原电池C.在石墨电极上镀锌D.使锌电极受到爱惜解析A项,将铜与石墨相连,以AgNO3溶液作电解质,铜为负极,正确;B项,铝-铜-AgNO3溶液、铝-铜-CuSO4溶液等均能够组成新的原电池,正确;C项,镀锌是电解池,错误;D项,锌、铝作电极,锌作正极,受到爱惜,正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题6-§3-2化学电源(同步练习)班级姓名座号一、选择题(每小题只有一个正确答案)1.利用离子反应“Fe+2Fe3+=3Fe2+”设计原电池,下列设计不合理的是( )①铜片、铁片、FeCl3溶液组成的原电池②石墨、铁片、Fe(NO3)3溶液组成的原电池③铁片、锌片、Fe2(SO4)3溶液组成的原电池④银片、铁片、Fe(NO3)2溶液组成的原电池A.①②B.②③C.③④D.②④2.下列有关锌锰干电池的说法中正确的是( )A.锌外壳是负极,石墨棒是正极材料B.在外电路中电子从石墨棒流向锌外壳C.电流从锌外壳流到石墨棒上D.电池内部阳离子从石墨棒向锌外壳移动3.(2020·湖北四地七校期中联考)如图是某化学课外活动小组设计的用化学电源使LED 灯发光的装置。
下列有关该装置的说法正确的是( )A.铜为负极,其附近的溶液变蓝,溶液中有Cu2+产生B.其能量转化的形式主要是化学能→电能→光能C.如果将锌片换成铁片,电路中的电流方向将发生改变D.如果将稀硫酸换成柠檬汁,LED灯将不会发光4.(2020·河北保定一中高一期中)某兴趣小组设计的简易原电池装置如图所示。
该电池工作时,下列说法正确的是( )A.锌片作正极B.碳棒上有气泡产生C.可将电能转化为化学能D.电子由碳棒经导线流向锌片5.(2019·吉林第三中学阶段测试)原电池总反应离子方程式为Mg+2H+=Mg2++H2↑,能实现该反应的原电池是( )A.正极为铜,负极为镁,电解质溶液为稀盐酸B.正极为铜,负极为铁,电解质溶液为稀硫酸C.正极为石墨,负极为镁,电解质溶液为CuSO4溶液D.正极为银,负极为镁,电解质溶液为NaCl溶液碱性锌锰电池铅-硫酸蓄电池原电池银锌纽扣电池2B.图Ⅰ所示电池放电过程中,硫酸浓度不断增大C.图Ⅰ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变D.图Ⅰ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag7.(2019·山东邹平一中高一)某普通锌锰干电池的结构如图所示。
下列说法正确的是( )A.锌筒是原电池的正极B.石墨电极上发生氧化反应C.铵根离子流向石墨电极D.电子经石墨电极沿电解质溶液流向锌筒8.(2020·成都外国语学校高一期中)银锌纽扣电池,其电池反应式为:Zn+Ag2O+H2O Zn(OH)2+2Ag。
下列说法不正确的是( )A.锌作负极,发生氧化反应B.负极的电极反应式为Zn-2e-=Zn2+C.正极为Ag2O,发生还原反应D.电池工作时,电流从Ag2O经导线流向Zn9.某华人科学家和他的团队研发出“纸电池”(如图)。
这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。
纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为Zn+2MnO2+H2O=ZnO+2MnO(OH)。
下列说法正确的是( )A.该电池的正极材料为锌B.该电池反应中二氧化锰发生氧化反应C.电池的正极反应式为MnO2+H2O+e-=MnO(OH)+OH-D.当有0.1 mol锌溶解时,流经电解液的电子数为1.204×102310.燃料电池是目前电池研究的热点之一。
现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。
下列叙述不正确的是( )A.外电路中电子由a流向bB.b极反应式是O2+4OH--4e-=4H2OC.总反应式为2H2+O2=2H2OD.使用过程中电解质溶液的浓度逐渐减小11.(2020·江西南昌中学高一期中)燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是( )A.负极反应式:O2+2H2O+4e-=4OH-B.负极反应式:CH4+8OH--8e-=CO2+6H2OC.随着放电的进行,溶液的氢氧根离子浓度不变D.放电时溶液中的阴离子向负极移动12.(2019·湖北襄阳高一质检)Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。
下列叙述不正确的是( )A.负极反应式为Mg-2e-=Mg2+B.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑C.正极反应式为AgCl+e-=Ag+Cl-D.电池放电时Cl-由负极向正极迁移13.锂离子电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂离子电池,某种锂离子电池的总反应式为Li+MnO2=LiMnO2,下列说法中正确的是( )A.Li是正极,电极反应式为Li-e-=Li+B.Li是负极,电极反应式为Li-e-=Li+C.MnO2是负极,电极反应式为MnO2+e-=MnO2-D.Li是负极,电极反应式为Li-2e-=Li2+14.(2020·湖南省武冈市第一中学高一期中)下面是几种常见的化学电源示意图,有关说法不正确的是( )A.下述电池分别属于一次电池、二次电池和燃料电池B.干电池在长时间使用后,锌筒被破坏C.铅蓄电池在工作中,负极每消耗1 mol铅,则硫酸溶液中就转移2 mol电子D.氢氧燃料电池是一种具有广阔应用前景的绿色电源15.(2019·柯桥区期末)最近,科学家研发了“全氢电池”,其工作原理如图所示。
下列说法正确的是( )A.右边吸附层中发生了氧化反应B.负极的电极反应是H2-2e-+2OH-=2H2OC.当右边吸附层中产生标准状况下氢气2.24 L时,电子在溶液中通过了0.2 molD.电解质溶液中Na+向左移动,ClO4-向右移动16.(2020·天水一中期末)固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。
该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。
下列判断正确的是( )①多孔电极a为负极②a极的电极反应式为O2+2H2O+4e-=4OH-③b极的电极反应式为H2-2e-+O2-2O④该电池的总反应式为2H2+O22H2OA.①②B.②④C.②③D.③④二、填空题17.选择适宜的材料和试剂,请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池。
请回答下列问题:(1)负极材料:______;正极材料:__________;电解质溶液:______________。
(2)写出电极反应式:正极:________________________;负极:_____________________________。
(3)原电池中电子从_________极流出,电解质溶液中阴离子流向_____极(填“正”或“负”)。
18.有一种微型电池,其电极分别为Zn和Ag2O,电解质溶液是KOH溶液,试回答下列问题:(1)原电池是把___________能转化成____________能的装置。
(2)该电池中Zn极为_________极。
(3)当金属Zn消耗了16.25 g时,转移电子的物质的量为_______________。
19.(2019·湖北孝感期中)航天技术中使用的氢氧燃料电池具有高能、轻便和无污染等优点。
氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都为2H2+O2=2H2O。
(1)工作时,电解质溶液中的阴离子移向_________(填“正”或“负”)极。
(2)酸式氢氧燃料电池的电解质溶液是稀硫酸,其负极反应式为2H2-4e-=4H+,则其正极反应式为____________________________________________。
(3)碱式氢氧燃料电池的电解质溶液是KOH溶液,如右图,则其负极反应式为______________________________________。
若该电池工作时溶液中增加1 mol H2O,则理论上电路中通过电子的物质的量为___________ mol。
20.(2020·河北鸡泽一中高一期中)(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向可知,氧气从_____口通入(填“a”或“b”),X极为电池的_______(填“正”或“负”)极。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为A极:2H2+2O2--4e-=2H2O;B极:O2+4e-=2O2-。
则A极是电池的_______极;电子从该极____________(填“流入”或“流出”)。
(3)若将(1)中燃料电池改为甲烷—空气燃料电池,该电池工作时,负极反应式为______________________,电池总反应式为__________________________________。
21.有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:实验次数电极材料水果品种电极间距/cm电压/mV 1锌铜菠萝39002锌铜苹果36503锌铜柑橘38504锌铜西红柿37505锌铝菠萝36506锌铝苹果3450试根据上表中的实验数据回答下列问题:(1)实验2中负极是________,电极反应式为______________________________。
(2)实验1和5电流方向相反的原因是___________________________________________________________________________________________________________。
(3)由实验1~实验4可知影响水果电池的电压的因素有________________________。
(4)根据实验2、6和实验1、5的比较可发现水果电池的电压还与___________有关。
专题6-§3-2化学电源(同步练习)参考答案一、选择题(每小题只有一个正确答案)1.C 解析:Cu不如铁活泼,则Fe作负极、Cu作正极,故①正确;活泼金属铁作负极,电解质溶液是含有Fe3+的溶液,故②正确;Fe不如Zn活泼,则Fe作正极、Zn作负极,故③错误;电解质溶液应是铁盐溶液,而不是亚铁盐溶液,故④错误。
2.A 解析:A项,在锌锰干电池中,锌外壳是负极,石墨棒是正极,故正确;B项,在外电路中电子从锌外壳流向石墨棒,故错误;C项,电流的方向与电子的流向相反,应从石墨棒流向锌外壳,故错误;D项,电池内部,阳离子向正极石墨棒移动,故错误。
3.B 解析:锌片作负极,发生氧化反应,铜片作正极,发生还原反应,A错误;该装置的能量转化形式是“化学能→电能→光能”,B正确;如把锌片换为铁片,铜片依然为正极,电路中的电流方向不会发生改变,C错误;如将稀H2SO4换为柠檬汁,由于柠檬汁中含有柠檬酸,溶液呈酸性,LED灯也会发光,D错误。
