专题四一单元一课时杂化轨道理论与分子空间构型导学案(无答案)-河北省涞水波峰中学高三化学一轮复习
【原创】高二化学《分子的空间构型与应用》导学案
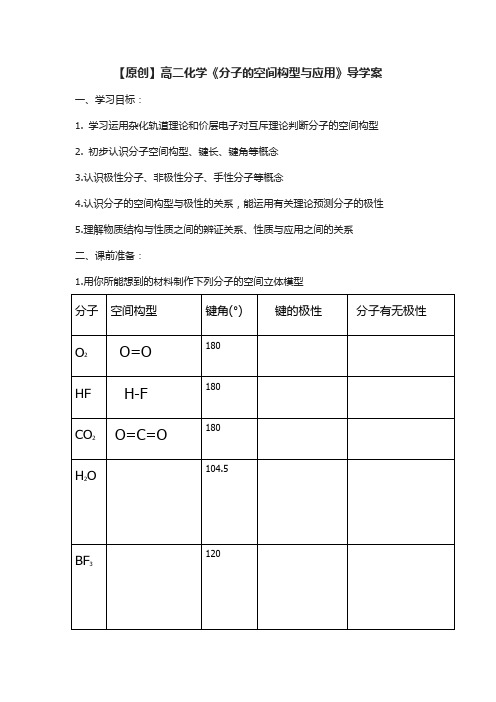
2.思考以下问题:①判断分子空间构型构型的方法有哪些?②CH4和CCl4的空间构型是什么,键角一样吗?H2O 、NH3、CH4中心原子杂化类型是什么,三者的键角一样吗?③从以上物质的空间构型归纳分子极性的规律。
④我们学过的同分异构有哪些类型?三、教学过程1.判断分子空间构型的方法①杂化轨道理论:P66【你知道吗?】C原子与H原子结合形成的分子为什么是CH4,而不是CH2或CH3?在形成CH4分子的过程中,碳原子_______轨道上的_______个电子进入_______空轨道,_______轨道和_______轨道“混和”起来,形成______________,C-H键的键角为_______,分子的空间构型为______________,CCl4键角为_______,C-H键长____C-Cl键长(填大于、小于或等于)。
②价层电子对互斥理论:分子中的_____________(包括成键电子对和孤电子对)由于相互_________作用,而趋向于彼此_____________以减小_____________,分子尽可能采取_____________的空间构型。
价电子对数分别是2、3、4时,价电子对的几何分布分别呈_____________、_____________、_____________。
③等电子原理:具有相同价电子数和相同原子数的分子或离子具有相同的结构特征。
例题:CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]。
CO分子中C原子上有一对孤电子对,C、O原子都符合8电子稳定结构,CO的结构式为,与CO 互为等电子体的离子为(填化学式)。
2.同分异构现象分子内部原子的结合顺序、成键方式等不同而产生分子式相同而结构不同的现象称为同分异构现象,具有同分异构现象的化合物互称为同分异构体。
①写出化学式为C5H12的有机物的结构式:______________________、_____________________、______________________②乙酸(CH3COOH)和甲酸甲酯(HCOOCH3)____(是或不是)同分异构体,二者的官能团分别是________________、________________③乳酸的结构键线式如图,请用*标出手性碳原子。
高二 化学杂化轨道理论 导学案

3)杂化轨道只用于形成键或者用来容纳。
3.判断杂化轨道的方法
1)结合R模型判断分子立体构型
分子式
BeCl2
BCl3
CH4
价层电子对数
分子可能立体构型
杂化类型
轨道总数
与组成
共有2个杂化轨道
1个ns和1个np
共有个杂化轨道
①CH≡CH ②CH3OH ③HCHO ④CH3COOH ④ ⑤CH3COOH
二、探究未知请同学们写出自己的疑惑,至少两点。
①;
②。
重点:正确判断中心原子的杂化类型及立体构型。
难点:判断中心原子的杂化类型。
【导学流程】
一.基础感知
1.杂化理论:在外界条件影响下,原子内部能量相近的原子轨道混合的过程叫做原子轨道的杂化,重新组合后形成的新的原子轨道叫杂化原子轨道。
2.杂化理论要点:
1).杂化理论是一种__________理论,是鲍林为了解释分子的________提出的。
杂化轨道理论
【学习目标】
1.学生结合P39-40,熟记SP、SP2、SP3杂化轨道的组成,说出杂化轨道的特点。
2.学生结合P41表2-6,利用VSEPR模型判断中心原子的杂化类型和立体构型。
3.学生结合教师讲评,能说出杂化轨道理论的要点。
4.学生结合教师讲评,能总结判断中心原子杂化轨道的方法。
【重点难点】
个ns和个np
共有个杂化轨道
个ns和个np
2)解题指导:若中心碳原子连四个单键,则为sp3杂化,若碳原子上连有一个双键则为sp2杂化,若中心碳原子连有一个三键则为sp杂化。例如:CH2=CH2中心C原子形成3个σ键,一个π键(是由一个p轨道形成),无孤对电子,故价层电子对数为3,杂化类型为sp2。
2.2.2《杂化轨道理论和配合物简介》导学案(含解析)人教版高二化学选修3

第二章《分子结构与性质》导学案第二节分子的立体构型(第二课时杂化轨道理论和配合物简介)【学习目标】1.通过阅读思考、讨论交流,了解杂化轨道理论的内容,知道原子轨道杂化的条件及原子轨道与杂化轨道数目的关系。
2.通过问题探究、典析剖析,能根据杂化理论判断简单分子或离子的立体构型。
3.通过实验探究配位键的特点及配合物理论,能说明简单配合物的成键情况,培养学生实验探究问题的能力。
【学习重点】杂化轨道理论的理解及对简单分子或离子的空间构型判断、配合物概念及成键特点【学习难点】配合物概念及成键特点【自主学习】旧知回顾:1.共价键按轨道的重叠方式可分为σ键和π键两种类型。
2. 甲烷分子呈正四面体形结构,它的4个C—H键的键长相同,H—C—H的键角为109°28′。
按照我们已经学过的价键理论,甲烷的4个C—H单键都应该是σ键,可否用价层电子对互斥理论解释其原因?不可以。
新知预习:1.杂化轨道理论原理是原子在形成分子时,由于原子的相互影响,若干不同类型能量相近的原子轨道混杂起来,混杂时保持轨道总数不变,重新组合成新的相同的轨道。
2.杂化轨道理论要点:(1)条件:杂化轨道理论认为,在形成分子时,通常存在激发、杂化、轨道重叠等过程。
但应注意,原子轨道的杂化,只有在形成分子的过程中才会发生,而孤立的原子是不可能发生杂化的。
同时只有能量相近的原子轨道(如2s,2p等)才能发生杂化,而1s轨道与2p轨道由于能量相差较大,它是不能发生杂化的。
3.配位键是成键的两个原子一方提供孤对电子,一方提供空轨道而形成的共价键。
金属离子或原子与某些分子或离子(称为配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
共同特点是由提供孤对电子的给予体与接受孤对电子的中心原子(或离子)以配位键结合形成的化合物,又称络合物。
【同步学习】情景导入:上节课我们学习了价层电子对互斥理论,现在请同学们用价层电子对互斥理论预测甲烷分子的空间构型如何?从键数、键能、键长、键角、构型各方面观察,我们发现C的价电子排布与CH4的结构之间的出现了矛盾。
杂化轨道理论和配合物导学案

杂化轨道和配合物理论(第一课时)班级: 姓名: 小组: 。
【学习目标】1.学生通过阅读课本39-40,记忆SP SP 2 SP 3轨道组成、形状,说出杂化轨道的特点及用途。
2.学生通过阅读课本41页表2-6,能判断杂化轨道的数目、类型及与分子构型之间的关系。
3.学生通过阅读课本41-43页内容,能利用定义判断中心原子、配体,并正确表示配位键。
4.学生通过教师讲解,结合内、外界原子性质的不同,利用实验现象确定配合物的结构。
【重点难点】重点:判断杂化轨道类型,推断分子的立体构型,常见配合物的形成结构及表示方法。
难点:杂化轨道类型及分子构型的判断。
【导学流程】一.基础感知1.结合课本39-41页“杂化轨道理论”内容,完成下列问题:1)2)确定杂化轨道步骤①计算中心原子的价层电子对②确定VSEPR 模 ③确定杂化轨道类型 由上述步骤确定中心原子采取的杂化轨道类型,并推测分子的立体构型。
①PCl 3 ②BCl 2 ③CS 2 ④SCl 2 ⑤HCHO ⑥SO 42- ⑦H 3O +思考:有机物中标有“·”的碳原子的杂化方式依次为?2.结合课本41-43页“配合物理论”内容,完成下列问题:1)配合物的组成如右图所示,回答关于配合物[TiCl(H 2O)5]Cl 2•H 2O 的相关问题:A.配体是 ,配位数是B.作为配体的Cl −与非配体Cl −的数目关系C.中心离子是 ,配离子D.1mol 该物质与足量AgNO 3溶液作用,最多生成 molAgCl2)向CuSO 4溶液中加入过量的NaOH 溶液可生成[Cu(OH)4]2-,试回答:①提供孤电子对的是 ②提供空轨道的是③[Cu(OH)4]2-的结构可用示意图表示为杂化类型 轨道组成 轨道夹角 实例 立体构型 SPBeCl 2 SP 2 BF 3 SP 3 CH 4內界 (配离子)。
分子的立体构型----杂化轨道理论教学设计-【通用,经典教学资料】

第二节分子的立体构型----杂化轨道理论教学设计一、教材分析1.教材的地位与作用本章比较系统地介绍了分子的结构和性质,内容比较丰富。
而本节课在共价键概念的基础上,介绍了分子的立体构型,并根据价层电子对互斥理论和杂化轨道理论对简单共价分子结构的多样性和复杂性进行了解释;并根据上述理论判断简单分子或离子的构型。
与前一节相比,它们在知识的认知水平上是渐进的,前一节是后一节的基础和铺垫。
2.教材处理⑴从H 、C、 N 、O的原子结构,依据共价键的饱和性和方向性,用电子式和结构式描述常见分子的结构,为本节学习做好铺垫。
⑵从甲烷分子分子中碳原子的价电子构型,对照甲烷分子的构型,引出问题:如何解释甲烷正四面体构型。
二、学情分析在学习本节课之前,学生已经在《化学必修2》介绍了共价键的概念,并用电子式的方式描述了原子间形成共价键的过程,为本节的学习做了铺垫。
学生比较容易用电子云和原子轨道进一步认识和理解共价键。
三、三维目标、重难点的确立及确立依据1.三维目标的确立及确立依据根据新课标的评价建议及教学目标的要求,结合本教材的内容及学生特点,我确定如下的教学目标:⑴知识与技能:认识杂化轨道理论的要点,能根据杂化轨道理论判断简单分子和离子的杂化类型,进一步了解化合物中原子的成键特征,提高归纳能力和空间想象能力⑵过程与方法:采用图表、比较、讨论的方法学习新知;通过观察原子轨道的图片和模型来理解抽象的概念。
⑶情感态度与价值观:通过了解杂化轨道理论提出的背景,激发投身科学、追求真理的积极情感,体验科学探究的艰辛与愉悦2.重难点的确立及确立依据:重点:杂化轨道理论的要点难点:对杂化轨道理论的理解确立依据:弱电解质的电离平衡应用到平衡理论,掌握若电解质电离平衡的学习方法,对今后学习盐类的水解平衡和沉淀的溶解平衡奠定了基础。
并且在运用已学知识分析、推导新知识的过程中,提高分析问题和总结知识的能力。
四、教学流程1.引入:自然科学的研究在许多时候产生于人们对一些既定的科学事实的解释,例如上节课我们所学习的价层电子对互斥理论,它很好地解释并预测了分子的立体构型。
高中化学_杂化轨道与分子构型教学设计学情分析教材分析课后反思

第二节杂化轨道和空间构型【学习目标】1.复习巩固电子式、共价键、σ键、π键、键参数。
2.理解掌握杂化轨道、价层电子对、会计算价层电子对数,理解中心原子轨道和分子构型的关系。
重难点:杂化轨道理解计算,杂化轨道和分子构型的关系【回顾旧知识】1、共价键的实质:2、σ键、π键的形成过程3、单键双键三键的组成4、写出下列物质的电子式N2HCl CO2H2O NH3BF3CH4【开启新知识】一、活动探究发挥自己的想象,各小组用橡皮泥把下列物质可能的形状捏出来CO2H2O NH3BF3CH4提示:原子用球,键用牙签成果展示疑问:CO2H2O的组成都是一个中心原子,两个被结合原子,分子组成一样,构型为什么不一样?问题分析:分子构型是由共价键的和决定的共价键的实质是也就是说,分子长什么样和共用电子对所处的轨道夹角有关系二、杂化轨道理论1.用杂化轨道理论解释甲烷分子的形成在形成CH4分子时,碳原子的一个轨道和三个轨道发生混杂,形成四个能量相等的杂化轨道。
四个杂化轨道分别与四个H原子的1s轨道重叠成键形成CH4分子,所以四个C—H键是等同的。
可表示为2.杂化轨道的类型问题思考:(1)观察上述杂化过程,分析原子轨道杂化后,数量和能量有什么变化?(2)2s轨道与3p轨道能否形成sp2杂化轨道?三、确定杂化轨道数目及类型对AB m形分子来说杂化轨道数目=σ键+ 孤电子对数=m +练练手A原子的价电子数-m×B原子最多还能容纳的电子数2【巩固练习】学情分析学生在学习本部分内容之前,学习了共价键的相关知识,但这一部分内容比较抽象,难以理解,学生学起来很吃力,尤其是价层电子对互斥理论、杂化轨道理论、VSEPR模型,学生根本分不清是什么东西,也不知道有什么用法。
我在这样的基础上,先把杂化轨道理论放在前面,价层电子对互斥理论和VSEPR 模型放到后面,这样学生能知道计算出来的杂化轨道,轨道里面填装价层电子对,然后再相互排斥,得到构型。
2.2.3杂化轨道理论教学设计2024-2025学年高二上学期化学人教版(2019)选择性必修2
3.加强课后辅导,针对学生在杂化轨道理论方面存在的问题,进行有针对性的指导,提高教学效果。
板书设计
1.标题:2.2.3杂化轨道理论
-杂化轨道定义
-杂化类型:sp、sp^2、sp^3
-杂化轨道与分子结构
-杂化轨道与分子性质
核心素养目标
学情分析
本课程面向高二年级学生,他们在前一阶段的学习中,已掌握了原子结构、化学键等基础知识,概念的理解上,学生可能存在一定难度。在知识层面,学生对分子空间构型的认识尚需加强;在能力方面,学生的空间想象和逻辑推理能力有待提高;在素质方面,学生的科学探究精神和合作学习能力需要进一步培养。此外,部分学生可能存在对复杂概念的理解障碍,影响了对杂化轨道理论的掌握。因此,教学中应注重启发式教学,结合实际案例,帮助学生克服学习难点,提高学生的学科素养。
3.应用题:给出2-3个分子的结构,要求学生判断其杂化类型,并解释其分子性质。
4.实践题:分组讨论,每组选择一个有机分子,分析其杂化类型,并在课堂上展示分析过程和结果。
5.快速问答:教师随机提问,学生快速回答,问题涉及课程内容的重点和难点。
总用时:45分钟
在教学过程中,注意关注学生的学习反馈,及时调整教学方法和节奏,确保学生能够理解和掌握杂化轨道理论。同时,注重培养学生的学科素养,提高他们的解决问题的能力。
学生学习效果
1.理解杂化轨道的概念,掌握sp、sp^2、sp^3等杂化类型及其形成原理。
2.应用杂化轨道理论解释分子几何构型及键性,分析分子的结构与性质关系。
板书设计以简洁明了为原则,通过关键词和核心概念突出课程重点,结合直观的分子模型简图和杂化轨道示意图,帮助学生更好地理解抽象的理论知识,增强课堂学习的趣味性和艺术性。
高中化学杂化轨道理论优秀教案

杂化轨道理论教学设计模板课题名称杂化轨道理论简介教师姓名冯明华学生年级高二课时 1课程标准描述来源:]通过分析甲烷、乙烯和乙炔的杂化轨道形成过程,学会用杂化轨道理论解释分子构型的方法;学会从甲烷、乙烯和乙炔的结构解释物质性质的方法考试大纲描述能说出sp、sp2、sp3杂化轨道的形成过程;会用杂化轨道理论解释分子的构型教材内容分析认识共价分子的多样性和复杂性判断简单分子或离子构型。
根据杂化轨道理论和价层电子对互斥理论判断分子或离子构型,帮助学生充分理解sp、sp2、sp3杂化轨道的形成过程可以确保学生正确判断分子或离子构型学生分析学生的空间想象思维略弱,相关知识的准确度不够,在教学中需要细致把握。
可通过微观和宏观模型或者模拟视频认识微观分子。
学习目标1.学生通过阅读教材,了解分子杂化轨道理论。
2.学生通过理解学案相关内容,能判断常见分子的杂化方式。
重点判断常见分子的杂化轨道形成过程难点判断常见分子的分子构型教学过程教师活动学生活动阅读学生快速阅读教材,填写学案甲烷的杂化能说出甲烷的轨道杂化方式引入新课观察甲烷分子的球棍模型和比例模型,回忆甲烷分子构型通过碳原子结构与甲烷分子结构的认知冲突引导学生思考,引入杂化轨道的概念sp3杂化过程讲解引导学生从甲烷分子中碳原子的成键情况与碳原子价电子轨道表示式的冲突进行思考。
碳原子最外层未成对电子是2个,但是甲烷分子中碳原子却形成了四个共用电子对;碳原子最外层四个电子能量并不相同,但是甲烷分子中碳原子形成四个能量相同分析甲烷分子的结构,思考甲烷分子中碳原子与氢原子的成键情况并答复下列问题。
同时认识甲烷分子中碳原子的原子轨道发生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
姓名________班级______编制 方海英 时间 7.23 编号 12 审核 张永罡
专题四 第一单元 分子构型与物质的性质
第一课时 杂化轨道理论与分子空间构型
[学习目标] 能准确判断共价分子中中心原子的杂化轨道类型,能用杂化轨道理论推测分子的空间构型。
课前预习单:
一、杂化轨道理论与分子的空间构型
1.sp 3杂化与CH 4分子的空间构型
(1)杂化轨道的形成
碳原子2s 轨道上的1个电子进入2p 空轨道,□011个2s 轨道和□023个2p 轨道“混合”,形成□
03能量相等、成分相同的4个sp 3杂化轨道。
图示:
(2)sp 3杂化轨道的空间指向 碳原子的4个sp 3杂化轨道指向□
04正四面体的4个顶点,每个轨道上都有一个未成对电子。
(3)共价键的形成
碳原子的4个□
05sp 3杂化轨道分别与4个H 原子的□061s 轨道重叠形成4个相同的σ键。
(4)CH 4分子的空间构型
CH4分子的空间构型为□07正四面体结构,分子中C—H键之间的夹角都是□08109.5°。
2.sp2杂化与BF3分子的空间构型
(1)sp2杂化轨道的形成
硼原子2s轨道上的1个电子进入2p轨道。
□091个2s轨道和□102个2p轨道发生杂化,形成能量相等、成分相同□113个sp2杂化轨道。
图示:
(2)sp2杂化轨道的空间指向
硼原子的3个sp2杂化轨道指向平面三角形的三个顶点。
(3)共价键的形成
12sp2杂化轨道分别与3个氟原子的□132p轨道重叠,形成3个相同的硼原子的3个□
σ键。
(4)BF3分子的空间构型
BF3分子的空间构型为□14平面三角形,键角为□15120°。
3.sp杂化与BeCl2分子的空间构型
(1)杂化轨道的形成
Be原子2s轨道上的1个电子进入2p轨道,□161个2s轨道和□171个2p轨道发生杂
182个sp杂化轨道。
化,形成能量相等、成分相同的□
图示:
(2)sp杂化轨道的空间指向
两个sp杂化轨道呈直线形。
(3)共价键的形成。
