药品包装用复合膜、袋通则2015.doc
YBB药用复合膜袋通则图文稿

Y B B药用复合膜袋通则文件管理序列号:[K8UY-K9IO69-O6M243-OL889-F88688]Y B B00132002-2015药用复合膜、袋通则YaoyongFuheMo、DaiTongzeGeneralRequirementforLaminatedFilmsandPouchesforPharmaceuticalPackaging 复合膜系指各种塑料与纸、金属或其它塑料通过黏合剂组合而形成的膜,其厚度一般不大于0.25mm。
复合袋系将复合膜通过热合的方法而制成的袋,按制袋形式可分为三边封袋、中封袋、风琴袋、自立袋、拉链袋等。
本标准适用于非注射剂用的药品包装用复合膜、袋。
药品包装用复合膜按材料组合分类,如表1所示:表1?复合膜分类注1:玻璃纸简称PT;双向拉伸聚丙烯简称BOPP:双向拉伸聚酯简称BOPET;双向拉伸尼龙简称BOPA;聚乙烯简称PE;流延聚丙烯简称CPP;乙烯与醋酸乙烯酯共聚物简称EVA;乙烯与丙烯酸共聚物简称EAA;乙烯与甲基丙烯酸共聚物简称EMA。
注2:复合时可用干法复合或无溶剂复合,这时粘合层为一般的粘合剂。
也可用挤出复合,这时粘合层为PE或EVA、EMA、EAA等树脂。
[外观]取本品适量,在自然光线明亮处,正视目测。
不得有穿孔、异物、异味、粘连、复合层间分离及明显损伤、气泡、皱纹、脏污等缺陷。
复合袋的热封部位应平整、无虚封。
【鉴别】红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004-2015)第四法测定,每层应分别与对照图谱基本一致。
(铝、纸成分可不做)【阻隔性能】水蒸气透过量选用适宜方法。
试验时热封面向低湿度侧,试验温度38℃±5℃,相对湿度90%±2%,应符合表2的规定。
氧气透过量选用适宜方法,试验时热封面向氧气低压侧,试验温度23℃±2℃,应符合表2的规定。
表2?阻隔性能【机械性能】内层与次内层剥离高强度取膜、袋适量,照剥离强度测定法(YBB001020003-2015)测定,纵、横向剥离强度平均值应符合表3规定。
YBBxxxxxxxx-2015药用低密度聚乙烯塑料膜、袋

YBBxxxxxxxx-2015药用低密度聚乙烯塑料膜、袋本标准适用于采用流涎法和吹制法生产的药用薄膜和袋,主要原料为低密度聚乙烯树脂(LDPE)。
该产品适用于非无菌固体原料药的包装。
外观方面,取适量样品在明亮的自然光下观察,表面应光洁、色泽均匀,不得有穿孔、异物、异味、粘连。
袋的热封部位应平整,无虚封。
鉴别方面,使用红外光谱法和密度测定法进行检测。
红外光谱应与对照图谱基本一致。
密度应在0.910~0.935g/cm3之间。
阻隔性能方面,使用水蒸气透过量测定法和气体透过量测定法进行检测。
水蒸气透过量不得超过15g/(m2*24h),氧气透过量不得超过4000cm3/(m2*24h*0.1MPa)。
机械性能方面,使用拉伸性能测定法进行检测。
纵向和横向拉伸强度平均值均不得低于10MPa。
厚度小于等于0.05mm 的膜,纵向和横向断裂拉伸长率平均值均不得低于130%;厚度大于0.05mm的膜,纵向和横向断裂拉伸长率平均值均不得低于200%。
热合强度方面,对膜和袋分别进行检测。
对膜进行热合强度测试,热合强度平均值不得低于7.0N/15mm。
对袋进行热合强度测试,热合强度平均值不得低于7.0N/15mm。
本品炽灼残渣测试:取5.0g本品,精密称定后放入已恒重的坩埚中,缓缓炽灼至完全炭化,再于550℃炽灼至恒重。
遗留残渣不得超过0.1%。
溶出物试验:取适量本品,分别加入内表面积为600cm2的塞锥形瓶中,加入70℃±2℃的水、70℃±2℃的65%乙醇和58℃±2℃的正己烷,200ml浸泡2小时后取出,放冷至室温,用同批试验用溶剂补充至原体积为供试液。
以同批水、65%乙醇、正己烷为空白对照溶液,进行下列试验:易氧化物试验:取供试液20ml,精密加入高锰酸钾滴定液(0.002mol/L)20ml与稀硫酸1ml,煮沸3分钟,迅速冷却,加入碘化钾0.1g,在暗处放置5分钟,用硫代硫酸钠滴定液(0.01mol/L)滴定。
YBB001320022015 药用复合膜袋通则

YBB00132002-2015药用复合膜、袋通则Yaoyong Fuhe Mo 、Dai TongzeGeneral Requirement for Laminated Films and Pouches for Pharmaceutical Packaging 复合膜系指各种塑料与纸、金属或其她塑料通过黏合剂组合而形成的膜,其厚度一般不大于0、25mm。
复合袋系将复合膜通过热合的方法而制成的袋,按制袋形式可分为三边封袋、中封袋、风琴袋、自立袋、拉链袋等。
本标准适用于非注射剂用的药品包装用复合膜、袋。
药品包装用复合膜按材料组合分类,如表1所示:表1 复合膜分类注1:玻璃纸简称PT;双向拉伸聚丙烯简称BOPP;双向拉绳聚酯简称BOPET;双向拉伸尼龙简称BOPA;聚乙烯简称PE;留延聚丙烯简称CPP;乙烯与醋酸乙烯酯共聚物简称EV A;乙烯与丙烯酸共聚物简称EAA;乙烯与甲基丙烯酸共聚物简称EMA。
【外观】取本品适量,在自然光线明亮处,正视目测。
不得有穿孔、异物、异味、粘连、复合层间分离及明显损伤、气泡、皱纹、脏污等缺陷。
复合袋的热封部位应平整、无虚封。
【鉴别】红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004-2015)第四法测定,每层应分别与对照图谱基本一致。
(铝、纸成分可不做)【阻隔性能】水蒸气透过量选用适宜方法。
试验时热封面向低湿度侧,试验温度38℃±5℃,相对湿度90%±2%,应符合表2的规定。
氧气透过量选用适宜方法,试验时热封面向氧气低压侧,试验温度23℃±2℃,应符合表2的规定。
(YBB001020003-2015)测定,纵、横向剥离强度平均值应符合表3规定。
【复合袋的热合强度】照热合强度测定法(YBB00122003-2015)测定,测得值应符合表3规定。
表3 机械性能照包装材料溶剂残留量(YBB00312004-2015)测定法测定,溶剂残留总量不得过5、0mg/ m2,其中苯及苯类溶剂残留量均不得检出。
YBB001320022015复合膜通则
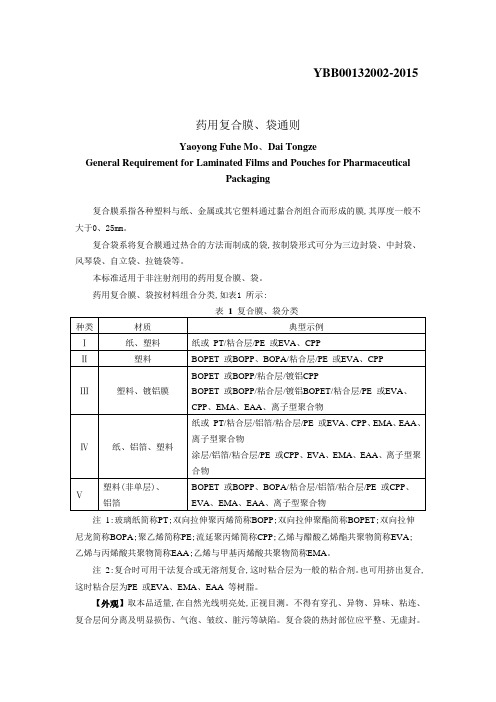
YBB00132002-2015药用复合膜、袋通则Yaoyong Fuhe Mo、Dai TongzeGeneral Requirement for Laminated Films and Pouches for PharmaceuticalPackaging复合膜系指各种塑料与纸、金属或其它塑料通过黏合剂组合而形成的膜,其厚度一般不大于0、25mm。
复合袋系将复合膜通过热合的方法而制成的袋,按制袋形式可分为三边封袋、中封袋、风琴袋、自立袋、拉链袋等。
本标准适用于非注射剂用的药用复合膜、袋。
药用复合膜、袋按材料组合分类,如表1 所示:注1:玻璃纸简称PT;双向拉伸聚丙烯简称BOPP;双向拉伸聚酯简称BOPET;双向拉伸尼龙简称BOPA;聚乙烯简称PE;流延聚丙烯简称CPP;乙烯与醋酸乙烯酯共聚物简称EVA; 乙烯与丙烯酸共聚物简称EAA;乙烯与甲基丙烯酸共聚物简称EMA。
注2:复合时可用干法复合或无溶剂复合,这时粘合层为一般的粘合剂。
也可用挤出复合,这时粘合层为PE 或EVA、EMA、EAA 等树脂。
【外观】取本品适量,在自然光线明亮处,正视目测。
不得有穿孔、异物、异味、粘连、复合层间分离及明显损伤、气泡、皱纹、脏污等缺陷。
复合袋的热封部位应平整、无虚封。
【鉴别】红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004-2015)第四法测定,每层应与对照图谱基本一致(铝、纸成分可不做)。
【阻隔性能】水蒸气透过量选用适宜方法。
试验时热封面向湿度低侧,试验温度38℃±0、5℃,相对湿度90%±2%,应符合表2 的规定。
氧气透过量选用适宜方法,试验时热封面向氧气低压侧,试验为温度23℃±2℃。
应符合表2 的规定。
【机械性能】内层与次内层剥离强度取膜、袋适量,照剥离强度测定法(YBB00102003-2015)测定,纵、横向剥离强度平均值应符合表3 规定。
【复合袋的热合强度】照热合强度测定法(YBB00122003-2015)测定。
药品包装用复合膜、袋通则2015
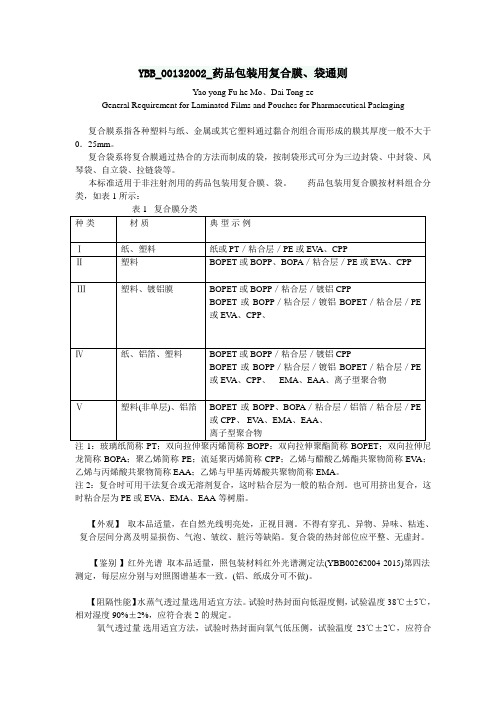
YBB_00132002_药品包装用复合膜、袋通则Yao yong Fu he Mo、Dai Tong zeGeneral Requirement for Laminated Films and Pouches for Pharmaceutical Packaging复合膜系指各种塑料与纸、金属或其它塑料通过黏合剂组合而形成的膜其厚度一般不大于0.25mm。
复合袋系将复合膜通过热合的方法而制成的袋,按制袋形式可分为三边封袋、中封袋、风琴袋、自立袋、拉链袋等。
本标准适用于非注射剂用的药品包装用复合膜、袋。
药品包装用复合膜按材料组合分类,如表1所示:注1:玻璃纸简称PT;双向拉伸聚丙烯简称BOPP:双向拉伸聚酯简称BOPET;双向拉伸尼龙简称BOPA;聚乙烯简称PE;流延聚丙烯简称CPP;乙烯与醋酸乙烯酯共聚物简称EV A;乙烯与丙烯酸共聚物简称EAA;乙烯与甲基丙烯酸共聚物简称EMA。
注2:复合时可用干法复合或无溶剂复合,这时粘合层为一般的粘合剂。
也可用挤出复合,这时粘合层为PE或EV A、EMA、EAA等树脂。
【外观】取本品适量,在自然光线明亮处,正视目测。
不得有穿孔、异物、异味、粘连、复合层间分离及明显损伤、气泡、皱纹、脏污等缺陷。
复合袋的热封部位应平整、无虚封。
【鉴别】红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004-2015)第四法测定,每层应分别与对照图谱基本一致。
(铝、纸成分可不做)。
【阻隔性能】水蒸气透过量选用适宜方法。
试验时热封面向低湿度侧,试验温度38℃±5℃,相对湿度90%±2%,应符合表2的规定。
氧气透过量选用适宜方法,试验时热封面向氧气低压侧,试验温度23℃±2℃,应符合表2的规定。
【机械性能】内层与次内层剥高强度取膜、袋适量,照剥离强度测定法(YBB001020003-2015)测定,纵、横向剥离强度平均值应符合表3规定。
药品包装用复合膜标准

药品包装用复合膜标准药品包装用复合膜是一种在医药行业中广泛使用的包装材料,其质量标准对于保障药品的质量和安全具有重要意义。
本标准旨在规定药品包装用复合膜的技术要求、试验方法、检验规则和标志、包装、运输、贮存等要求,以确保药品包装用复合膜的质量和安全性,保障药品的有效性和稳定性。
一、技术要求。
1. 外观质量,药品包装用复合膜应具有良好的透明度和光泽,无色差、气泡、皱纹、污渍等缺陷。
2. 物理性能,药品包装用复合膜应具有一定的拉伸强度、撕裂强度和破裂伸长率,以确保其在包装过程中不易损坏。
3. 化学性能,药品包装用复合膜应符合相关的卫生标准,不得含有对人体有害的物质,如重金属、有机溶剂等。
4. 热封性能,药品包装用复合膜应具有良好的热封性能,确保包装的密封性和防潮性。
5. 印刷性能,药品包装用复合膜应能够满足药品包装的印刷要求,印刷图案清晰、色彩饱满、不易脱落。
二、试验方法。
1. 外观检验,采用目测和光源透视等方法进行外观检验,确保药品包装用复合膜的外观质量符合要求。
2. 物理性能测试,采用拉伸试验机进行拉伸强度、撕裂强度和破裂伸长率的测试,确保其符合相关标准。
3. 化学性能测试,采用化学分析方法对复合膜中的有害物质进行检测,确保其不含有对人体有害的物质。
4. 热封性能测试,采用热封试验机对复合膜的热封性能进行测试,确保其能够满足包装的密封要求。
5. 印刷性能测试,采用印刷设备对复合膜进行印刷,检验其印刷效果是否符合要求。
三、检验规则和标志。
1. 对于合格的药品包装用复合膜,应在其包装上标注相关的质量标志,以示其合格性。
2. 对于不合格的药品包装用复合膜,应及时予以淘汰,并进行相应的处理,以免影响药品的质量和安全。
四、包装、运输、贮存。
1. 药品包装用复合膜应在包装过程中注意防潮、防晒、防污染,确保其质量不受影响。
2. 在运输和贮存过程中,应避免受潮、受热、受压,以免影响其使用性能和质量。
综上所述,药品包装用复合膜标准对于保障药品的质量和安全具有重要意义,各相关企业应严格按照标准要求进行生产和使用,以确保药品的有效性和稳定性,保障人民群众的用药安全。
YBB00132002药品包装用复合膜袋通则 (1)

YBB_00132002_药品包装用复合膜、袋通则复合膜系指各种塑料与纸、金属或其它塑料通过黏合剂组合而形成的膜其厚度一般不大于0.25mm。
复合袋系将复合膜通过热合的方法而制成的袋,按制袋形式可分为三边封袋、中封袋、风琴袋、自立袋、拉链袋等。
本标准适用于非注射剂用的药品包装用复合膜、袋。
药品包装用复合膜按材料组合分类,如表1所示:表1 复合膜分类种类材质典型示例Ⅰ纸、塑料纸或PT/粘合层/PE或EV A、CPPⅡ塑料 BOPET或BOPP、BOPA/粘合层/PE或EV A、CPPⅢ塑料、镀铝膜 BOPET或BOPP/粘合层/镀铝CPPBOPET或BOPP/粘合层/镀铝BOPET/粘合层/PE或EV A、CPP、EMA、EAA、离子型聚合物Ⅳ纸、铝箔、塑料纸或PT/粘合层/铝箔/粘合层/PE或EV A、CPP、EMA、EAA、离子型聚合物涂层/铝箔/粘合层/PE或CPP、EV A、EMA、EAA、离子型聚合物Ⅴ塑料(非单层)、铝箔BOPET或BOPP、BOPA/粘合层/铝箔/粘合层/PE或CPP、 EVA、EMA、EAA、离子型聚合物注1:玻璃纸简称PT;双向拉伸聚丙烯简称BOPP:双向拉伸聚酯简称BOPET;双向拉伸尼龙简称BOPA;聚乙烯简称PE;流延聚丙烯简称CPP;乙烯与醋酸乙烯酯共聚物简称EV A;乙烯与丙烯酸共聚物简称EAA;乙烯与甲基丙烯酸共聚物简称EMA。
注2:复合时可用干法复合或无溶剂复合,这时粘合层为一般的粘合剂。
也可用挤出复合,这时粘合层为PE或EV A、EMA、EAA等树脂。
[鉴别] 红外光谱选取适宜方法,取每层材料,照分光光度法(中华人民共和国药典2000年版附录ⅣC)测定,应符合规定。
(铝、纸成分可不做)。
[外观] 取本品适量,在自然光线明亮处,正视目测。
不得有穿孔、异物、异味、粘连、复合层间分离及明显损伤、气泡、皱纹、脏污等缺陷。
复合袋的热封部位应平整、无虚封。
[阻隔性能] 水蒸气透过量照塑料薄膜和片材透水蒸气性试验方法杯式法(GBl037-88)的规定进行。
YBB00072005-2015药用低密度聚乙烯塑料膜、袋

YBB00072005-2015药用低密度聚乙烯塑料膜、袋YBB00072005-2015药用低密度聚乙烯膜、袋Yaoyong Dimidu Jyixi Mo、DaiLDPE Films and Pouches for Pharmaceutical Packaging本标准适用于低密度聚乙烯树脂(LDPE)为主要原料采用流涎法、吹制法生产的药用薄膜,以及由此薄膜通过热封制成的袋。
本品适用于非无菌固体原料药的包装。
【外观】取本品适量,在自然光线明亮处,正视目测。
表面应光洁、色泽均匀,不得有穿孔、异物、异味、粘连。
袋的热封部位应平整、无虚封。
【鉴别】 *(1)红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004-2015)第四法测定,应与对照图谱基本一致。
(2)密度取本品约2g,浸渍液选用无水乙醇,照密度测定法(YBB00132003-2015)测定,本品的密度应为0.910,0.935g/cm3【阻隔性能】水蒸气透过量取本品适量,照水蒸气透过量测定法(YBB00092003-2015)第一法实验条件B测定,不得过15g/(m2*24h)。
氧气透过量取本品适量,照气体透过量测定法(YBB00082003-2015)第一法或第二法测定,不得过4000cm3/(m2*24h*0.1MPa)。
【机械性能】拉伸强度取本品适量,照拉伸性能测定法(YBB00112003-2015)测定,试验速度(空载):300mm/min?30mm/min,试样为? 型。
纵向、横向拉伸强度平均值均不得低于10MPa。
断裂拉伸率取本品适量,找拉伸性能测定法(YBB00112003-2015)测定,试验速度(空载):300mm/min?30mm/min,试样为? 型。
厚度小于等于0.05mm的膜,纵向、横向断裂拉伸长率平均值均不得低于130%;厚度大于0.05mm的膜,纵向、横向断裂拉伸长率平均值均不得低于200%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
YBB_00132002_药品包装用复合膜、袋通则
Yao yong Fu he Mo、Dai Tong ze
General Requirement for Laminated Films and Pouches for Pharmaceutical Packaging
复合膜系指各种塑料与纸、金属或其它塑料通过黏合剂组合而形成的膜其厚度一般不大于0.25mm。
复合袋系将复合膜通过热合的方法而制成的袋,按制袋形式可分为三边封袋、中封袋、风琴袋、自立袋、拉链袋等。
本标准适用于非注射剂用的药品包装用复合膜、袋。
药品包装用复合膜按材料组合分类,如表1所示:
注1:玻璃纸简称PT;双向拉伸聚丙烯简称BOPP:双向拉伸聚酯简称BOPET;双向拉伸尼龙简称BOPA;聚乙烯简称PE;流延聚丙烯简称CPP;乙烯与醋酸乙烯酯共聚物简称EV A;乙烯与丙烯酸共聚物简称EAA;乙烯与甲基丙烯酸共聚物简称EMA。
注2:复合时可用干法复合或无溶剂复合,这时粘合层为一般的粘合剂。
也可用挤出复合,这时粘合层为PE或EV A、EMA、EAA等树脂。
【外观】取本品适量,在自然光线明亮处,正视目测。
不得有穿孔、异物、异味、粘连、复合层间分离及明显损伤、气泡、皱纹、脏污等缺陷。
复合袋的热封部位应平整、无虚封。
【鉴别】红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004-2015)第四法测定,每层应分别与对照图谱基本一致。
(铝、纸成分可不做)。
【阻隔性能】水蒸气透过量选用适宜方法。
试验时热封面向低湿度侧,试验温度38℃±5℃,相对湿度90%±2%,应符合表2的规定。
氧气透过量选用适宜方法,试验时热封面向氧气低压侧,试验温度23℃±2℃,应符合
表2的规定。
【机械性能】内层与次内层剥高强度取膜、袋适量,照剥离强度测定法(YBB001020003-2015)测定,纵、横向剥离强度平均值应符合表3规定。
【复合袋的热合强度】照热合强度测定法(YBB00122003-2015)测定。
测得应符合表3规定。
【溶剂残留量】取样品适量,裁取内表面积0.02m2,将其迅速裁成l0mm×30mm碎片,照包装材料溶剂残留量(YBB00312004-2015)测定法测定,溶剂残留总量不得过5.0mg/m2,其中苯类溶剂残留量均不得检出。
【袋的耐压性能】取5个袋,袋内填充约二分之一袋容量的水,并热合封口(参照生产工艺采用的热合条件)。
将试样逐个放在上、下板之间,试验中上、下板应保持水平,不变形,与袋的接触面必须光滑,上、下板的面积应大于试验袋。
根据表4规定加砝码保持1分钟(负荷为上加压板与砝码重量之和),目视,不得破裂或泄漏。
【袋的跌落性能】取5个袋,袋内填充约二分之一袋容量的水,并热合封口(参照生产工艺采用的热合条件)。
将试样按表5高度逐个自由落于光滑、坚硬的水平面(如水泥地面)。
目视,不得破裂。
【溶出物试验】供试液的制备:取样品适量,分别取本品内表面积600cm2(分割成长3cm,宽0.3cm的小片)三份置具塞锥形瓶中,加水(70℃±2℃)、65%乙醇(70℃±2℃)、正己烷(58℃±2℃)200ml浸泡2小时后取出,放冷至室温,用同批试验用溶剂补充至原体积作为供试液,以同批水、65%乙醇、正己烷为空白液,进行下列试验:
易氧化物精密量取水浸液20ml,精密加入高锰酸钾滴定液(0.002mol/L)20ml与稀硫酸1ml,煮沸3分钟,迅速冷却,加入碘化钾0.1g,在暗处放置5分钟,用硫代硫酸钠滴定液(0.01mol /L)滴定,滴定至近终点时,加入淀粉指示液0.25ml,继续滴定至无色,另取水空白液同法操作,二者消耗滴定液之差不得过1.5ml。
不挥发物分别取水、65%乙醇、正己烷浸出液与空白液各100ml置于已恒重的蒸发皿中,水浴蒸干,105℃干燥2小时,冷却后精密称定,水不挥发物残渣与其空白残渣之差应不得过30.0mg;65%乙醇不挥发物残渣与其空白残渣之差不得过30.0mg;正己烷不挥发物残渣与其空白残渣之差不得过30.0mg。
重金属精密量取水浸液20ml,加醋酸盐缓冲液(pH3.5)2ml,依法检查(中国药典2015年版通则第一法),含重金属不得过百万分之一。
【微生物限度】取试样用开孔面积为20cm2的消毒过的金属模板压在内层面上,将无菌棉签用氯化钠注射液稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次,共擦抹5个位置100cm2。
每支棉签抹完后立即剪断(或烧断),投入盛有30ml 氯化钠注射液的锥型瓶(或大试管)中。
全部擦抹棉签投入瓶中后,将瓶迅速摇晃1分钟,精置10分钟,即得供试品溶液。
供试品溶液进行薄膜过滤后,依法检查(中国药典2015年版通则1105、1106)。
测定应符合表6的规定。
表6 微生物限度指标
【异常毒性】取本品500cm2,剪碎(长3cm,宽0.3cm)。
加入氯化钠注射液50ml,置高压蒸汽灭菌器 110℃保持30分钟后取出,冷却后备用,以同批氯化钠注射液做空白,静脉注射,依法测定(中国药典2015年版通则1141),应符合规定。
附件:检验规则
1、产品检验分为全项检验和部分检验。
2、有下列情况之一时,应按标准的要求,进行全项检验。
(1)产品注册
(2)产品出现重大质量事故后,重新生产
(3)监督抽验
(4)产品停产后,重新恢复生产
3、产品批准注册后,药包材生产、使用企业在原料产地、添加剂、生产工艺等没有变更的情形下,可按标准的要求,进行全项检验。
4、外观检验:复合膜按每卷膜取2米进行检验;复合袋按计数抽样程序第一部分:按接收量限(AQL)检索的逐批检验抽样计划(GB/T2828.1-2012)规定进行,检验水平为Ⅱ,接收
质量限位6.5。
5、尺寸偏差见表7。
