13_异亮氨酸
食品营养强化剂氨基酸使用的有关要求
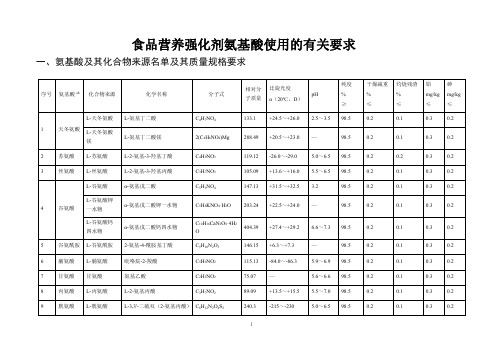
食品营养强化剂氨基酸使用的有关要求一、氨基酸及其化合物来源名单及其质量规格要求L-半胱氨酸L-α-氨基-β-巯基丙酸C3H7NO2S121.16+8.3~+9.5 4.5~5.598.50.50.10.30.2L-半胱氨酸盐酸盐一水物L-2-氨基-3-巯基丙酸盐酸盐一水物C3H7NO2S·HCl·H2O175.64+5.5~+7.0 1.5~2.098.58.0~120.10.30.2N-乙酰基-L-半胱氨酸N-乙酰基-L-α-氨基-β-巯基丙酸C5H9NO3S163.20+21~+27 2.0~2.898.00.20.1——10半胱氨酸L-胱氨酸L-3,3'-二硫双(2-氨基丙酸)C6H12N2O4S2240.3-215~-230 5.0~6.598.50.20.10.30.2 L-半胱氨酸L-α-氨基-β-巯基丙酸C3H7NO2S121.16+8.3~+9.5 4.5~5.598.50.50.10.30.2L-半胱氨酸盐酸盐一水物L-2-氨基-3-巯基丙酸盐酸盐一水物C3H7NO2S·HCl·H2O175.64+5.5~+7.0 1.5~2.098.58.0~120.10.30.2L-半胱氨酸盐酸盐L-2-氨基-3-巯基丙酸盐酸盐C3H7NO2S·HCl157.62+5.6~+8.9 1.5~2.098.5 2.00.10.30.211缬氨酸L-缬氨酸L-2-氨基-3-甲基丁酸C5H11NO2117.15+26.6~+28.8 5.5~6.598.50.20.10.30.212蛋氨酸L-蛋氨酸2-氨基-4-甲巯基丁酸C5H11NO2S149.21+21.0~+25.0 5.6~6.198.50.20.20.30.2N-乙酰基-L-甲硫氨酸N-乙酰-2-氨基-4-甲巯基丁酸C7H13NO3S191.25-18.0~-22.0—98.50.50.10.30.213亮氨酸L-亮氨酸L-2-氨基-4-甲基戊酸C6H13NO2131.17+14.9~+16.0 5.5~6.598.50.20.20.30.2 14异亮氨酸L-异亮氨酸L-2-氨基-3-甲基戊酸C6H13NO2131.17+38.9~+41.8 5.5~6.598.50.20.20.30.215酪氨酸L-酪氨酸S-氨基-3(4-羟基苯基)-丙酸C9H11NO3181.19-11.3~-12.1 5.0~6.598.50.20.20.30.216苯丙氨酸L-苯丙氨酸L-2-氨基-3-苯丙酸C9H11NO2165.19-33.0~-35.0 5.4~6.098.50.20.10.30.217赖氨酸L-盐酸赖氨酸L-2,6-二氨基己酸盐酸盐C6H14N2O2·HCl182.65+20.4~+21.5 5.0~6.098.50.40.10.30.2L-赖氨酸醋酸盐L-2,6-二氨基己酸醋酸盐C6H14N2O2·C2H4O2206.24+8.5~+10.0 6.5~7.598.50.30.20.30.2L-赖氨酸L-2,6-二氨基己酸C6H14N2O2·H2O164.2+25.5~+27.09.0~10.598.50.20.10.30.2L-赖氨酸-L-谷氨酸二水物L-2,6-二氨基己酸α-氨基戊二酸盐二水物C11H23N3O6·2H2O329.35+27.5~+29.5 6.0~7.598.00.20.10.30.2L-赖氨酸-天冬氨酸L-2,6-二氨基己酸L-氨基丁二酸盐C10H21N3O6279.30+24.0~+26.5 5.0~7.098.00.20.10.30.218精氨酸L-精氨酸L-2-氨基-5-胍基戊酸C6H14N4O2174.2+26.0~+27.910.5~12.098.50.20.10.30.2 L-盐酸精氨酸L-2-氨基-5-胍基戊酸盐酸盐C6H14N4O2·HCl210.66+21.3~+23.5—98.50.20.10.30.2 L-精氨酸-天冬氨酸L-2-氨基-5-胍基戊酸-L-氨基丁二酸C10H21N5O6307.31+25.0~+27.0 6.0~7.098.50.20.10.30.219组氨酸L-组氨酸α-氨基-β-咪唑基丙酸C6H9N3O2155.15+12.0~+12.87.0~8.598.50.20.20.30.2L-盐酸组氨酸一水物L-2-氨基-3-咪唑基丙酸盐酸盐一水物C6H9N3O2·HCl·H2O209.63+8.5~+10.5 3.5~4.598.50.20.10.30.220色氨酸L-色氨酸L-2-氨基-3-吲哚基-1-丙酸C11H12N2O2204.23-30.0~-32.5 5.4~6.498.50.20.10.30.2 21瓜氨酸L-瓜氨酸L-2-氨基-5-脲戊酸C6H13N3O3175.19+24.5~+26.5 5.7~6.798.50.20.10.30.222鸟氨酸L-盐酸鸟氨酸2,5-二氨基戊酸单盐酸盐C5H12N2O2·HCl168.62+23.0~+25.0 5.0~6.098.50.20.10.30.2a不得使用非食用的动植物原料作为单体氨基酸的来源。
异亮氨酸 分子量

异亮氨酸分子量全文共四篇示例,供读者参考第一篇示例:异亮氨酸(Isoleucine)是人体内十分重要的一种氨基酸,它是九种必需氨基酸之一。
异亮氨酸是一种脂溶性的氨基酸,即可溶于有机溶剂中,也可以溶解在脂肪中,但不溶于水。
这种氨基酸在人体内体内不仅参与蛋白质的合成,还在胰岛素的合成和体内抵抗感染中发挥着重要作用。
异亮氨酸的分子量为131.17g/mol,化学式为C6H13NO2,结构式为(CH3)2CHCH2CH(NH2)COOH。
异亮氨酸在自然界中主要以L 型存在,在体内可以转化为D型异亮氨酸。
异亮氨酸是构成蛋白质的重要组成部分之一,其主要功能是在体内参与蛋白质的合成和组织修复。
异亮氨酸还可以被转化为葡萄糖以供能源使用。
异亮氨酸还能够促进肌肉生长和修复受损组织。
增加异亮氨酸的摄入量可以提高肌肉质量,加速肌肉生长。
在日常生活中,异亮氨酸通常通过食物摄入。
富含异亮氨酸的食物主要包括肉类、鱼类、奶制品、豆类和坚果等。
体育锻炼者、运动员和生长发育期的儿童也可以通过补充异亮氨酸的方式来增加肌肉质量和促进身体发育。
虽然异亮氨酸在体内有着多种重要功能,但也不可忽视过量摄入的危害。
过量摄入异亮氨酸会导致代谢失常、肝脏负担增加、胃肠道问题等。
合理控制异亮氨酸的摄入量十分重要。
第二篇示例:异亮氨酸,又称“亮氨酸异构体”,是一种氨基酸的异构体,其分子式为C6H13NO2,分子量为131.17。
它是一种非极性氨基酸,在生物体内起着重要的生物学功能。
异亮氨酸在蛋白质合成中起着关键的作用,同时也参与了体内多种生化反应的调节。
本文将详细介绍异亮氨酸的结构、性质、生物学功能等方面的知识。
异亮氨酸的结构非常特殊,它的分子式是C6H13NO2,由一个异戊二碳环底脱氨化而来。
与正常的亮氨酸相比,异亮氨酸的侧链多了一个甲基基团,因此它是亮氨酸的立体异构体。
这个甲基基团使异亮氨酸在生物体内的空间构象上与亮氨酸不同,因而具有不同的生物学活性。
牛血清白蛋白元素组成

4. 苏氨酸(Threonine):C4H9NO3
5. 丙氨酸(Alanine):C3H7NO2
6. 酪氨酸(Tyrosine):C9H11NO3
7. 苯丙氨酸(Phenylalanine):C9H11NO2
8. 甘氨酸(Glycine):C2H5NO2
9. 天冬氨酸(Aspartic acid):C4H7NO4
10. 谷氨酸(Glutamic acid):C5H9NO4
11. 亮氨酸(Leucine):C6H13NO2
12. 丝氨酸(Serine):C3H7NO3
13. 苏氨酸(Methionine):C5H11NO2S
这些氨基酸组合在一起形成牛血清白蛋白的蛋白质结构,而这些氨基酸中的原子元素如碳、氢、氧、氮和硫,则决定了整个牛血清白蛋白的元素组成。
牛血清白蛋白是一种主要存在于牛血液中的蛋白质,其元素组成主要包括碳(C)、氢(H)、氧(O)、氮(N)和硫(S)。具体来说,牛血清白蛋白可通过氨基酸序列来分析其元素组成,以下是一些常见的氨基酸及其元素组成:
1. 赖氨ine):C5H11NO2
氨基酸之亮氨酸

生理限量:
占食品中总蛋白质量的6.4%。
可安全用于食品。
生理功能
作为氨基酸输液及综合氨基酸制剂。 用于幼儿特发性高血糖的诊断和治疗。 并适用于糖代谢失调、伴有胆汁分泌减少的肝病、贫血、中毒、肌萎缩症、脊髓灰质炎后遗症、神经炎及精神 病。
生理功能
由于它很容易转化为葡萄糖,因此亮氨酸有助于调节血糖水平。
滤液用碱液调至pH3.3, 不断搅拌, 并加少量谷氨酸作品种, 待谷氨酸析出结晶, 抽滤得谷氨酸粗品, 精制后得成品。
酸溶沉淀:将上步的合并滤饼(氯化钠和亮氨酸混合结晶), 加入3mol/L的盐酸溶液7.5L, 加热搅拌, 70℃-80℃保温0.5h, 抽滤除去氯化钠结晶, 滤液为亮氨酸盐酸盐溶液, 体积大约为13L, 然后按其体积的10%往滤液中加入邻二甲苯-4-磺酸, 使完全形成亮氨酸磺酸盐析出, 过滤取滤饼, 滤液按同样方式操作, 使滤液加入邻二甲苯-4-磺酸后再无沉淀析出为止。
选育细胞膜通透性突变株,使目的产物分泌到细胞外,使细胞内终产物的浓度达不到引起反馈调节的浓度;
应用基因工程、代谢工程的手段有目的改造微生物菌株,使其高浓度合成目的产物。
生产方法-酶催化法
生产方法-微生物发酵法
浓缩段→一次中和段→氨解段→脱色段→二次中和段→精制段
微生物发酵法是高效、环保、节能、易于控制的方法。在工业生产时,微生物发酵法分为六个步骤:
氨基酸之亮氨酸
名称
中文学名:亮氨酸、白氨酸 化学结构名称:α-氨基-γ-甲基戊酸、α-氨基异己酸 英文名:Leucine 英文简写:L、Leu
分子式
化学式:C6H13NO2 分子式:(CH3)2CHCH2CH(NH2)COOH 相对分子量:131.18
物化性质
液相色谱-串联质谱法测定徽州毛豆腐中18种氨基酸

分析检测液相色谱-串联质谱法测定徽州毛豆腐中18种氨基酸郝玉玲1,盛新颖1*,武文文1,徐雅芫2,程江华2,张 雷3(1.安徽科博产品检测研究院有限公司,安徽合肥 230001;2.安徽省农业科学院农产品加工研究所,安徽合肥 230031;3.安徽省食品药品检验研究院,安徽合肥 230021)摘 要:本文建立了徽州毛豆腐中18种氨基酸快速检测的方法,样品以沸水浸提,以液相色谱-串联质谱法测定。
结果显示,该方法在9 min内可完成所有氨基酸的分离,检出限为2.44~6.36 μg·kg-1,定量限为8.05~20.99 μg·kg-1,加标回收率在83.60%~101.20%,相对标准偏差在0.27%~2.61%。
该方法具有分析速度快、重复性好等优点。
关键词:氨基酸;液相色谱-串联质谱;徽州毛豆腐Determination of 18 Amino Acids in Huizhou Maotofu byLiquid Chromatography Tandem Mass SpectrometryHAO Yuling1, SHENG Xinying1*, WU Wenwen1, XU Yayuan2, CHENG Jianghua2, ZHANG Lei3(1.Anhui Kebo Product Testing and Research Institute Co., Ltd., Hefei 230001, China; 2.Institute of Agricultural Products Processing, Anhui Academy of Agricultural Sciences, Hefei 230031, China; 3.Anhui Institute of Food andDrug Inspection, Hefei 230021, China)Abstract: This article establishes a rapid detection method for 18 amino acids in Huizhou Maotofu. The samples are extracted with boiling water and determined by liquid chromatography tandem mass spectrometry. The results showed that the method could complete the separation of all amino acids within 9 minutes, with a detection limit of 2.44~6.36 μg·kg-1, a quantification limit of 8.05~20.99 μg·kg-1, an spiked recovery rate of 83.60%~101.20%, and a relative standard deviation of 0.27%~2.61%. This method has the advantages of fast analysis speed and good repeatability.Keywords: amino acids; liquid chromatography tandem mass spectrometry; Huizhou Maotofu徽州毛豆腐因其长毛和口感独特等特征,成为我国著名的素食佳肴。
巧记20种氨基酸缩写(3篇)

第1篇1. 甘氨酸(Gly)- Glycine甘氨酸是蛋白质中最简单的氨基酸,只有一个碳原子。
它在蛋白质的三级结构中起着重要作用。
2. 脯氨酸(Pro)- Proline脯氨酸是一个环状氨基酸,由于其独特的结构,它对蛋白质的折叠和稳定性有重要影响。
3. 谷氨酸(Glu)- Glutamic acid谷氨酸是一种酸性氨基酸,它在蛋白质的酸性基团中起重要作用。
4. 丙氨酸(Ala)- Alanine丙氨酸是一种非极性、非极性的氨基酸,它在蛋白质中常见。
5. 异亮氨酸(Ile)- Isoleucine异亮氨酸是一种疏水性氨基酸,它在蛋白质的疏水区域中起作用。
6. 亮氨酸(Leu)- Leucine亮氨酸是一种疏水性氨基酸,它是构成肌肉蛋白质的主要成分。
7. 酪氨酸( Tyr)- Tyrosine酪氨酸是一种含有酚羟基的氨基酸,它在蛋白质的信号传导和色素形成中起作用。
8. 苯丙氨酸(Phe)- Phenylalanine苯丙氨酸是一种芳香族氨基酸,它在蛋白质的结构和功能中起重要作用。
9. 丝氨酸(Ser)- Serine丝氨酸是一种极性氨基酸,它含有羟基,在蛋白质的三级结构中起作用。
10. 苏氨酸(Thr)- Threonine苏氨酸是一种极性氨基酸,它含有羟基,在蛋白质的折叠和功能中起作用。
11. 色氨酸(Trp)- Tryptophan色氨酸是一种芳香族氨基酸,它在蛋白质的折叠和功能中起作用,并且是人体必需氨基酸。
12. 缬氨酸(Val)- Valine缬氨酸是一种疏水性氨基酸,它是构成肌肉蛋白质的主要成分。
13. 组氨酸(His)- Histidine组氨酸是一种碱性氨基酸,它在蛋白质的酸碱平衡和代谢中起作用。
14. 赖氨酸(Lys)- Lysine赖氨酸是一种碱性氨基酸,它是构成肌肉蛋白质的主要成分。
15. 精氨酸(Arg)- Arginine精氨酸是一种碱性氨基酸,它在蛋白质的酸碱平衡和信号传导中起作用。
异亮氨酸

鉴别 检查
类别 含量测定
贮藏
本品为L-2-氨基-3-甲基戊酸,按干燥品计算,含C6H13NO2得少于98.5%。
本品为白色结晶或结晶性粉末,无臭。 本品在水中略溶,在乙醇或乙醚中几乎不溶。 比旋度 取本品,精密称定,加6mol/L盐酸溶液溶解并定量稀释制成每1mL中约含40mg的溶液,依法测定(通则 0621),比旋度为+38.9°至+41.8°。
1、取本品与异亮氨酸对照品各适量,分别加水溶解并稀释制成每1ml中约含0.4mg的溶液,作为供试品溶液 与对照品溶液。照其他氨基酸项下的色谱条件试验,供试品溶液所显主斑点的位置和颜色应与对照品溶液的主斑 点相同。
2、本品的红外光吸收图谱应与对照的图谱(光谱集 894图)一致。
酸度 取本品0.20g,加水20mL溶解后,依法测定(通则0631),pH值应为5.5~6.5。 溶液的透光率 取本品0.5g,加水20mL溶解后,照紫外-可见分光光度法(通则0401),在430nm的波长处测定透光率,不 得低于98.0%。 氯化物 取本品0.25g,依法检查(通则0801),与标准氯化钠溶液5.0mL制成的对照液比较,不得更浓(0.02%)。 硫酸盐 取本品1.0g,依法检查(通则0802),与标准硫酸钾溶液2.0mL制成的对照液比较,不得更浓(0.02%)。 铵盐 取本品0.10g,依法检查(通则0808),与标准氯化铵溶液2.0mL成的对照液比较,不得更深(0.02%)。
由于它很容易转化为葡萄糖,因此异亮氨酸有助于调节血糖水平。异亮氨酸缺乏的人会出现类似低血糖的症 状,如头痛,头晕,疲劳,抑郁,精神错乱,和易怒等。
异亮氨酸最好的食物来源包括糙米,豆类,肉类,坚果,大豆粉,和全麦。由于它是一种必不可少的氨基酸, 这意味着身体不能自己生产,只能通过饮食获得。从事高强度体力活动和低蛋白质饮食的人,应该考虑采取白氨 酸补充。尽管有独立补充形式,但是最好还是与异亮氨酸和缬氨酸一起摄入。因此,选择混合型补充剂更为方便。
组成蛋白质的21种氨基酸

组成蛋白质的21种氨基酸蛋白质是由氨基酸通过肽键连接而成的大分子。
在自然界中,有20种标准氨基酸构成了绝大多数蛋白质,这些氨基酸是:1.丙氨酸(Alanine, Ala, A)2.精氨酸(Arginine, Arg, R)3.天冬氨酸(Aspartic acid, Asp, D)4.天冬酰胺(Asparagine, Asn, N)5.半胱氨酸(Cysteine, Cys, C)6.谷氨酸(Glutamic acid, Glu, E)7.谷氨酰胺(Glutamine, Gln, Q)8.甘氨酸(Glycine, Gly, G)9.组氨酸(Histidine, His, H)10.异亮氨酸(Isoleucine, Ile, I)11.亮氨酸(Leucine, Leu, L)12.赖氨酸(Lysine, Lys, K)13.甲硫氨酸(Methionine, Met, M)14.苯丙氨酸(Phenylalanine, Phe, F)15.脯氨酸(Proline, Pro, P)16.丝氨酸(Serine, Ser, S)17.胸腺嘧啶核苷酸(Threonine, Thr, T)18.色氨酸(Tryptophan, Trp, W)19.酪氨酸(Tyrosine, Tyr, Y)20.缬氨酸(Valine, Val, V)除了这20种标准氨基酸外,还有一种特殊的氨基酸被遗传密码指定插入到某些蛋白质中,那就是:21.角氨酸(Selenocysteine, Sec, U)角氨酸被认为是第21种“标准”氨基酸,虽然它并不是由标准的遗传密码直接编码的,而是通过一个特殊的机制在RNA水平上进行插入。
角氨酸含有一个罕见的硒原子,使其在生物化学过程中具有独特的性质。
有时候,还会提到第22种氨基酸:22.吡咯赖氨酸(Pyrrolysine, Pyl, O)吡咯赖氨酸在所有生物体中都非常罕见,仅在一些甲烷产生微生物和某些古细菌中的特定蛋白中发现。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十三章异亮氨酸、亮氨酸与缬氨酸发酵第一节分支链氨基酸的生物合成途径和代谢调节机制在L型异亮氨酸(Ile)、亮氨酸(Leu)和缬氨酸(Val)的分子中,都具有由甲基侧链形成的分枝结构(见表13-1),故称上述三种氨基酸为分枝链氨基酸(branched chain amino acids)。
分枝链氨基酸是合成蛋白质的素材,可以作为生物体的能源,也作为生物体成分的前体。
但是,高等动物不能合成这三种氨基酸,故Ile、Leu、Val称为必需氨基酸。
目前,分枝链氨基酸主要用作氨基酸输液的原料。
表13-1 分枝链氨基酸的结构名称结构式分子式分子量异亮氨酸(Ile)C6H13O2N 131.18亮氨酸(Leu)C6H13O2N 131.18缬氨酸(Val)C5H11O2N 117.15Ile分子内有两个不对称碳原子,因而,Ile存在着D、L、D别、L别四种光异构体(表13-2)。
很难用化学合成法,或用化学合成法与酶法相组合的方法,廉价制造纯度高的L型Ile。
Leu与Val分别只有两个光学异构体,能够用化工合成、酶法分割的方法,较廉价地制造。
要廉价生产高纯度的L型Ile,只有采用发酵法,因此,Ile发酵就成了分枝链氨基酸发酵的中心问题。
然而,从自然界中,只找到了分泌Leu或Val的菌株,却找不到分泌Ile的菌株。
直到20世纪60年代后半期,随着氨基酸生物合成系反馈调节机制的全部搞清,可以通过选育目的氨基酸代谢拮抗物抗性株的方法,从遗传上解除原菌株的反馈调节机制,从而可以利用这种抗性菌株,由糖直接发酵生产Ile(Leu或Val)。
表13-2 Ile的四种光学异构体L-Ile D-Ile D-别Ile L-别Ile 1960年,经过用粗糙链孢霉、大肠杆菌的营养缺陷型突变株,及用放射性同位素标记的前体,进行研究的结果,确定了Ile、Leu及Val的生物合成途径(图13-1)。
出于V aI和Leu的所有碳原子,都来自于丙酮酸,所以,V al及Leu亦称丙酮酸族氨基酸。
Ile的六个碳原子中的四个碳原子来自于ASP,所以,Ile与Thr、Lys、Met一起,亦称作ASP族氨甚酸。
Umbarger等研究的结果,清楚地说明,不仅L-Thr是Ile的前体,D-Thr及α-氨基丁酸也是Ile的前体。
并且指明,由D-Thr等物质生成α-酮基丁酸的酶,不受反馈抑制。
因此,可以用D-Thr或α-氨基丁酸发酵制造Ile。
分支链氨基酸的生物合成途径如图13-1所示。
图13-1 分支链氨酸生物合成途径及其调节机制由图13-1可以看出,异亮氨酸、亮氨酸和缬氨酸这3种分支链氨基酸是从苏氨酸、丙酮酸经过若干步酶促反应而合成的。
可以看出,L-苏氨酸是异亮氨酸的直接前体,丙酮酸是缬氨酸的直接前体,由缬氨酸合成途径的中间体α-乙酰异戊酸分支合成亮氨酸。
在合成异亮氨酸、缬氨酸的途径中,有4步反应的酶是共用的,即乙酰乳酸合成酶、乙酰乳酸异构还原酶、二羟基脱水酶及分支链氨基酸转氨酶。
它们分别催化异亮氨酸及缬氨酸生物合成途径中互相对应的反应。
例如,乙酰乳酸合成酶既催化异亮氨酸合成途径中由α-酮丁酸生成,α-乙酰-α-羟基丁酸的反应,又催化缬氨酸合成途径中由活性乙醛和丙酮酸生成α-乙酰乳酸的反应。
此外,分支链氨基酸转氨酶不仅能催化异亮氨酸和缬氨酸的合成,而且也能催化亮氨酸的合成,也就是说,异亮氨酸、缬氨酸和亮氨酸生物合成途径中的最后一步转氨基反应,都是由同一种转氨酶催化完成的。
二、代谢调节机制研究表明,在粘质赛氏杆菌中,分支链氨基酸生物合成的代谢调节机制如图13-2所示。
图13-2 粘质赛氏杆菌中分支链氨基酸生物合成的调节机制由图13-2可以看出,Ile合成中的第一个限速酶是L-Thr脱氨基酶,第二个限速酶则是乙酰羟基酸合成酶。
Va1合成中的限速酶是乙酰基酸合成酶,也就是Ile合成中的第二个限速酶。
Leu合成中的限速酶是α-异丙基苹果酸合成酶。
限速酶的不同,就意味着目的产物合成所受的代谢调节不同。
然而,随着微生物种类的不同,限速酶的调节因子也不同,就现有的研究情况来说,粘质赛氏杆菌的代谢情况了解得较为全面,这种细菌的分枝链氨基酸合成的代谢调节方式,跟大肠杆菌相类似。
其他菌种的代谢调节方式只是部分地了解。
分支链氨基酸生物合成的代谢调节机制如下。
(1)苏氛酸脱氨酶受异亮氨酸的反馈抑制。
(2)α-乙酰乳酸合成酶受缬氨酸的反馈抑制。
(3)α-异丙基苹果酸合成酶受亮氨酸的反馈抑制。
(4)分支链氨基酸合成酶系的各个酶的生成,受这3种末端氨基酸——异亮氨酸+缬氨酸+亮氨酸的多价阻遏。
编码3个分支链氨基酸合成酶系的基因组成两个主要的操纵子:ilv(左)和1eu(右)操纵子(图13-3 )。
位于图距85min的ilv GEDACB操纵子中,DACB基因编码异亮氨酸、缬氨酸2个途径共用的4个多功能酶:基因C和D编码乙酰乳酸异构还原酶的亚基和二羟基脱水酶。
基因B、G和E则分别编码乙酰乳酸合成酶亚基Ⅰ、Ⅱ和缬氨酸转氨酶。
基因A编码苏氨酸脱氨酶。
它们的控制区也分别处在B与C、C与A和E与G基因之间。
亮氨酸合成途径酶系由leu操纵子编码:基因A编码异丙基苹果酸合成酶,基因D、C编码α-异丙基苹果酸异构酶,基因B编码β-异丙基苹果酸脱氢酶。
leuDCBA操纵子被靠近结构基因A的调节区所控制。
处于图距2min的ilvH、I操纵于编码同功酶乙酰乳酸合成酶亚基Ⅲ。
图13-3 大肠杆菌leu(右)ilv(左)操纵子的组织结构在ilv GEDACB操纵子中,转录时GEDA产生一条mRNA,而C和B则不和它一起转录。
编码Ⅲ型合成酶的结构基因ilv H、I则位于2min处,但都受该途径终产物的阻遏。
此外,所有的结构基因产物都可能受到多价阻遏,但是,无论是用遗传的方法还是生化的方法都未能鉴定出阻遏物,所以目前认为ilv和leu操纵子表达的控制可能主要通过衰减机制。
1eu操纵子控制区的全部核苷酸序列已经测出。
经分析发现,Pribnow box居于前导转录物起始转录位点之前,此前导转录物具有编码28个氨基酸残基的能力。
其上含有的4个连续的leu密码子,无疑也是在翻译水平上起调节作用的、除非亮氨酰-tRNA leu与翻译的核搪体处在这点(指4个leu密码子处)上空转时被隔离开来。
如此,转录便向前,一组基因开始表达。
另外,还含有3个异亮氨酸和3个缬氨酸密码子,显示着前导肽上这些氨基酸的有效性可能影响1eu操纵子的表达。
1eu前导转录物除含有能够产生前空白子(A—A)、终止子(B—B)和保护子(D—D)的二级结构外,还存在一种能阻止前空白于形成并且引起操纵子衰减的附加序列(additionalsequence)D—D。
由于D—D首先形成,此操纵子将会总是处于衰减状态,除非核糖体在那里破坏D—D配对,并且A—A也不配对。
运转的核糖体需要精确的密码排列,如果只在leu密码子处发生空转,那么在加个ilv-val第一个双密码子处空转的核糖体不能使操纵子去阻遏,而且在第二个ilv-val双密码子处空转的核糖体也都不能去阻退,因为它阻止了前空白子(A—A)的形成。
这就对多价阻遏产生了某些怀疑,实际上,这很可能就是多价衰减。
ilv操纵子表达的程度好像取决于一个以上核糖体沿前导RNA的移动速率,而亮氨酰、缬氨酰和异亮氨酰-tRNA的有效性决定着这种移动速率。
核糖体的移动将促进前导转录物结构上发生动力学的变化,显示着可能引起终止子茎环结构的形成。
当所有氨酰-tRNA都存在时,核糖体沿前导肽平滑地移动,直到它遇上隐藏终止密码的碱基配对形成茎环结构Z —Z为止。
这种终止便给出了足够的时间形成终止子,以致发生衰减作用。
第二节异亮氨酸发酵1901年,Fischer在由蛋白水解液分离的亮氨酸组分中发现了旋光度较亮氨酸更大的物质,此为有关L-异亮氨酸的最早报道。
L-异亮氨酸(L-Isoleucine),化学名为β-甲基-α-氨基戊酸。
由于在α位和β位具有两个不对称碳原子,因而存在D、L、D别、L别四种旋光异构体,但自然界中存在的异亮氨酸为L-异亮氨酸,其余三种均无营养价值。
由于存在四种旋光异构体,因此很难采用化学合成法或化学合成与酶法相结合的方法,廉价制造高纯度L-异亮氨酸,只有采用发酵法。
然而,自然界中只找到了分泌L-亮氨酸和L-缬氨酸的菌株,却未发现分泌L-异亮氨酸的菌株。
直到20世纪60年代后半期,随着氨基酸生物合成体系反馈调节机制的全部搞清,才人工选育出L-异亮氨酸产生菌。
一、L-异亮氨酸生产方法L-异亮氨酸生产方法有提取法、化学合成法和发酵法三类,但目前在工业生产上实施的主要是发酵法。
由于化学合成法生产的L-异亮氨酸与其它异构体分离困难,因而未能实现工业化生产。
发酵法就是利用微生物的代谢作用,生物合成并过量积累L-异亮氨酸,包括添加前体物发酵法和直接发酵法两类。
1添加前体物发酵法又称微生物转化法。
这种方法使用葡萄糖作为发酵碳源、能源,再添加特异的前体物质即在氨基酸生物合成途径中的一些合适中间代谢产物,以避免氨基酸生物合成途径中的反馈调节作用,经微生物作用将其有效转化为目的氨基酸。
图13-4 L-异亮氨酸合成前体由于其前体物质稀少或价格昂贵,目前已很少采用此法生产L-异亮氨酸。
2直接发酵法直接发酵法是借助于微生物具有合成自身所需氨基酸的能力,通过对特定微生物的诱变处理,选育出营养缺陷型及氨基酸结构类似物抗性突变株,以解除代谢调节中的反馈抑制和反馈阻遏,从而达到过量积累某种氨基酸的目的。
目前,异亮氨酸产生菌大多由谷氨酸产生菌黄色短杆菌(Brevibacterium flavum)、谷氨酸棒杆菌(Corynebacterium glutamicum)、乳糖发酵短杆菌(Brevibacterium Lactofermentas)诱变选育而来。
二、L-异亮氨酸生产概况目前国际上日本生产L-异亮氨酸占有垄断地位,厂家有味之素、协和发酵和田边制药三家,均以发酵法生产,产酸率达30~35g/L,提取率60~70%。
目前全世界合计年产量400~500吨。
鉴于L-异亮氨酸生产的高难度,L-异亮氨酸一直是高价氨基酸。
我国的L-异亮氨酸发酵研究始于20世纪70年代,90年代初正式工业化生产。
目前,传统一次投糖分批发酵大罐产酸率为20~22g/L,总得率为40~50%。
与日本相比较,我国的L-异亮氨酸生产水平还较低(如表13-3所示)。
表13-3 我国与日本L-异亮氨酸发酵技术指标的比较生产技术指标日本中国产酸率(g/L) 30~35 20~25对糖转化率(%) 20~25 13~15提取收率(%) 60~75 60三、L-异亮氨酸产生菌育种策略及实例(一)L-异亮氨酸产生菌常规育种策略根据L-异亮氨酸生物合成途径及代谢调节机制(如图13-1和图13-2所示),L-异亮氨酸高产菌应具备以下生化特征:1. CO2固定反应能力强;2.天冬氨酸合成酶能力强;3.天冬氨酸激酶活力强;4.高丝氨酸脱氢酶活力强;5.苏氨酸脱氨酶活力强;6.乙酰羟基酸合成酶活力强;7.二氢吡啶-2,6-二羧酸合成酶活力微弱或丧失;8.琥珀酰高丝氨酸转琥珀酰酶活力微弱或丧失;9.谷氨酸脱氢酶活力弱。
