常用实验动物生理指标
动物实验技术2常用实验动物兔、犬、猴

体
爱美尔球虫 Eimaria spp.
动
卡氏肺孢子虫 Pneumocystis carinii
物
全部蠕虫 All Helminths
动物种类 豚鼠 地鼠 兔
● ●● ● ●●
○
○
○○
●
● ●●
鞭毛虫 Flagellates 纤毛虫 Ciliates
●●● ●
无任何可检测到的寄生虫
注:●必须检测项目,要求阴性;○必要时检测项目,要求阴性。
家兔颈部有减压神经独立分支。颈部神经血管束中 有三根粗细不同的神经,最粗白色为迷走神经,较 细灰白色为交感神经,最细为减压神经。
正常体温39,5℃,体温变化灵敏。
5、感觉器官
耳廓大,表皮很薄,血管清晰,便于血管注射和 采血。
家兔眼球巨大,是眼科研究中最常用的动物。虹 膜内色素细胞决定眼睛的颜色,白色兔眼睛的虹 膜缺乏色素,眼内由于血管内血色透露,所以看 起来是红色。
种公兔编号等)。
注意事项 1、有疾病种兔如阴部炎、脚癣、乳房炎不得交
配。 2、交配前提前2小时喂食,不要过饱,交配时要
将笼中食具拿走,将母兔轻轻放入公兔笼中。 3、配种季节和时间:冬春两季在中午前后,夏秋
物
Disease Virus (RHDV)
●● ●
仙台病毒 Sendai Virus (SV)
小鼠肺炎病毒 Pneumonia Virus of Mice
●
(PVM)
●
呼肠孤病毒Ⅲ型 Reovirus type Ⅲ (Reo-3)
轮状病毒Rotavirus (RRV)
● ● ●
●
无任何可查到的病毒
● ●●
原
物 小肠结肠炎耶尔森菌 Yesinia enterocolitica
家兔实验实训报告

一、实验目的1. 了解家兔的基本生物学特性。
2. 掌握家兔实验操作的基本技能,包括麻醉、固定、给药、采样等。
3. 通过实验,观察家兔在不同生理条件下的反应,加深对生理学知识的理解。
二、实验时间2023年10月15日至2023年10月18日三、实验地点XX大学动物实验中心四、实验对象家兔(新西兰白兔)3只,体重2.5kg左右五、实验用品1. 实验动物:家兔3只2. 实验器材:手术器械、麻醉机、呼吸机、血压计、心电图机、显微镜、培养皿、试剂等3. 实验试剂:生理盐水、葡萄糖、乳酸、碳酸氢钠等六、实验方法1. 麻醉与固定:采用吸入麻醉法,使用异氟醚诱导麻醉,待家兔失去意识后,进行固定,确保实验过程中动物安全。
2. 生理指标监测:通过血压计、心电图机等设备,监测家兔的血压、心率、呼吸频率等生理指标。
3. 给药实验:按照实验设计,给予家兔不同的药物,观察其生理反应。
4. 组织采样:在实验过程中,对家兔的心脏、肝脏、肾脏等组织进行采样,进行病理学检查。
七、实验步骤1. 麻醉与固定:将家兔放入麻醉箱内,调整异氟醚浓度,待家兔失去意识后,将其固定在手术台上。
2. 生理指标监测:连接血压计、心电图机等设备,监测家兔的血压、心率、呼吸频率等生理指标。
3. 给药实验:a. 将家兔随机分为三组,每组1只。
b. 第一组:给予生理盐水作为对照。
c. 第二组:给予葡萄糖溶液,观察家兔的生理反应。
d. 第三组:给予乳酸溶液,观察家兔的生理反应。
4. 组织采样:在实验结束后,对家兔的心脏、肝脏、肾脏等组织进行采样,进行病理学检查。
八、实验结果1. 生理指标:在实验过程中,家兔的血压、心率、呼吸频率等生理指标均保持稳定。
2. 给药实验:a. 对照组:生理盐水组家兔生理指标稳定。
b. 葡萄糖组:家兔血糖升高,呼吸加快,心率增快。
c. 乳酸组:家兔血糖降低,呼吸减慢,心率减慢。
3. 组织采样:病理学检查结果显示,三组家兔的心脏、肝脏、肾脏等组织无明显异常。
常用实验动物生理指标

常用实验动物生理指标
1.活动指标
一、体动性指标:
1)移动距离:从动物发出的体动性响应到相应信号的静止状态所消
耗的距离,反映动物的移动能力。
2)行为活动:主要指日常行为,例如动物食物、测试环境、休息等,反映动物的行为活动能力。
二、生长指标:
1)体重变化:以RGR(relative growth rate)表示,表示动物体
重增加的速度。
2)骨骼肌重量:骨骼肌重量是体重的有用部分,反映动物的骨骼肌
发育水平。
三、营养指标:
1)蛋白质利用率:表示动物代谢和吸收蛋白质的能力。
2)脂肪吸收:指动物体内对脂肪的吸收和代谢能力。
四、新陈代谢指标:
1)肝脏功能:主要是采用检测血清乳酸脱氢酶(LDH)等生化指标。
2)肾脏功能:一般衡量方法是检测血中肌酐浓度(Serum creatinine)。
五、免疫指标:
1)免疫细胞数目:免疫细胞包括淋巴细胞,用以检测动物的免疫能力。
2)血清IgG水平:血清IgG水平是一种检测动物抗菌性的指标,反映动物免疫力水平。
六、器官功能指标:
1)心肌指标:心肌指标包括心肌收缩力强度(ECG)、心肌厚度和心肌收缩指标(Cardiac Markers)等,表示动物心肌功能
2)肺功能指标:肺功能指标以呼吸音。
血压动物生理学实验

家兔动脉血压系列实验家兔动脉血压系列实验I. 家兔动脉血压测定及神经、体液调节。
II. 家兔减压神经放电。
1.掌握学习动脉插管直接测量和记录动脉血压的实验方法;2.了解减压神经放电的引导记录方法;3.观察某些神经和体液因素对动脉血压的调节;4.观察减压神经传入冲动的发放特征,进一步认识动脉血;5.压变动与减压神经传入冲动发放的相互关系。
动脉血压的动态平衡和相对稳定性是通过神经和体液因素的调节而实现的;参与支配心脏活动的神经主要有心交感神经和心迷走神经,支配血管的神经有缩血管神经和舒血管神经。
在神经调节中以颈动脉窦-主动脉弓的减压反射尤为重要。
支配血管的交感缩血管神经兴奋时,使血管收缩、外周阻力增加,动脉血压升高。
体液因素主要为肾上腺素和去甲肾上腺素。
它们的作用主要是调节心脏的心输出量、外周阻力等。
心脏的神经支配--心交感神经其节前神经纤维发自脊髓的第1~5胸段的中间外侧柱,节后神经元位于星状神经节或颈交感神经节内。
节后神经元的轴突形成心脏神经丛,分布在心脏的窦房结、房室交界、房室束、心房肌和心室肌等处。
心交感节后神经元末梢释放的去甲肾上腺素与心肌细胞膜上的β-肾上腺素受体结合,通过增加自律细胞和心室肌细胞钙内流,导致心率加快,房室交界的传导加快,心房肌和心室肌的收缩能力加强(正性变时、变力、变传导作用)。
心脏的神经支配--心迷走神经节前神经元的胞体位于延髓的迷走神经背核和疑核,在胸腔内与心交感神经一起组成心脏神经丛,相伴行进入心脏,与心内神经节细胞发生突触联系;节后神经纤维支配心脏的窦房结、房室交界、心房肌、房室束及其分支;心迷走神经节后纤维末梢释放神经递质乙酰胆碱,作用于心肌细胞膜的M型胆碱受体,通过抑制钙内流和自律细胞的内向电流,导致心率减慢,心房肌不应期缩短,房室传导速度减慢,心房肌收缩能力减弱(负性变时、变力、变传导作用);血管的神经支配与生理作用交感缩血管神经交感舒血管神经副交感舒血管神经中枢延髓的缩血管中枢(T1-L2-3侧角) 皮质运动区脑干副交感核S2-3外侧核链递质去甲肾上腺素乙酰胆碱乙酰胆碱分布绝大多数血管多为单一支配)骨骼肌血管软脑膜、消化腺、外生殖器血管作用α受体→血管缩β受体→血管舒血管舒张血管舒张特点①调节血压作用大②持续发放紧张性冲动紧张性↑→血管缩紧张性↓→血管舒①不参与血压调②平时无作用③与情绪、运动有关①不参与血压调节②参与调节局部血流效应器(心、血管)心血管中枢(延髓)感受器(颈动脉窦和主动脉弓)交感缩血管神经心交感神经心迷走神经迷走神经窦神经心血管活动的神经调节血压升高时,可引起压力感受性反射,其反射效应是使心率减慢,外周血管阻力降低,血压回降,这一反射也称为减压反射;减压反射是一种负反馈调节机制。
常用实验动物的生物学特点及应用(共99张PPT)

四、饲养管理
(一)环境
小鼠对环境变化敏感,自动调节体温的能力较差,过冷 过热易诱发疾病。
(二)笼具和垫料 一般采用无毒塑料制成的透明或半透明的鼠盒,不锈钢丝制 的笼盖,饮水器为玻璃瓶或塑料瓶。
垫料应有强吸湿性、无毒、无刺激气味,无粉尘,不可食
(三)饲料及饮水
• 应喂全价饲料,并保持饲料相对稳定。
4叶:左叶、右叶、中叶、尾叶 ②肝脏分 ③在阴道口形成的阴道栓碎裂成3~5块
恒河猴、食蟹猴、熊猴(阿萨密猴,蓉猴);
由于犬可以通过短期训练能够配合实验,所以适合于进行慢性实验,如条件反射实验、各种实验治疗效果实验、毒理学实验、内分泌腺摘除实验
等可。用于③脑功脾能,脏血液有循环贮、血血型、、呼吸造生理血、内功分泌能、 ,与其他动物不同
(2)C3H/He(C3):野生色。 乳腺癌发病率为97%,对致肝癌因素敏感,对狂犬病病毒敏
感,对炭疽杆菌有抗力。用于肿瘤学、生理学、核医学、免疫 学的研究。国际使用最广泛的品系
(3)BALB/c(C):白化。
乳腺肿瘤发生率低,但对致癌因子敏感。肺癌发病率雌 性26%,雄性29%。对放射性照射极为敏感。广泛应用于 肿瘤学、生理学、免疫学、核医学和单克隆抗体等研究中 。
③神经递质等活性物质的释放
⑥雌鼠乳腺发达5 3对位于胸部, 对, 幼鼠主要从外生殖器与肛门的距离判断,近者为雌性,远者为雄性.
(三)肿瘤学、白血病研究
2对位于腹部
栖居于树木和岩石坡面,群居性强,活动范围较固定
⑦小鼠无汗腺,靠尾部散热 断尾猴、台湾岩猴、平顶猴(猪尾猴)。
④评价药物对肾功能的影响及药物副作用的研究。
②性周期短,繁殖力强
发情周期4~5d,发情后2~3h可排卵;
健康动物生理指标参考值
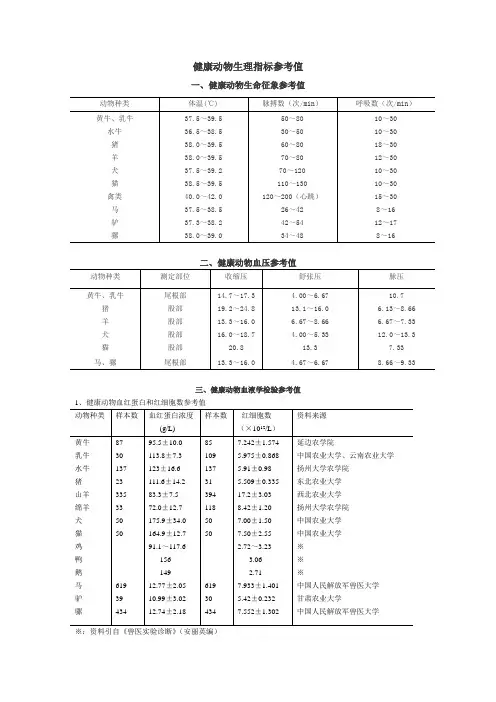
健康动物生理指标参考值一、健康动物生命征象参考值二、健康动物血压参考值三、健康动物血液学检验参考值1、健康动物血红蛋白和红细胞数参考值※:资料引自《兽医实验诊断》(安丽英编)2.健康动物红细胞指数参数值3.健康动物白细胞数参考值※:资料引自《兽医实验诊断》(安丽英编)4.健康动物白细胞分类平均值参考值(%)※:资料引自《兽医实验诊断》(安丽英编)5.健康动物血小板数参考值6.健康动物红细胞压积参考值7.健康动物血沉参考值8.健康动物血液生化检验参考值(引自Radostits O M, et al. 2005. Veterinary Medicine. 9th Edition;Morgan r h.2007.Handbook of Small Animal practice.5th Edition)总胆红素 μmol/L 0.17~8.55 0~1.71 0~17.10 7.10~35.00 2~17 2~17 直接胆红素 μmol/L 0.70~7.54 0~5.13 0~6.8 0~20~2 间接胆红素 μmol/L 0.51 0~5.13 3.42~34.2 0.17~8.38 胆酸 μmol/L <120 <25 ~10~20 <10<5 ~ 胆固醇 mmol/L 1.0~5.6 1.05~1.50 3.05~3.10 1.20~4.60 2.5~5.9 2.1~5.1 ~ 血糖mmol/L2.49~4.162.77~4.444.71~8.324.16~6.38 3.9~6.13.9~8.08.4~10.1总蛋白 g/L 57~81 64.0~70.0 35~60 60~7750~71 50~80 40.0~54.7白蛋白 g/L 21~36 27.0~39.0 19~24 29~38 28~40 23~35 15.3~22.4 球蛋白g/L30.0~34.827.0~41.052.9~64.326.2~40.427.0~44.026.0~51.021.3~35.3A/G g/g0.84~0.940.63~1.26 0.37~0.51 0.62~1.460.59~1.11 0.45~1.19 0.43~1.05α球蛋白 g/L7.5~8.85.0~7.0β球蛋白 g/L 8.0~11.2γ球蛋白g/L16.9~22.59.0~30.022.4~24.65.5~19.0α1球蛋白g/L3.2~4.40.60~0.70 2.0~5.02.0~11.0α2球蛋白g/L12.8~15.43.10~13.103.0~11.04.0~9.0β1球蛋白g/L7.0~12.01.3~3.34.0~15.8 7.0~13.03.0~9.0β2球蛋白g/L3.0~6.012.6~16.82.9~8.96.0~14.06.0~10.0γ1球蛋白g/L5.0~13.03.0~25.0γ2球蛋白g/L4.0~9.014.0~19.0纤维蛋白原μmol/L8.82~20.62.94~11.82.94~14.72.94~11.85.88~11.81.47~8. 82甘油三酯mmol/L 0.56 0.56T4 nmol/L 54~110 12~36 20~52 15~58T3 nmol/L 0.7~2.2 1.2~3.1 0.6~1.9皮质醇nmol/L 13~21 42~82 76~88 36~81 13.8~165.6 13.8~138丙氨酸转氨酶(ALT)IU/L 11~40 24~38 31~58 3~23 15~70 10~50 167.8天冬氨酸转氨酶(AST)IU/L 78~132 167~513 32~84 220~600 10~50 10~40 174碱性磷酸酶(ALP)IU/L 0~500 93~387 120~400 140~4003 20~150 10~100 482.5γ-谷氨酰转移酶(γ-GT)IU/L 601~1074 20~56 10~60 4~44 1~11.5 1~10ARGIU/L 1~30 0~14 0~14 0~14 0~14AcChEIU/L 1270~2430 270 930 450~790 270 540ButChE IU/L 70 110 400~430 2000~31001260~3020 640~1400肌酸激酶(CK)IU/L 35~280 145~380 30~200 26~450乳酸脱氢酶(LDH)IU/L 692~1445 123~392 380~630 160~410 50~495 75~495 636 LDH1 %39.8~63.5 29.3~51.8 34.1~61.8 6.3~18.5 1.7~30.2 0~8.0﹡:mmHg为非法定计量单位,1mmHg=133.322Pa注:引自《兽医临床病理学》(王小龙主编)、《兽医临床鉴别诊断学》(王民桢主编)四、健康动物尿液检查参考值注:引自《兽医临床病理学》(王小龙主编)。
实验动物学实验报告鸡(3篇)
第1篇一、实验目的1. 了解鸡的生物学特性、生理功能及生长发育规律。
2. 掌握鸡的饲养管理技术,为实验动物学教学和科研提供基础。
二、实验材料1. 实验动物:鸡(品种、年龄、性别等)2. 实验器材:温度计、湿度计、饲料、饮水器、称重器、笼具等3. 实验试剂:消毒液、营养液等三、实验方法1. 观察鸡的外部形态结构,了解其生长发育规律。
(1)观察鸡的头部、颈部、胸部、腹部、尾部等部位,记录其形态、颜色、羽毛等特征。
(2)测量鸡的体长、体重、翼长等指标,了解其生长发育规律。
2. 观察鸡的生理功能。
(1)观察鸡的呼吸、心跳、排泄等生理现象。
(2)观察鸡的采食、饮水等行为。
3. 掌握鸡的饲养管理技术。
(1)了解鸡的饲料种类、营养成分、饲养方式等。
(2)观察鸡的饲养环境,包括温度、湿度、光照等。
(3)掌握鸡的消毒、防疫、疾病防治等技术。
四、实验结果与分析1. 鸡的形态结构(1)头部:鸡的头部呈椭圆形,有喙、眼、耳等器官。
(2)颈部:鸡的颈部细长,肌肉发达,有利于采食和呼吸。
(3)胸部:鸡的胸部宽大,有发达的胸肌,有利于飞行。
(4)腹部:鸡的腹部较宽,有利于消化和生殖。
(5)尾部:鸡的尾部较短,羽毛密实,有利于保温。
2. 鸡的生理功能(1)呼吸:鸡的呼吸以肺为主,气囊辅助呼吸。
(2)心跳:鸡的心脏四腔,心跳较快,有利于血液循环。
(3)排泄:鸡的排泄器官有肾脏、输尿管、泄殖腔等。
(4)采食:鸡的喙尖利,善于啄食。
(5)饮水:鸡的饮水需求较高,需保持充足的水源。
3. 鸡的饲养管理技术(1)饲料:鸡的饲料应富含蛋白质、碳水化合物、脂肪、维生素和矿物质等。
(2)饲养环境:鸡的饲养环境应保持适宜的温度、湿度、光照等,以利于其生长发育。
(3)消毒:定期对鸡舍、饲料、饮水等消毒,预防疾病传播。
(4)防疫:定期进行疫苗接种,预防疫病发生。
(5)疾病防治:发现病鸡应及时隔离治疗,防止疫情扩散。
五、实验总结本次实验通过对鸡的形态结构、生理功能及饲养管理技术的观察,使我们对鸡的生物学特性有了更深入的了解。
家兔栓塞实验报告
家兔栓塞实验报告
家兔是一种常见的实验动物,其生理结构与人类相似,因此在医学研究中有着
广泛的应用价值。
本次实验旨在观察家兔在栓塞状态下的生理变化,以期为相关疾病的治疗提供参考依据。
实验方法:
1. 实验动物,选取健康成年家兔10只,体重在2-3kg之间。
2. 实验分组,将家兔随机分为实验组和对照组,每组5只。
3. 实验操作,实验组家兔在麻醉状态下,通过介入手术在肺动脉内插入栓塞物,对照组家兔进行相同手术但不插入栓塞物。
4. 实验观察,记录实验组家兔插入栓塞物后的生理指标变化,如心率、血压、
呼吸频率等,并与对照组进行对比观察。
实验结果:
1. 实验组家兔在插入栓塞物后,出现明显的心率增加、血压升高、呼吸频率加
快等生理指标变化,表明栓塞物对家兔心血管系统产生了明显的影响。
2. 对照组家兔在手术后生理指标变化较小,与实验组有明显差异。
实验结论:
栓塞状态下,家兔心血管系统会出现明显的生理变化,这为相关心血管疾病的
研究提供了重要参考。
同时,本实验结果也提示了栓塞治疗的潜在风险,需要进一步的临床研究来验证其安全性和有效性。
实验意义:
本次实验结果为心血管疾病的治疗提供了重要参考,为相关医学研究提供了实验数据支持。
同时也提醒临床医生在应用栓塞治疗时需谨慎,避免潜在的风险。
综上所述,本次家兔栓塞实验结果表明,在栓塞状态下家兔心血管系统会出现明显的生理变化,这为相关疾病的治疗提供了重要参考。
然而,栓塞治疗也存在一定的风险,需要进一步的研究和验证。
希望本次实验结果能够为相关医学研究提供有益的参考,为临床医生的治疗决策提供支持。
3.常用实验动物的生物学特性
还广泛用于药物的安全评价实验,如常用 小鼠进行药物的致畸、致癌、致突变的“三致 ”实验。小鼠实质脏器易患病变,适用于损害 实质性脏器的毒物研究。
2) 各种药物的筛选性实验
筛选实验动物用量较大。筛选实验多 半是先从小鼠做起,一般常选用封闭群 健康成年小鼠即可符合实验要求,有必 要时再使用近交系小鼠或其它较大动物 做进一步的肯定实验。
3.遗传病
大鼠尿崩症 血胆红素过多症(黄疸)、 侏儒症、 遗传性贫血、 隐睾症、 肾盂积水、 遗传性视网膜营养不良 白内障、缺肾症等 是研究人类遗传性疾病的良好动物模型。
附表 大鼠常用正常生理生化数据 指 标 正常值 指 标 正常值 成年体重 ♂ 200—280g 白细胞计数 ♀ 180—250g 总数 12.5(8.7—18)×103/mm3 寿命 3—5年 中性 22(9—34)% 染色体数 2n=42 淋巴 73(65—84)% 体温 38.2(37.8—38.7)℃ 单核 2.3(0—5)% 呼吸频率 85.5(66-114)次/min 嗜碱 0.5(0—1.5)% 耗氧量 2000mm3/g活体重 嗜酸 2.2(0-6)% 通气量 73(50—101)ml/min 血葡萄糖 121(86—149)mg/100ml 潮气量 0.86(0.60—1.25)ml 血浆尿素 43(26—60)mg/100ml 心率 475(370—580)次/min 血浆非蛋白氮 20—40mg/100ml 心输出量 47m1/min 血浆总蛋白 7.2(6.9—7.6)g/100ml 收缩压 13.07(10.93-15.99)kPa 血浆白蛋白 3.1(2.6—3.5)g/100ml 舒张压 10.13(7.99-11.99)kPa 血浆球蛋白 4.0(3.3—5.0)g/100ml 全血容量 6.41(5.75—6.99)ml/100g 血钾 23(20—26)mg/100ml 血浆容量 4.04(3.63—4.53)ml/100g 血钠 343(330-359)mg/100ml 红细胞总数 8.9(7.2—9.6)×106/mm3 血氯 382(365—408)mg/100ml 红细胞压积 46(39—53)% 碱性磷酸酶 61(40-95)IU/L 血红蛋白 14.8(12-17.5)g/100ml 谷丙转氨酶 30—52IU/L 血小板 (787—967)×103/μl 血清胆固醇 128(90—150)mg/100ml
常用实验动物生物学特性
(五)老年病学的研究
小鼠寿命短,传代时间短,随着鼠龄的增加,机体 内的一些生理生化指标不断发生变化,特别是高龄鼠 中老年病明显增多,是老年学研究的极好材料。多用 于糖质、脂质、胶原和免疫等方面的研究。
(六)计划生育研究
小鼠繁殖力强,性周期和妊娠期短,生长快,适合 计划生育研究。如常用小鼠做抗生育、抗着床、抗早 孕、抗排卵等实验应用上的首选动物。
小鼠 Mouse (Mus musculus)
实验小鼠起源
实验小鼠的前身: The oldest Chinese lexicon written in 1100 BC has a word for spotted mice. Interest gradually spread to the West,via the imperial courts of Japan.
型变化; 下颌骨的喙状突较小,髁状突发达,运用下颌骨
形态的分析技术,可进行近交系小鼠遗传监测; 染色体为20对,寿命达2-3年; 有多种毛色。
面部尖突,嘴脸部有19根触须,尾长与体长相等 小鼠无汗腺,尾有四条明显的血管,背腹面各有一条 静脉,两侧各有一条动脉. 小鼠胃容量小,约1-1.5ml,功能较差,不耐饥饿,肠道 短,盲肠不发达. 雌性为双子宫,呈“Y”型。 淋巴系统发达,外界刺激可使淋巴系统增的透明或半透明的鼠盒,不 锈钢丝制的笼盖,饮水器为玻璃瓶或塑料瓶。
垫料应有强吸湿性、无毒、无刺激气味,无粉尘, 不可食.
(三)饲料及饮水
应喂全价饲料,并保持饲料相对稳定。 可用高压湿热消毒,另一种为60Co消毒 饮用水需经灭菌处理, 每周添料,换水3-4次.
(四)性别鉴定
成年小鼠雄鼠的阴囊明显;雌鼠可见阴道开口和 五对乳房. 幼鼠主要从外生殖器与肛门的距离判断,近者为 雌性,远者为雄性.
