水的硬度的测定
水的硬度的测定实验报告

水的硬度的测定实验报告实验目的:本实验旨在通过实验方法测定水样的硬度,了解水的硬度对水质的影响,为水质监测和水处理提供参考。
实验原理:水的硬度是指水中含有的钙离子和镁离子的总和,通常以钙碳酸盐的形式存在。
硬度分为临时硬度和永久硬度两种。
临时硬度是指水中的碳酸钙和碳酸镁,它们可以通过加热水样使之分解而去除;永久硬度是指水中的硫酸钙、硫酸镁和氯化钙等,它们不能通过加热水样而去除。
实验步骤:1. 取一定量的水样,加入适量的EDTA(乙二胺四乙酸)指示剂,使之与水样中的钙离子和镁离子形成螯合物。
2. 用标准的EDTA溶液进行滴定,当水样中的钙离子和镁离子被EDTA完全螯合后,指示剂颜色由蓝色变为红色,记录滴定所需的EDTA溶液的体积V1。
3. 用相同的水样重复上述步骤,记录滴定所需的EDTA溶液的体积V2。
4. 计算水样的硬度值,硬度值=(V1-V2)×标准EDTA溶液的摩尔浓度×1000。
实验数据:取两次水样测定的数据如下:第一次测定,V1=10.5ml,V2=5.2ml。
第二次测定,V1=10.3ml,V2=5.1ml。
实验结果:根据实验数据计算得到的水样硬度值分别为:第一次测定,硬度=(10.5-5.2)×0.01×1000=53mg/L。
第二次测定,硬度=(10.3-5.1)×0.01×1000=52mg/L。
实验结论:通过本次实验测定得到的水样硬度值为53mg/L和52mg/L,说明水样的硬度较高。
水的硬度主要受到地质条件和水源的影响,硬水容易形成水垢,影响水质和生活用水。
因此,对于硬水的处理和改善是十分重要的。
实验注意事项:1. 实验中应严格按照操作规程进行,保证实验数据的准确性和可靠性。
2. 实验后应及时清洗实验器材,避免实验器材受到腐蚀和污染。
3. 在实验中应注意个人安全,避免接触有毒有害物质。
结语:本次实验通过测定水样的硬度值,了解到水的硬度对水质的影响,为水质监测和水处理提供了参考。
如何测定水硬度高低的原理

如何测定水硬度高低的原理水的硬度是指水中钙、镁离子浓度的含量,主要以钙、镁离子的浓度表示。
测定水硬度的方法有很多,其中最常用的方法是滴定法、比色法、原子吸收光谱法等。
下面将分别介绍这些方法的原理。
1. 滴定法:滴定法是一种测定水硬度的常用方法,主要基于络合滴定反应原理。
滴定法有EDTA(乙二胺四乙酸)滴定法和硬度指示剂滴定法两种。
- EDTA滴定法:EDTA是一种能与钙、镁离子发生络合反应的螯合剂。
这种滴定法的原理是,在碱性条件下,EDTA与水中的钙、镁离子形成稳定的络合物,形成棕色螯合物,然后用含有酸性指示剂的溶液进行滴定,当水中的钙、镁离子被EDTA完全络合后,溶液颜色由棕色变为蓝色,蓝色消失时滴定结束,根据所加入EDTA溶液的体积来计算钙、镁离子的含量,从而测定水的硬度。
- 硬度指示剂滴定法:硬度指示剂滴定法是基于一种叫做“硬度指示剂”的溶液的颜色变化原理。
硬度指示剂通常是一种有机染料,具有特定的酸碱性变色特性。
当硬度指示剂与溶液中的钙、镁离子发生络合反应时,颜色会发生明显变化,通过观察颜色的消失或出现来判断水中钙、镁离子的含量,进而测定水的硬度。
2. 比色法:比色法也是一种常用的测定水硬度的方法,它基于钙、镁离子与某种试剂形成有色沉淀的原理。
比色法的原理是,在一定的酸碱条件下,将试剂加入水样中,试剂与水中的钙、镁离子发生反应后形成特定颜色的沉淀,采用特定的光源照射水样,通过比较沉淀颜色与标准色板或光度计的读数来确定水中钙、镁离子的含量,从而测定水的硬度。
3. 原子吸收光谱法:原子吸收光谱法是一种精密的测定水硬度的方法,它基于钙、镁离子对特定波长的光的吸收能力的原理。
原子吸收光谱法的原理是,将水样中的钙、镁离子通过某种特定的装置(如火焰、石墨炉等)进行原子化,然后通过特定波长的光源照射原子化后的溶液,测量溶液中的钙、镁离子对波长的吸收程度,根据吸收光的强度与钙、镁离子的浓度之间的关系,计算出水中钙、镁离子的含量,进而测定水的硬度。
水硬度的测定方法和计算公式

水硬度的测定方法和计算公式
水硬度是指水中含有的钙离子和镁离子的浓度,通常以钙碳酸盐或镁碳酸盐的形式存在。
水硬度的测定方法可以通过不同的实验和计算公式来确定。
一种常用的测定水硬度的方法是滴定法。
该方法使用乙酰巴胺作为指示剂,它与钙和镁形成的络合物颜色发生变化。
首先,将水样品与乙酸与酒石酸混合,这样可以去除其他金属离子的干扰。
然后,加入乙酰巴胺指示剂,水样会呈现红色。
随着滴加EDTA(乙二胺四乙酸)溶液,当所有的钙和镁离子与EDTA形成络合物后,颜色会从红色变为蓝色。
通过记录添加的EDTA滴数,就可以计算出水中的总硬度。
水硬度的计算公式有多种,其中一种常用的公式是:
水硬度(mg/L)= 2.497 × V × N × 1000 / V1
其中,V为EDTA滴定液的体积(mL),N为EDTA的浓度(mol/L),V1为取样体积(L)。
另一种常用的计算公式是:
水硬度(mg/L)= 50.045 × V × N × 1000 / V2
其中,V为EDTA滴定液的体积(mL),N为EDTA的浓度(mol/L),V2为取样体积(L)。
需要注意的是,以上公式适用于总硬度的测定。
如果只需要测定水中的钙离子或镁离子的浓度,可以根据所需离子的化学方程式和配位比来计算。
除了滴定法,还有其他的测定水硬度的方法,如复合指示剂法、离子选择电极法等。
这些方法各有优缺点,选择合适的方法取决于实验目的和要求。
无论使用哪种方法,准确的测定水硬度对于了解水质的性质和适用性非常重要。
水硬度的测定实验报告

水硬度的测定实验报告一、实验目的1、了解水硬度的概念及其表示方法。
2、掌握 EDTA 滴定法测定水硬度的原理和操作方法。
3、学会使用络合滴定指示剂和判断滴定终点。
二、实验原理水的硬度主要是由于水中含有钙、镁离子。
测定水的硬度就是测定水中钙、镁离子的总量。
常用的表示方法有两种:以碳酸钙(CaCO₃)的质量浓度表示的“德国度(°d)”和以钙离子(Ca²⁺)和镁离子(Mg²⁺)的总物质的量浓度表示的“毫摩尔/升(mmol/L)”。
在一定条件下,以铬黑 T 为指示剂,用乙二胺四乙酸二钠盐(EDTA)标准溶液滴定水中的钙、镁离子。
EDTA 与钙、镁离子形成稳定的络合物。
在滴定过程中,溶液颜色由酒红色变为蓝色,即为滴定终点。
三、实验仪器与试剂1、仪器酸式滴定管(50 mL)移液管(25 mL)锥形瓶(250 mL)容量瓶(250 mL)分析天平玻璃棒烧杯(500 mL、250 mL)2、试剂乙二胺四乙酸二钠盐(EDTA):分析纯氯化铵氨水缓冲溶液(pH = 10)铬黑 T 指示剂钙标准溶液(001 mol/L)水样四、实验步骤1、 EDTA 标准溶液的配制与标定(1)配制 001 mol/L EDTA 标准溶液称取约 4 g EDTA 二钠盐于小烧杯中,用适量蒸馏水溶解,转入容量瓶中,定容至 250 mL,摇匀。
(2)标定 EDTA 标准溶液用移液管准确移取 2500 mL 钙标准溶液于锥形瓶中,加入 20 mL 蒸馏水和 5 mL 氯化铵氨水缓冲溶液,加入 3 4 滴铬黑 T 指示剂,用EDTA 标准溶液滴定至溶液由酒红色变为蓝色,即为终点。
记录消耗EDTA 标准溶液的体积,平行标定3 次,计算EDTA 标准溶液的浓度。
2、水样的采集与预处理采集适量的水样,若水样浑浊或有杂质,需进行过滤处理。
3、水样硬度的测定用移液管准确移取 2500 mL 水样于锥形瓶中,加入 20 mL 蒸馏水和5 mL 氯化铵氨水缓冲溶液,加入 3 4 滴铬黑 T 指示剂,用 EDTA 标准溶液滴定至溶液由酒红色变为蓝色,即为终点。
水的硬度的测定实验报告

水的硬度的测定实验报告实验背景水的硬度是指水中钙、镁等金属离子的含量。
这些离子容易生成水垢,对人体健康和设备维护都有影响。
因此,对水的硬度进行测定是非常重要的。
实验目的通过实验测定水的硬度,了解不同类型水的硬度特点,并掌握硬度的计算方法和实验操作技巧。
实验原理水的硬度可分为临时硬度和总硬度,临时硬度是由碳酸钙和碳酸镁形成的,加热后可溶解,总硬度则是由碳酸钙、碳酸镁、硫酸钙、硫酸镁等形成的,加热后也不能溶解。
常用的测定硬度的方法有比色法、滴定法和复合指示剂法。
本次实验采用滴定法测定水的硬度。
实验仪器和药品- 滴定管- 钾二氧化铬(K2Cr2O7)- 硝酸银(AgNO3)- EDTA(二乙二酸)- 氯化铁指示剂- 干燥培养皿- 磁子- 模板- 去离子水实验步骤步骤一:制备标准EDTA溶液。
取1g的EDTA,加入100ml 的去离子水溶解,得到0.01mol/L的EDTA溶液。
步骤二:准备滴定标准样品。
取10ml的含有硬度金属离子的水样,加入5ml的NH3-NH4Cl缓冲液,加入5滴氯化铁指示剂,然后滴入标准EDTA溶液,直至颜色变为蓝色。
步骤三:测量水样硬度。
首先取10ml含有硬度金属离子的水样,同上述方法制备样品。
然后按照步骤二的方法进行滴定,并记录所需的EDTA滴定液体积。
步骤四:计算水样硬度。
水样硬度的计算公式为:(所用标准EDTA滴定液的体积-检测金属离子滴定液的体积)x0.01x1000/样品费用(ml)。
实验结果和分析本次实验测定了三种水的硬度,测量结果如下:水样硬度(mg/L)自来水 162矿泉水 323盐水 1009从上表可以看出,不同类型的水硬度差别很大。
自来水的硬度较低,矿泉水和盐水的硬度则较高。
而盐水的硬度达到了1009mg/L,属于严重劣质水。
通过对硬度的测定,可以掌握不同类型水的硬度特点,为选择适合的水质提供了科学依据。
同时,也对水的质量监管提出了要求。
实验结论本次实验通过滴定法测定了不同类型水的硬度,掌握了硬度的计算方法和实验操作技巧。
水硬度测定
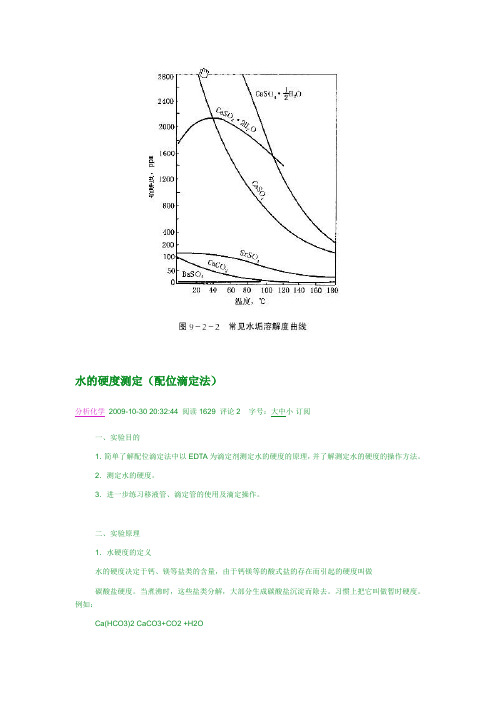
水的硬度测定(配位滴定法)分析化学2009-10-30 20:32:44 阅读1629 评论2 字号:大中小订阅一、实验目的1.简单了解配位滴定法中以EDTA为滴定剂测定水的硬度的原理,并了解测定水的硬度的操作方法。
2.测定水的硬度。
3.进一步练习移液管、滴定管的使用及滴定操作。
二、实验原理1.水硬度的定义水的硬度决定于钙、镁等盐类的含量,由于钙镁等的酸式盐的存在而引起的硬度叫做碳酸盐硬度。
当煮沸时,这些盐类分解,大部分生成碳酸盐沉淀而除去。
习惯上把它叫做暂时硬度。
例如:Ca(HCO3)2 CaCO3+CO2 +H2O由钙、镁的氯化物、硫酸盐、硝酸盐等引起的硬度叫做非碳酸盐硬度。
由于这些盐类不可能借煮沸生成沉淀而除去,因此习惯上把它叫做永久硬度。
碳酸盐硬度和非碳酸盐硬度之和就是水的总硬度。
硬水不适宜于工业上使用,如锅炉里用了硬水,经长期烧煮后,能生成锅垢,既浪费燃料,又易阻塞管道,造成重大事故。
有几种常用的硬度单位:一种是以每dm3水中所含Ca2+(或相当量Mg2+)的毫摩尔数表示的,以1 dm3水中含有0.5毫摩尔Ca2+为l度;一种是以1 dm3水中含10毫克CaO为1度,称为德国硬度,以DH表示。
8DH以下为软水,8~10DH为中等硬水,16~30DH为硬水,硬度大于30DH的属于很硬的水;另外也有以每升水中所含的钙、镁化合物换算成CaCO3的毫克数表示的。
本实验采用德国硬度表示水的硬度。
2.配位滴定法测定水的硬度。
配位滴定法是以配位反应为基础的滴定分析方法,螯合物又是目前该方法中应用最广的一类配位化合物。
因为它的稳定性强,适当控制就能得到所需的配位化合物,有的螫合剂对金属离子有选择性。
乙二胺四乙酸是具有羧基和氨基的螯合剂,能与许多阳离子形成稳定的螯合物,因此被广泛用作配位滴定法中的滴定剂。
乙二胺四乙酸简称EDTA或EDTA酸,用H4Y表示。
通常把它的溶解度较大的二钠盐也称EDTA,实际使用中常用H2Y2-表示。
水硬度的测定

EDTA标准溶液常用乙二胺四乙酸的二钠盐 (EDTA·2Na·2H2O=372.24)配制,然后以Zn为基准物质标定其
浓度。滴定在pH=10的条件下进行,以EBT为指示剂,溶液由紫红色 变为纯蓝色为终点。
终点前 Zn2+ + HIn 2-
ZnIn- + H+
LOGO
测定Ca的含量 测定Mg的含量
EDTA 乙二胺四乙酸 (H4Y)——良好的络合剂
EDTA(乙二胺四乙酸)结构 H
-
OOCH2C H+ N
HOOCH2C
CH2
CH2
H
-
H+ CH2COO N
CH2COOH
两个氨氮 四个羧氧
双极离子
有四6元 个酸配位H原4Y子,能+ 与2 H绝+ 大多H数6Y金2+ 属六离元子酸配位生成1:1的 稳定五元环螯合物。与无色金属离子形成的配合物无色与 有色金属离子形成的配合物颜色更深
纯蓝色
紫红色
滴定过程 Zn2+ + H2Y 2-
ZnY2- + 2H+
终点 ZnIn- + H2Y 2紫红色
ZnY2- +HIn2- + H+ 纯蓝色
显游离指示剂颜色
✓ 变色实质:EDTA置换少量与指示剂配位的金属离子,释放指示剂
,从而引起溶液颜色的改变
❖ 取一定量的水样,调节pH≈10,以铬黑T为指示剂, 用EDTA标准溶液(0.01000 mol·L-1)滴定Ca2+和 Mg2+的总量,即可计算水的硬度。反应过程如下:
干扰离子的消除:
水硬度测试的原理和步骤

水硬度测试的原理和步骤水的硬度是指水中所溶解的钙、镁离子含量的总和,可以通过测定水样中钙、镁离子的浓度来确定。
水的硬度对于工业生产、家庭用水以及环境保护等方面有着重要的影响,因此对水的硬度进行测试具有重要意义。
下面将介绍水硬度测试的原理和步骤。
一、原理:水硬度的主要原理是通过配位反应测定水中的钙、镁离子的浓度。
常用的测试方法有两种,分别是石酸滴定法和钠化滴定法。
1.石酸滴定法原理:水中钙、镁离子与石蕊酸生成可溶性络合物,通过指示剂的变色,来判断石酸的消耗量,从而确定钙、镁离子的浓度。
2.钠化滴定法原理:水中的钙、镁离子与EDTA生成稳定的络合物,当少量的钙、镁离子和兔血红蛋白的反应接近滴定的等价点时,指示剂溶液的颜色由橙色变为蓝色,通过判断这个颜色转变点的体积来确定钙、镁离子的浓度。
二、步骤:1.首先准备好所需的试剂和过滤好的待测水样,保证实验的准确性。
2.按照要求的比例配制石酸或钠化涂滴定液。
3.取一定量的待测水样,转移到一个容量瓶中,并加入适量的指示剂。
4.使用滴定管滴加石酸滴定液或钠化涂滴定液,在滴定过程中要均匀旋转容量瓶,直到指示剂颜色的变化。
5.记录滴定液的体积,然后进行均匀摇匀。
6.重复以上步骤,直到连续两次滴定的结果相差不大。
7.计算水样中钙、镁离子的浓度,根据滴定体积和液体中的溶质的反应计算。
8.最后,根据计算结果,判断水的硬度。
需要注意的是,在测试过程中应保持实验环境的洁净,避免外部杂质对测试结果的干扰。
同时要按照操作规程进行实验,并注意安全操作,避免有害物质对人体的伤害。
水硬度测试的原理和步骤如上所述,通过测定水样中钙、镁离子的浓度来判断水的硬度。
这对于工业生产、家庭用水以及环境保护等方面具有重要意义,通过测试水硬度,我们能够评估水的品质,为相关领域的决策提供参考依据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、目的及要求
水的硬度的测定
1.了解水的硬度的测定意义和水硬度常用的表示方法。 2.掌握EDTA法测定水中Ca2+、Mg2+含量的原理和方法。 3.熟悉金属指示剂变色原理及滴定终点的判断。
二、实验试剂、材料消耗
1.0.020mol· L-1EDTA标准溶液 2.NH3—NH4Cl 缓冲溶液:20g NH4Cl溶于水后,加 100mL浓NH3· H2O,用水稀释至1L。 3.铬黑T5g· L-1溶于三乙醇胺-无水乙醇。称0.5g铬 黑T,溶于25mL三乙醇胺、75mL 无水乙醇溶液中, 低温保存,有效期约100天。 4.三乙醇胺溶液1:2 5.NaOH溶液 40g· L-1
• 注意:测定工业用水前应针对水样情况进 行适当的前处理,如水样呈酸性或呈碱性, 要预先中合;水样如含有机物,颜色较深, 须用2ml浓盐酸及少许过硫酸铵加热脱色后 再测定;水样浑浊,需先过滤(但应注意 用纯水将滤纸洗净后用);水样中含有较 多的CO32-,也影响滴定,则需先加酸煮沸, 驱除CO2后,再进行滴定。
• 当在水中加入铬黑T指示剂时,铬黑T首先 与水中部分Mg2+结合生成Mg-EBT(酒红色) 配合物。当滴入EDTA时,EDTA与Ca2+、 Mg2+络合,终点时,EDTA夺取与Mg-EBT 中的Mg2+,将EBT置换出来,溶液由酒红 色变为纯蓝色,即为终点。
水的硬度的表示方法:
⑴以度表示,1°=10ppmCaO,1升水中含 10mgCaO。相当于是10万份水中含水1份 CaO ; • ⑵以水中CaCO3的浓度(ppm)计,相当 于每升水中含CaCO3多少 毫克。 • 水的总硬度计算公式:
铬黑T和Mg2+显色灵敏度高于Ca2+显色的
灵敏度,当水样中Mg2+含量较底时,终点变色不
敏锐。为此可在EDTA标准溶液中加入适量 Mg2+(标定前加入,不影响测定结果);或者 在缓冲溶液中加入一定量的Mg—EDTA盐,利 用置换滴定来提高终点变色的敏锐性;也可采
用K—B混合指示剂,此时终点的颜色由紫红色
变为蓝绿色。 水的硬度通常是将钙、镁总含量折算成 氧化物或碳酸钙的量来表示。这里介绍常用的 二种表示方法:
有关反应:
滴定前:Mg2+ + EBT = Mg-EBT(紫红色) pH≈10 ; NH3—NH4Cl;铬黑T作指示剂 滴定时:Ca2+ + H2y4- = CaY2-+ 2H+ Mg2+ + H2y4- = MgY2-+ 2H+ 化学计量点:Mg_EBT(紫红色) + H2y4- = M-EBT(蓝色) + 2H+ 稳定性:CaY2- >MgY2- >Mg· EBT >Ca· EBT 即:KCaY2- >KMgY2- >KMg· EBT >KCa· EBT
学习要求
• • • • • 1.EDTA标准溶液的配制及其标定方法。 2.水的总硬度的表示方法?水硬度的测定意义? 3.EDTA法测定水硬度的原理?测定条件? 4.Ca2+、Mg2+被EDTA滴定所允许的最高酸度? 5.测定水中Ca2+、Mg2+时为什么用NH3—NH4Cl 控制溶液的酸度pH≈10? 6.铬黑T指示剂的应用条件?
三、实验原理
水的总硬度通常表示水中钙、镁的总量。其中钙、镁的酸式碳
酸盐遇热既形成碳酸盐沉淀而被除去,这部分钙、镁含量称为永久硬 度。如
Ca(HCO3)2 = CaCO3↓+CO2↑+H2O 以氯化物、硫酸盐、硝酸盐等形式存在的钙、镁含量称为永久 硬度。 测定水的总硬度一般采用EDTA滴定法。在PH≈10的氨性缓冲 溶液中,以铬黑T为指标剂,用EDTA标准溶液滴定。在化学计量点 前,Ca2+、Mg2+与络黑T形成紫红色配合物,当用EDTA标准溶液滴 定至化学计量点时,游离出指示剂,溶液呈现纯蓝色。滴定时,Fe3+、 Al3+等干扰离子,可用三乙醇胺掩蔽,Cu2+、Pb2+、Zn2+等金属离子 可用国通常以10mg· L-1 CaO或1mg· L-1 CaCO3表示水的硬度。 • 水的硬度按德国度分为五种:极软水0—4。 DH;软水4—8。DH;微软水8—16。DH; 硬水16—30。DH;极硬水大于30。DH。 • 生活饮用水要求硬度≤25。DH。工业用水要 求为软水,否则易形成水垢,造成危害。
• 7.为什么掩蔽Fe3+、Al3+要在酸性溶液中加
入三乙醇胺?
