(仅供参考)物理化学笔记
物理化学课堂笔记

第一章:化学热力学一.绪论。
1.物理化学从化学现象与物理现象之间的联系着手,用物理学的理论和实验方法来研究化学变化,相变化及其P,V,T,物理变化本质。
了解物质的性质与其结构之间的关系规律的科学。
(简而言之就是用物理方法研究化学问题)其它定义:研究物质系统发生 pVT 变化、相变化和化学变化过程的基本原理,主要是平衡规律和速率规律以及与这些变化规律有密切联系的物质结构及性质(宏观性质、微观性质、界面性质和分散性质等)。
2.物理化学的基本组成①化学热力学:任一过程的方向和限度。
(研究化学反应的方向与限度。
例如:合成氨、人造金刚石、人造饼干等等。
)②化学动力学:任一过程的速度和机理(一个过程具体的每个步骤)。
(研究化学速率与反应机理,例H2与O2混合。
鞭炮。
4.电化学、表面化学、胶体化学。
)③结构化学:(研究物质结构与性质之间内在联系。
)3.研究方法①热动力学方法:以大量指点所构成的宏观系统为研究对象,直接从宏观实验和观察为基础,处理问题只关注起始和终止,不考虑宏观物体个别分子的行为不研究宏观系统个别粒子的结构及其变化的具体细节。
②统计力学方法:从宏观到微观的方法研究对象:大量粒子组成的宏观系统出发点:系统中微观粒子的性质(如质量、振动频率、转动惯量等)③量子力学方法:以量子力学为基础,以原子和分子为研究对象,揭示物质性质及其内在关系。
1-1基本性质(Basic Concept)1.系统和环境(System and Surrounding)①System: The materials of interest is defined as system.(研究的物质被定义为系统)Surrounding: The everything else is defined as surrounding.(其余的东西被定义为环境)②系统的分类(Classification of system)根据系统和环境,物质和能量交换方式,系统可分为敞开系统(Open),封闭系统(Closed),隔离系统(isolated)。
物理化学下册笔记

物理化学下册笔记
由于篇幅限制,我将为您提供一个章节的笔记示例。
如需获取更全面的笔记,建议查阅教材、相关教辅或课堂讲义。
物理化学下册重点笔记
第X章热力学第二定律与熵
1. 热力学第二定律的表述
热力学第二定律指出,不可能把热量从低温物体传到高温物体而不引起其
他变化。
热力学第二定律的数学表达式为:$\Delta S \geq 0$,其中$\Delta S$为
熵变。
2. 熵的概念
熵是系统的无序度的量度。
对于封闭系统,有$\Delta S = \Delta Q/T$,其中$\Delta Q$为热量变化,T为绝对温度。
3. 熵增加原理
在封闭系统中,自发反应总是向着熵增加的方向进行。
熵增加原理是热力学第二定律的一个重要推论。
4. 熵与自然现象
熵增加原理可以解释许多自然现象,例如热传导、扩散等自发过程。
熵的概念也可以用来分析生命体系的演化过程,它是生命体系复杂性的来源之一。
5. 熵的物理意义
熵是系统内分子运动无序性的量度,它反映了系统微观状态数目的多少。
当系统从一种平衡态向另一种平衡态转变时,如果无序性增加,则$\Delta S > 0$;如果无序性减小,则$\Delta S < 0$。
以上仅为一个章节的笔记示例,完整的笔记需要涵盖整本教材的内容。
如需获取更多信息,建议查阅教材或请教专业人士。
物理化学知识点(全)
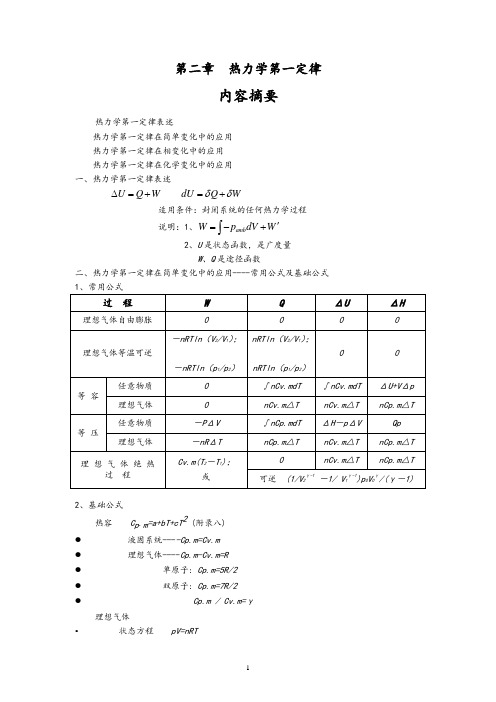
第二章热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 过 程WQΔUΔH理想气体自由膨胀理想气体等温可逆-nRTln (V 2/V 1); -nRTln (p 1/p 2) nRTln (V 2/V 1);nRTln (p 1/p 2)0 0等 容任意物质0 ∫nCv.mdT ∫nCv.mdT ΔU+V Δp 理想气体 0 nCv.m △T nCv.m △T nCp.m △T 等 压任意物质-P ΔV ∫nCp.mdT ΔH -p ΔV Qp 理想气体-nR ΔT nCp.m △TnCv.m △T nCp.m △T 理 想 气 体 绝 热过 程 Cv.m(T 2-T 1);或nCv.m △TnCp.m △T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
物化笔记总结

第一章 热力学第一定律一、基本概念系统与环境, 状态与状态函数, 广度性质与强度性质, 过程与途径, 热与功, 内能与焓。
二、基本定律热力学第一定律: ΔU=Q+W 。
焦耳实验: ΔU=f(T ) ; ΔH=f(T) 三、基本关系式1、体积功的计算 6W= -p e dV恒外压过程: W= -p e ΔVln V 1 = nRT ln p2可逆过程: W=nRT V p2 12、热效应、焓等容热: Q V =ΔU (封闭系统不作其他功) 等压热: Q p =ΔH (封闭系统不作其他功) 焓的定义: H=U+pV ; dH=dU+d(pV)ϕT2C dT焓与温度的关系: ΔH= T p13、等压热容与等容热容热容定义: C V= (?U?T )V ; C p = ( ??T H )p定压热容与定容热容的关系:C C = nRV热容与温度的关系: 四、第一定律的应用1、理想气体状态变化 C p =a+bT+c’2T等温过程: ΔU =0 ; ΔH=0 ; W=-Q= ϕ p e dV 等容过程: W=0 ; Q =ΔU= ϕ C V dT ; ΔH= ϕ C p dT等压过程: W=-p e ΔV ; Q =ΔH=ϕC pdT ; ΔU= ϕ C VdT可逆绝热过程:Q=0 ; 利用p 1 V 1γ=p 2 V 2γ 求出 T 2,W =ΔU=ϕC VdT ;ΔH= ϕ C p dT不可逆绝热过程: Q=0 ;p1利用 C V (T 2-T 1)=-p e (V 2-V 1)求出 T 2,ϕC dT ϕ C dTW =ΔU= V ;ΔH= p2、相变化可逆相变化: ΔH=Q=n Δ_H ;W =-p(V2-V 1)=-pV g =-nRT ; ΔU=Q+W3、热化学物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。
摩尔反应热的求算:H 9 (298) = ϖ H 9(B,298)反应热与温度的关系—基尔霍夫定律:[?( H )rm ] =ϖ C (B) B p ,m 。
物理化学重点(必看)
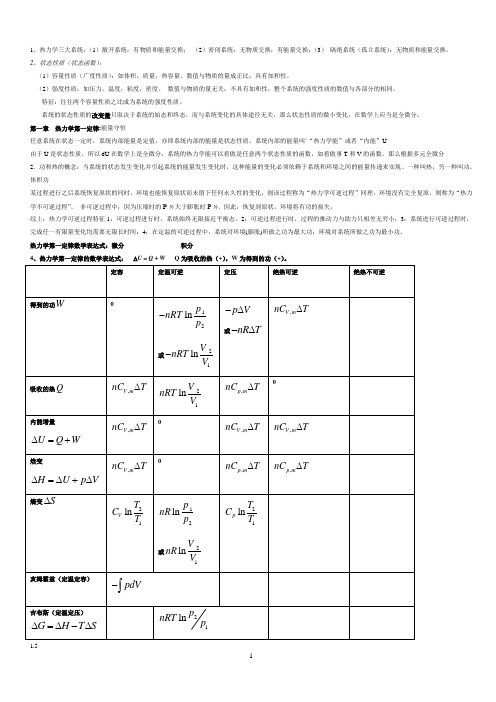
1、热力学三大系统:(1)敞开系统:有物质和能量交换;(2)密闭系统:无物质交换,有能量交换;(3)隔绝系统(孤立系统):无物质和能量交换。
2、状态性质(状态函数):(1)容量性质(广度性质):如体积,质量,热容量。
数值与物质的量成正比;具有加和性。
(2)强度性质:如压力,温度,粘度,密度。
数值与物质的量无关;不具有加和性,整个系统的强度性质的数值与各部分的相同。
特征:往往两个容量性质之比成为系统的强度性质。
系统的状态性质的改变量只取决于系统的始态和终态,而与系统变化的具体途径无关,那么状态性质的微小变化,在数学上应当是全微分。
第一章热力学第一定律:能量守恒任意系统在状态一定时,系统内部能量是定值,亦即系统内部的能量是状态性质。
系统内部的能量叫’“热力学能”或者“内能”U由于U是状态性质,所以dU在数学上是全微分,系统的热力学能可以看做是任意两个状态性质的函数,如看做事T和V的函数,那么根据多元全微分2.功和热的概念:当系统的状态发生变化并引起系统的能量发生变化时,这种能量的变化必须依赖于系统和环境之间的能量传递来实现。
一种叫热,另一种叫功。
体积功某过程进行之后系统恢复原状的同时,环境也能恢复原状而未留下任何永久性的变化,则该过程称为“热力学可逆过程”同理,环境没有完全复原,则称为“热力学不可逆过程”。
非可逆过程中:因为压缩时的P外大于膨胀时P外,因此,恢复到原状,环境将有功的损失,综上:热力学可逆过程特征1:可逆过程进行时,系统始终无限接近平衡态。
2:可逆过程进行时,过程的推动力与助力只相差无穷小;3:系统进行可逆过程时,完成任一有限量变化均需要无限长时间;4:在定温的可逆过程中,系统对环境(膨胀)所做之功为最大功;环境对系统所做之功为最小功。
热力学第一定律数学表达式:微分积分4、热力学第一定律的数学表达式:∆U = Q + W Q为吸收的热(+),W为得到的功(+)。
1.5焦耳理想气体自由膨胀实验说明W=0,Q=0,△H=0,△U=012、在通常温度下,对理想气体来说,定容摩尔热容为:单原子分子系统,V m C =32R 双原子 ,V m C =52R 多原子分子 ,V m C 632R R ==定压摩尔热容:单原子分子系统,52p m C R =双原子分子(或线型分子)系统 ,,p m V m C C R -=,72p m C R =多原子分子(非线型)系统,4p m C R = 可以看出:,,p mV m C C R -=14、在发生一绝热过程时,由于0Q δ=,于是dU Wδ=理想气体的绝热可逆过程,有:,V m nC dT pdV =- ⇒ 22,11lnln V m T V C R T V =- 21,12ln ,ln V m p V C Cp m p V ⇒= ,,p mV mC pV C γγ=常数 =>1.15、-焦耳汤姆逊系数:J T T =()H pμ∂∂- J T μ->0 经节流膨胀后,气体温度降低;J T μ-<0 经节流膨胀后,气体温度升高; J T μ-=0 经节流膨胀后,气体温度不变。
物理化学知识点归纳

物理化学知识点归纳物理化学是化学学科的一个重要分支,它综合运用物理学的原理和方法来研究化学现象和过程。
以下是对物理化学一些重要知识点的归纳:一、热力学第一定律热力学第一定律,也就是能量守恒定律,表明能量可以在不同形式之间转换,但总量保持不变。
在热力学中,通常用公式△U = Q + W来表示,其中△U 是系统内能的变化,Q 是系统吸收或放出的热量,W 是系统对外做功或外界对系统做功。
例如,在一个绝热容器中进行的化学反应,如果体系对外做功,那么内能就会减少;反之,如果外界对体系做功,内能就会增加。
二、热力学第二定律热力学第二定律有多种表述方式,其中克劳修斯表述为:热量不能自发地从低温物体传到高温物体。
开尔文表述为:不可能从单一热源取热使之完全变为有用功而不产生其他影响。
熵(S)的概念在热力学第二定律中至关重要。
对于一个孤立系统,熵总是增加的,这意味着系统总是朝着更加混乱和无序的方向发展。
比如,混合气体自发扩散后,不会自动分离回到初始状态,因为这个过程熵增加了。
三、热力学第三定律热力学第三定律指出,绝对零度(0K)时,纯物质完美晶体的熵值为零。
这一定律为计算物质在不同温度下的熵值提供了基准。
四、化学平衡化学平衡是指在一定条件下,可逆反应中正逆反应速率相等,反应物和生成物的浓度不再随时间改变的状态。
平衡常数(K)是衡量化学平衡的重要参数。
对于一个一般的化学反应 aA + bB ⇌ cC + dD,平衡常数 K 的表达式为:K = C^cD^d / A^aB^b (其中方括号表示物质的浓度)。
影响化学平衡的因素包括温度、浓度、压强等。
例如,对于吸热反应,升高温度会使平衡向正反应方向移动;增加反应物浓度,平衡也会向正反应方向移动。
五、相平衡相平衡研究的是多相体系中各相的组成、性质以及它们之间的相互转化规律。
相律是描述相平衡体系中自由度、组分数和相数之间关系的定律,其表达式为 F = C P + 2,其中 F 是自由度,C 是组分数,P 是相数。
物理化学笔记(附例题)
用分析天平称取 1.2346g K2Cr2O7 基准物质,溶解后转移至 100.0mL 容量
瓶中定容,试计算 c(K2Cr2O7)和 c( 1 6 K 2 Cr2 O 7 ) 解:已知
m(K 2 Cr2 O 7 )=1.2346g
M ( K 2 Cr2 O 7 )= 294.18g mol-1
1 -1 M (1 = 49.03g mol-1 6 K 2 Cr2 O 7 )= 294.18g mol 6
表 1-2 类 型 粒子直径/nm <1 分散系名称 真溶液 分子、离子 分散系 分散系分类(二) 主要特征 最稳定,扩散快,能透过滤纸及半透 膜,对光散射极弱。 很稳定,扩散慢,能透过滤纸及半透 膜,对光散射极弱,粘度大。 稳定,扩散慢,能透过滤纸,不能透 过半透膜,光散射强。 不稳定,扩散慢,不能透过滤纸及半 透膜,无光散射 多 相 系 统 单 相 系 统
1 1 n( KMnO 4 ) =5n(5KMnO4) 5 5
可见,基本单元的选择是任意的,它既可以是实际存在的,也可以根据需要而人为设定。
1mol 物质的质量称为该物质的 “摩尔质量” ,符号为 M,单位为 kg·mol 1,常用单 - - 位为 g·mol 1。例如 1mol 12C 的质量是 0.012kg,则 12C 的摩尔质量 M(C)=12 g·mol 1。 - 任何分子、原子或离子的摩尔质量,当单位为 g·mol 1 时,数值上等于其相对原子 质量、相对分子质量或离子式量。若用 m 表示 B 物质的质量,则该物质的物质的量为:
(3)NaCl 饱和溶液中
n( NaCl) = 3.173g / 58.44g mol-1 = 0.0542mol n(H 2 O) = (12.003-3.173)g / 18g mol-1 = 0.491mol
物理化学知识点
物理化学知识点物理化学知识点概述1. 热力学定律- 第零定律:如果两个系统分别与第三个系统处于热平衡状态,那么这两个系统之间也处于热平衡状态。
- 第一定律:能量守恒,系统内能量的变化等于热量与功的和。
- 第二定律:熵增原理,自然过程中熵总是倾向于增加。
- 第三定律:当温度趋近于绝对零度时,所有纯净物质的熵趋近于一个常数。
2. 状态方程- 理想气体状态方程:PV = nRT,其中P是压强,V是体积,n是摩尔数,R是理想气体常数,T是温度。
- 范德瓦尔斯方程:(P + a(n/V)^2)(V - nb) = nRT,修正了理想气体状态方程在高压和低温下的不足。
3. 相平衡与相图- 相律:描述不同相态之间平衡关系的数学表达。
- 相图:例如,水的相图展示了水在不同温度和压强下的固态、液态和气态的平衡关系。
4. 化学平衡- 反应速率:化学反应进行的速度,受温度、浓度、催化剂等因素影响。
- 化学平衡常数:在一定温度下,反应物和生成物浓度之比达到平衡时的常数值。
5. 电化学- 电解质:在溶液中能够产生带电粒子(离子)的物质。
- 电池:将化学能转换为电能的装置。
- 电化学系列:金属的还原性或氧化性排序。
6. 表面与胶体化学- 表面张力:液体表面分子间的相互吸引力。
- 胶体:粒子大小在1到1000纳米之间的混合物,具有特殊的表面性质。
7. 量子化学- 量子力学基础:描述微观粒子如原子、分子的行为。
- 分子轨道理论:通过分子轨道来描述分子的结构和性质。
- 电子能级:原子和分子中电子的能量状态。
8. 光谱学- 吸收光谱:分子吸收特定波长的光能,导致电子能级跃迁。
- 发射线谱:原子或分子在电子能级跃迁时发出特定波长的光。
- 核磁共振(NMR):利用核磁共振现象来研究分子结构。
9. 统计热力学- 微观状态与宏观状态:通过系统可能的微观状态数来解释宏观热力学性质。
- 玻尔兹曼分布:描述在给定温度下,粒子在不同能量状态上的分布。
物理化学下册笔记
物理化学下册笔记物理化学下册笔记第一章:化学动力学1. 化学反应速率- 化学反应速率的定义:反应物和产物的浓度变化与时间的关系- 反应速率的影响因素:浓度、温度、催化剂- 反应速率的表达式:速率常数、反应级数、速率方程式 - 反应速率的测定方法:连续监测法、瞬时速率法2. 反应动力学- 反应速率与反应物浓度的关系:零级反应、一级反应、二级反应- 反应速率与温度的关系:反应速率常数和温度的关系、活化能- 反应速率与催化剂的关系:催化剂的作用机理、催化剂对反应速率的影响3. 催化剂- 催化剂的定义:对反应速率有正向影响但不参与反应本身 - 催化剂的分类:同质催化和异质催化- 催化剂的作用机理:吸附、活化、解离、吸附活化- 催化剂的应用:工业催化、环境催化、生物催化4. 反应速率与平衡- 反应速率的平衡关系:正反应和逆反应的速率相等- 反应速率与平衡常数的关系:速率常数和平衡常数的比较 - 平衡常数的温度变化:温度对平衡常数的影响、吉布斯自由能第二章:电化学和电解质1. 电解质- 弱电解质和强电解质:电解质的溶解度、电离度- 离子强度和离子活度:电解质的离子间相互作用2. 电动势和电池- 电动势的定义:电势差和电场强度之间的关系- 更容易发生氧化反应的金属:活性金属和不活性金属- 电动势的测定方法:电动势表、电动势的测量电路- 电化学电池:原电池和电解池3. 女士电池- 干电池和蓄电池:原理和应用- 锌锰干电池、铅蓄电池、锂离子电池4. 电解和电分析- 电解的定义和过程:电解质在电场中发生化学变化的过程 - 电分析方法:电析、电沉积、电量法和电位法第三章:溶液和溶剂1. 溶液的溶解过程- 溶解的定义和过程:溶质和溶剂分子间相互作用- 溶解的热效应:热溶解和热效应,热溶剂和冷溶剂2. 溶质和溶剂的选择性溶解- 溶质和溶剂的极性:极性溶质在极性溶剂中溶解- 极性溶质和非极性溶剂的溶解:伦敦分散力和极性作用力3. 溶液浓度的表示- 溶液浓度的定义:质量浓度、物质浓度、体积浓度- 溶度和饱和度:可溶性和溶液的饱和点4. 溶液的溶解度和共存现象- 溶解度的定义:单位体积溶剂中最多可以溶解溶质的质量 - 共存现象:共沸、共熔、共晶、共溶等第四章:分子结构和化学键1. 分子的构象和立体异构体- 分子空间结构的确定:简单分子的构象分析- 立体异构体的分类:顺式异构体和反式异构体、旋光异构体2. 化学键的类型和特征- 化学键的定义和类型:共价键、离子键和金属键- 共价键的特征:原子轨道、杂化轨道和共价电子对3. 化学键的性质和反应- 化学键的性质:键长、键能和键级- 化学键的反应:键断裂和键形成的反应第五章:固体和晶体结构1. 固体的结构和性质- 固体的分类:晶体和非晶体- 固体结构的确定:晶体学和X射线衍射2. 晶体的结构类型- 离子晶体:离子间的排列和离子半径比- 配位数和配体:- 共价晶体:共价键的网络结构和共价半径比3. 固体的力学和热力学性质- 固体的力学性质:弹性模量和脆性、塑性和韧性 - 固体的热力学性质:热膨胀和热导率第六章:化学热力学1. 热力学的基本概念和能量转化- 系统和环境:孤立系统、封闭系统和开放系统 - 热力学态函数:内能、焓和吉布斯自由能2. 热力学第一定律和焓的计算- 热力学第一定律:能量守恒定律- 焓的计算:焓变和焓的标准反应焓3. 热力学第二定律和熵的计算- 热力学第二定律:熵的增加原理和不可逆过程- 熵的计算:熵变和熵的标准反应熵4. 热力学第三定律和自由能的计算- 热力学第三定律:绝对零度和熵的零值- 自由能的计算:自由能变和自由能的标准反应自由能总结:物理化学的下册内容主要涵盖了化学动力学、电化学和电解质、溶液和溶剂、分子结构和化学键、固体和晶体结构、化学热力学等方面的知识。
物理化学笔记与考试指南
物理化学笔记与考试指南一、热力学基础。
(一)基本概念。
1. 系统与环境。
- 系统:被研究的对象,可以是物质的一部分,如一定量的气体、液体或固体。
- 环境:系统之外与系统密切相关的部分。
系统与环境之间可以有物质和能量的交换。
根据交换情况分为孤立系统(无物质和能量交换)、封闭系统(有能量交换无物质交换)和敞开系统(有物质和能量交换)。
2. 状态函数。
- 定义:其数值仅取决于系统的状态,而与系统到达该状态的途径无关。
如温度T、压力p、体积V、内能U等。
- 特点:状态函数的微小变化在数学上是全微分。
例如,对于理想气体pV = nRT,p、V、T都是状态函数。
3. 过程与途径。
- 过程:系统状态发生变化的经过。
常见的过程有等温过程(Δ T=0)、等压过程(Δ p = 0)、等容过程(Δ V=0)、绝热过程(Q = 0)等。
- 途径:实现过程的具体步骤。
例如,从同一始态到同一终态,可以有不同的途径。
(二)热力学第一定律。
1. 表达式。
- Δ U=Q + W,其中Δ U是系统内能的变化,Q是系统吸收的热量,W是环境对系统做的功。
2. 功的计算。
- 体积功W=-p_外Δ V(适用于等外压过程)。
对于理想气体的可逆过程,W = -nRTln(V_2)/(V_1)。
3. 热的计算。
- 等容热Q_V=Δ U(因为W = 0);等压热Q_p=Δ H,其中H = U + pV是焓。
(三)热化学。
1. 反应热的计算。
- 标准摩尔反应焓Δ_rH_m^θ的计算:- 由标准摩尔生成焓Δ_fH_m^θ计算:Δ_rH_m^θ=∑_iν_iΔ_fH_m^θ(产物)-∑_jν_jΔ_fH_m^θ(反应物),其中ν是化学计量数。
- 由标准摩尔燃烧焓Δ_cH_m^θ计算:Δ_rH_m^θ=-∑_iν_iΔ_cH_m^θ(产物)+∑_jν_jΔ_cH_m^θ(反应物)。
2. Hess定律。
- 化学反应不管是一步完成还是分几步完成,其反应热相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
*注意!由於放射性同位素的化學性質與該元素非放射性同位素基本相同,
因此放射性同位素可在各種化學反應中作為示蹤原子.(物理性質略有不同)
O
O
e.g.酯化作用 CH3-CO18H + CH3CH2OH→CH3COCH2CH3 + H2O18
" 鈷-60 放出的γ輻射可以用作殺死癌細胞 (1998 ASL 1)
相對同位素質量,相對原子質量和相對分子質量 " 相對分子質量 : 無單位 , 摩爾質量 : 有單位 (1999 AL 1)
1.4 摩爾概念 , 摩爾濃度(略)
c摩爾是物質的量的基本單位,這個數量等於 12.000 克同位素 12C 所含的碳原 子個數,相等於 6.022×1023,它是一個常#43; 2I-(aq) + 2H+(aq) → I2(aq) + H2O(l) +Cl-(aq) I2(aq) + 2S2O32-(aq) → 2I-(aq) + S4O62-(aq)
*注意事項! 由於 I2(l)具有揮發性,又有毒,易因揮發造成誤差及造成危險.因此 在實驗時,我們使用 I2(aq),即將 I2 溶於 KI(aq)之中產生的液體-- I3-(aq).
1.5 法拉第和摩爾
法拉第是指一摩爾電子的電量
法拉第電解定律
第一定律 : 電解時,電極析出的生成物質量與通入電量成正比.
第二定律 : 電解時,析出 1 摩爾物質所需的電量與它的離子所帶電荷成正比.
Q 1F
= 96485C,∴一粒電子的電量(電荷) =
96485 6.022 ×1023
= 1.6022 ×10−19 C
1.3 質譜儀 氣化室:氣化固體,電離室:產生陽離子,加速電場,再由偏轉磁場 令正離子偏轉,正離子愈輕,偏轉程度愈大.在特定電場/磁場下,只有特定質量 電荷比的離子才可擊中儀器末端的離子探測器. (2001 AL)
質譜儀的用途 : 質譜顯示各離子的質量電荷比及其對強度,這能証實同位素的 存在,並能用同位素豐度比計算相對原子質量.同位素的豐度比與峰高成正比
*記著! 電路中有一摩爾電子通過所需的電量=1F , 另外 Q=It
1.6 c實驗式 利用燃燒物質所得的數據或質量組成導出實驗式. d分子式 從實驗式和相對分子質量導出分子式.
A-Level Physical Chemistry Note (Version 3.0) ,Website---, Email:lwrncchg@ ©Lawrence Chung February 13, 2005 1
1.7 化學方程式和化學計量學
d維生素 C 藥片的滴定
在反應中反應物和生成的計量關係.包括與下列各項有關的計算: c反應質量 d氣體體積 e溶液的濃度和體積
涉列下列反應的滴定: c酸鹼反應 d氧化還原反應
一些定義 c標準溶液(standard)是指一種已知準確濃度的溶液
d基本標準物質(primary standard)是指能用於直接配製標準溶液的物質. 特點: 1) 純度高 2) 組成恆定 3) 性質穩定* *即保存,稱取時組成與重量不變(e.g. 不吸濕,不揮發等)
I2(aq) + I-(aq)
I3-(aq) 絡合離子,易溶於水,呈紅棕色;
當滴定時 I2(aq)逐漸變為淺黃色時,加入新鮮配製的澱粉溶液,將會將產生較弱 的深藍色絡合物,滴定終點時混合物由深藍色轉無色; 如果 I2 的濃度過高,則澱 粉會和 I2 產生穩定的絡合物,而難以分解.
維生素 C 即抗壞血酸,它在酸液中能迅速地被碘定量氧化,其反應方程式如下:
物理化學: 1.原子,分子和化學計量學
1.1 原子結構及 1.2 放射現象 c質子、中子和質子作為原子的組分.以下是α粒子,β粒子及γ放射的性質:
dα粒子,β粒子及γ放射受電場和磁場的影響(利用弗林明左手定則求力方向)
e同位素在探測洩漏,放射治療,核能和作為示蹤物*方面的用途 (還有 p.12 碳-14 定年法,放射衰變及核反應方程式的計算)
基本標準物質名稱 無水碳酸鈉 二水合乙二酸 乙二酸鈉
化學式 Na2CO3 H2C2O4‧2H2O Na2C2O4
標定對象 酸(p.17) 鹼或 KMnO4 KMnO4 (p.3,13)
P.S ! 標準溶液可以由其它標準溶液標定出來.
h鹽的定義 : 酸分子的氫離子 被金屬離子或銨 離子所取代.
e當量點 : 如酸鹼滴定中,加入的氫氯酸和氫氧化鈉完全反應之時 *當量點可用熱量滴定法準確測量.
f滴定終點 : 如酸鹼滴定中,指示劑在當量點附近變色之時.
g反滴定法: 將過量已知量的反應試劑 X 與不知量的反應物 Y 進行化學反應. 反應完結後,利用滴定找出剩餘試劑 X 的量,從此找出 X 與 Y 反應量和 Y 的量.
一些典型的滴定實驗
c I2 和 S2O32-的反應 : 用以滴定漂白水中,氯(I)酸鈉(次氯酸鈉)的有效成分 先利用氯(I)酸鈉與過量的碘化鉀在酸性溶液中反應,再用標準的硫化硫酸鈉溶 液滴定釋出的碘.有關的反應方程式如下:
d室溫室壓(R.T.P),標準溫度和壓強(S.T.P)狀況下氣體的摩爾體積
R.T.P : 25℃,1atm 下是 24 dm3 ; S.T.P: 0℃,1atm 下是 22.4dm3
亞佛加德羅定律:一定溫度和壓強下,氣體體積與它的摩爾數成正比
e理想氣體方程式 PV=nRT 及其用以相對分子質量的應用* 注意!此方程需使用 SI 單位, P 為 Nm-2(Pa) ,V 為 m3(1m3=1×103dm3=1×106cm3) R 為 8.314JK-1mol-1,T 為 K , 另外 1atm=1.01×105Nm-2
*請參考測定揮發性液體的相對分子質量實驗
f氣體分壓與摩爾分數
某氣體的摩爾分數(χ1)是指
該氣體的摩爾數 氣體混合物的總摩爾數
道爾頓分壓定律
1)氣體混合物的總壓強是各氣體分壓的總和. 即 PT=P1+P2+P3+… 2)某種氣體的分壓等於氣體混合物總壓強與該氣體摩爾分數的乘積. P1=χ1×PT
*備註! 如果對氣體混合物加入氦氣,即使總壓強,分壓仍然不變. (與 p.15 連繫)
