高中化学无机推断题总结三(含答案)
高二化学无机推断试题答案及解析

高二化学无机推断试题答案及解析1.下图所示的物质转化关系中,各物质均为短周期主族元素组成的单质或化合物。
已知:A、C、D、F、K均为单质;C、E、F、G、K常温下是气体,且K为工业上制造漂白粉的原料之一;J为白色沉淀且既能溶于B的水溶液,又能溶于E的水溶液;B、G可以使湿润的红色石蕊试纸变蓝;反应④是工业制化肥的重要反应之一。
(图中部分反应条件及物质未列出)请回答下列问题:(1)B的电子式为。
(2)H的化学式为。
(3)写出反应④的化学方程式。
(4)写出反应⑤的离子方程式。
【答案】(1)(2) NaAlO2(3)N2+3H22NH3(4)Al3++3NH3+3H2O=Al(OH)3↓+3NH4+或 Al3++3NH3·H2O=Al(OH)3↓+3NH4+【解析】K为工业上制造漂白粉的原料之一,可知k为氯气,B、G可以使湿润的红色石蕊试纸变蓝,说明水溶液呈碱性,G为氨气,C为氢气,F为氮气;J为白色沉淀且既能溶于B的水溶液,又能溶于E的水溶液,说明j为氢氧化铝;A为钠,B为氢氧化钠。
D为铝,H为偏铝酸钠,I为氯化铝。
⑴ B的电子式为。
⑵ H的化学式为 NaAlO2。
⑶写出反应④的化学方程式N2+3H22NH3。
⑷写出反应⑤的离子方程式Al3++3NH3+3H2O=Al(OH)3↓+3NH4+或 Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
【考点】本题考查无机流程图中物质的推断。
2.现有A、B、C、D四种短周期元素, A分别与B、C、D结合生成甲、乙、丙三种化合物, 且甲、乙、丙3分子中含相同数目的质子数,C、D结合生成化合物丁。
有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图:(1)写出B+乙→甲+C的化学反应方程式________________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是_____。
高考化学无机非金属材料的推断题综合复习及答案

高考化学无机非金属材料的推断题综合复习及答案一、无机非金属材料练习题(含详细答案解析)1.某一固体粉末含有SiO2、Fe2O3、Al2O3,加入足量NaOH溶液充分反应后,过滤,向所得溶液中加入过量盐酸,过滤,将所得滤渣洗涤并灼烧至恒重,最终固体成份为A.SiO2B.Fe2O3、SiO2C.SiO2、Al2O3D.Fe2O3【答案】A【解析】SiO2、Fe2O3、Al2O3,加入足量NaOH溶液充分反应后,过滤,向所得溶液中含有硅酸钠、偏铝酸钠,加入过量盐酸,生成硅酸沉淀,将所得滤渣洗涤并灼烧生成二氧化硅,故A正确。
2.化学与人类生产、生活密切相关,下列叙述中正确的是()A.石英是制造光导纤维的原料,也是常用的半导体材料(Al O)硬度仅次于金刚石,可做机械轴承,属于无机非金属材料B.刚玉23C.泰国银饰和土耳其彩瓷,其主要成分均为金属材料D.手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料【答案】B【解析】【分析】【详解】A.石英的主要成分是二氧化硅,是制造光导纤维的原料,硅单质是常用的半导体材料,故A错误;B.无机非金属材是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料。
是除有机高分子材料和金属材料以外的(Al O)是金属氧化物,硬度仅次于金刚石,利用其硬度大的特所有材料的统称,刚玉23点,可做机械轴承,属于无机非金属材料,故B正确;C.泰国银饰主要成分是银单质,属于金属材料,土耳其彩瓷主要成分是硅酸盐,属于无机非金属材料,故C错误;D.手机外壳上贴的碳纤维外膜为碳单质,属于无机物,不是有机高分子化合物,故D错误;答案选B。
3.化学与生活密切相关,下列有关说法正确的是( )A.漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂和净水剂B.燃放烟花呈现出多种颜色是由于烟花中添加了Na、Cu、Fe、Pt等金属的单质C.合金材料的组成元素一定全部是金属元素D.纯净的二氧化硅是制备光导纤维的原料【答案】D【解析】【分析】【详解】A.漂白粉具有强氧化性,既能杀菌消毒,又具有漂白性,所以漂白粉既可用来漂白棉、麻、纸张,也能用作游泳池及环境的消毒剂,但不能做净水剂,A错误;B.燃放烟花呈现出多种颜色是由于烟花中添加了一些金属元素,而不是金属单质,B错误;C.合金材料的组成元素不一定全部为金属元素,可能含有非金属元素,C错误;D.光导纤维的原料为二氧化硅,D正确;答案选D。
高三化学无机推断题知识点

高三化学无机推断题知识点一、化学无机推断的概念和目的化学无机推断是指通过实验方法,根据各种反应现象和特征性质来确定未知物质的性质和组成。
它在化学分析中起着重要的作用,能够帮助我们准确地确认化合物的成份、结构和性质。
化学无机推断的目的主要有两个方面:一是通过实验结果推断出未知物质的性质,例如判断其是否为盐酸、硫酸等酸性物质;二是通过实验结果推断出未知物质的组成和结构,例如判断其是否为氯化钠、硫酸铜等化合物。
二、无机盐的推断方法1. 阳离子的推断方法(1)利用化学特性:根据阳离子的特性,如化学反应、颜色、气味等,来推断出未知物质中所含的阳离子。
例如,铁离子在NaOH溶液中生成红棕色沉淀,可以推断出未知物质中可能含有Fe3+离子。
(2)利用气体的生成:一些阳离子在特定条件下能够生成气体,通过气体的产生来判断阳离子的存在。
例如,硫酸钾溶液中存在铜离子时,加入氨水会产生蓝色沉淀,同时释放出氨气,可以推断出未知物质中可能含有铜离子。
2. 阴离子的推断方法(1)利用溶液的凝固特性:一些阴离子在特定条件下能够凝固成为固体沉淀,通过凝固的出现来判断阴离子的存在。
例如,硝酸银溶液中存在氯离子时,会产生白色沉淀,可以推断出未知物质中可能含有氯离子。
(2)利用特殊的化学反应:一些阴离子在特定条件下会发生特殊的化学反应,通过反应的出现来判断阴离子的存在。
例如,加入Barfoed试液后,出现红色沉淀,可以推断出未知物质中可能含有还原糖。
三、常见无机化合物的推断1. 硝酸盐的推断(1)加热产生棕色气体:利用加热产生棕色气体的特点,可以推断出未知物质中可能含有硝酸盐。
(2)与亚硝酸银反应:亚硝酸银溶液可以与硝酸盐反应生成红褐色沉淀,从而推断出未知物质中可能含有硝酸盐。
2. 硫酸盐的推断(1)与氯化钡反应:氯化钡溶液可以与硫酸盐反应生成白色沉淀,通过判断是否有白色沉淀的生成来推断出未知物质中可能含有硫酸盐。
(2)加入氯化钠酸化亚硫酸:硫酸盐加入氯化钠酸化亚硫酸后产生气体的反应,可以推断出未知物质中可能存在硫酸盐。
高考化学 高无机综合推断 综合题附详细答案

高考化学高无机综合推断综合题附详细答案一、无机综合推断1.已知A、B、C、D是元素周期表中的四种短周期元素,A分别与B、C、D结合生成三种化合物:甲、乙、丙。
甲、乙、丙三种化合物的分子中含有相同数目的电子;丙与甲、乙均能发生化学反应,且甲、丙为无色有不同刺激性气味的物质,化合物丁与C的某种单质在常温下反应可生成红棕色气体;B、C、D三种元素的单质与甲、乙、丁三种化合物之间存在如图所示的转化关系(反应条件已略去):(1)D在元素周期表中的位置为________________。
(2)B、C、D的原子半径的大小关系为________(用元素符号表示)。
(3)丁与C的单质在常温下反应的化学方程式为______________。
(4)甲、乙、丙分子中的电子数均为________,实验室如何检验丙_______ 。
(5)C的单质+丙→乙+丁的化学方程式为_______________。
【答案】第2周期ⅤA族 N>O>F 2NO+O2===2NO2 10 能使湿润的红色石蕊试纸变蓝色 5O2+4NH36H2O+4NO【解析】【分析】本题有几个重要的突破口:①甲、乙、丙三种化合物的分子中含有相同数目的电子;②丙为无色有不同刺激性气味的物质;③化合物丁与C的某种单质在常温下反应可生成红棕色气体,说明丁为NO,C的某种单质可能为O2。
【详解】A、B、C、D是元素周期表中的四种短周期元素,A分别与B、C、D结合生成三种化合物:甲、乙、丙。
化合物丁与C的某种单质在常温下反应可生成红棕色气体,则丁为NO、C为O元素;丙与甲、乙均能发生化学反应,且甲、丙为无色有不同刺激性气味的物质,由图中信息可知,丙与O元素的单质反应生成NO,也可以由O的单质与D的单质化合而得,则丙为NH3、D为N元素,乙为H2O;甲、乙、丙三种化合物的分子中含有相同数目的电子,则其都有10个电子,结合图中信息,B的单质可以与H2O反应生成甲和O 元素的单质,故甲为HF、B为F元素。
高考化学 高无机综合推断 综合题含答案解析

高考化学高无机综合推断综合题含答案解析一、无机综合推断1.A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
(1)若A、B、C三种物质的焰色反应均为黄色,A俗称苛性钠,W为无色无味气体,C受热分解可转化为B。
①向B溶液中通入W生成C的离子方程式为__________________________________。
②A溶液与C溶液反应的化学方程式为______________________________________。
(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠。
①A、B、C三种物质中所含有的金属元素单质与W反应的化学方程式为_____________。
②A溶液一步转化为C溶液的反应离子方程式为________________________________。
(3)若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g·mol-1。
①B的化学式为________________。
②实验室制取B时,_____________(填“能”或“不能”)用向上排空气法收集B。
③一定条件下B与CO反应的化学方程式为_____________________________。
(4)若A为淡黄色固体单质,W为气体单质,B、C均为酸性氧化物。
则C溶于水形成化合物D,在加热的情况下,D的浓溶液与A反应的化学方程式为________________________。
【答案】CO32-+H2O+CO2=2HCO3- NaOH+NaHCO3=Na2CO3+H2O 2Al+2NaOH+2H2O =2NaAlO2 +3H2↑ Al3-+ 4OH- =AlO2- + 2H2O NO 不能 2NO+2CO2CO2+N2S+2H2SO4(浓)3SO2↑+2H2O【解析】【分析】(1) 若A、B、C 三种物质的焰色反应均为黄色,均含Na元素,A俗称苛性钠,则A为NaOH,W为无色无味气体,C受热分解可转化为B,则W为CO2、B为Na2CO3,C为NaHCO3;(2)若A、B、C三种物质都含有一种金属元素,且B为两性物质,W俗称苛性钠,则B为Al(OH)3,A为AlCl3、C为NaAlO2;(3) 若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g•mol-1,则A为N2、W为O2、B为NO、C为NO2;(4) 若A 为淡黄色固体单质,W 为气体单质,B、C均为酸性氧化物,则A为S,W为O2、B为SO2、C为SO3 。
高考化学专题复习高无机综合推断的综合题及答案解析

高考化学专题复习高无机综合推断的综合题及答案解析一、无机综合推断1.无机化合物X与Y均由三种相同短周期的非金属元素组成(X比Y的相对分子质量大),常温下均为无色液体,易水解,均产生酸性白雾。
取1.35gX与足量水完全反应,向反应后的溶液中滴加1.00mol·L-1的NaOH溶液40.0mL恰好反应,溶液呈中性,继续滴加BaCl2溶液至过量,产生不溶于稀盐酸的2.33g白色沉淀。
Y水解得到两种产物,其物质的量之比1:2,且产物之一能使品红溶液褪色。
请回答:(1)X的化学式______________。
白色沉淀属于_____________ (填“强”、“弱”或“非”)电解质。
(2)Y与水反应的化学方程式_________________。
(3)二元化合物Z能与X化合生成Y。
一定条件下,0.030mol Z与足量氨反应生成0.92gA(原子个数之比1:1,其相对分子量为184)和淡黄色单质B及离子化合物M,且M 的水溶液的pH<7。
将0.92gA隔绝空气加强热可得到0.64gB和气体单质C。
①写出Z与足量氨反应的化学方程式____________。
②亚硝酸钠和M固体在加热条件下_____________(填“可能”或“不能”)发生反应,判断理由是_________________。
③请设计检验离子化合物M中阳离子的实验方案:_________________。
【答案】SO2Cl2或SCl2O2强 SOCl2+H2O=2HC1+SO2↑ 6SCl2+ 16NH3=S4N4+2S+ 12NH4Cl 可能 NaNO2中N元素化合价为+3价,NH4C1中N元素化合价为-3价,发生氧化还原反应生成N2取少量M固体加水溶解,加入浓NaOH溶液加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则证明有NH4+【解析】【分析】X、Y常温下为无色液体,且水解产生白雾,证明产生氯化氢,1.35gX的水解产物能与0.04mol的NaOH,恰好完全反应,滴加氯化钡能产生难溶于酸的沉淀,则产生0.01mol的硫酸钡沉淀,Y的水解产物能使品红褪色,有二氧化硫产生,1.35gX中含有S:0.01mol,Cl:0.02mol,则氧元素的物质的量是(1.35g-0.32g-0.71g)÷16g/mol=0.02mol,故X为SO2Cl2;Y水解得到两种产物,其物质的量之比1:2,且产物之一能使品红溶液褪色,因此Y为SOCl2;二元化合物Z能与X化合生成Y。
高中化学无机推断题带答案
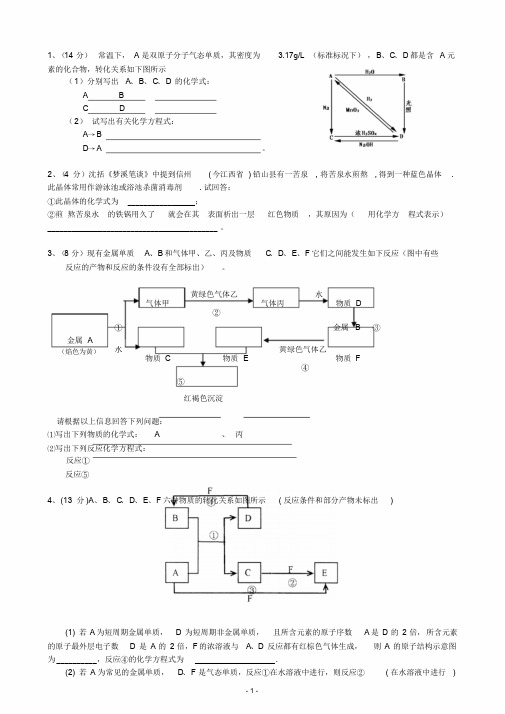
1、(14 分)常温下, A 是双原子分子气态单质,其密度为 3.17g/L (标准标况下),B、C、D 都是含 A 元素的化合物,转化关系如下图所示(1)分别写出A、B、C、D的化学式:A BC D(2)试写出有关化学方程式:A→BD→A 。
2、(4 分)沈括《梦溪笔谈》中提到信州(今江西省) 铅山县有一苦泉, 将苦泉水煎熬, 得到一种蓝色晶体. 此晶体常用作游泳池或浴池杀菌消毒剂. 试回答:①此晶体的化学式为_________________;②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________ 。
3、(8 分)现有金属单质A、B 和气体甲、乙、丙及物质C、D、E、F 它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
黄绿色气体乙水气体甲气体丙物质 D②①金属 B ③金属 A(焰色为黄)水黄绿色气体乙物质 C 物质 E 物质 F④⑤红褐色沉淀请根据以上信息回答下列问题:⑴写出下列物质的化学式: A 、丙⑵写出下列反应化学方程式:反应①反应⑤4、(13 分)A、B、C、D、E、F 六种物质的转化关系如图所示( 反应条件和部分产物未标出)(1) 若A 为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数 A 是D的2 倍,所含元素的原子最外层电子数D是A的2 倍,F 的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式为____________________.(2) 若A 为常见的金属单质,D、F 是气态单质,反应①在水溶液中进行,则反应②( 在水溶液中进行)- 1 -的离子方程式是____________________,已知常温下1g D 与F 反应生成B(气态)时放出92.3kJ 热量,写出反应的热化学方程式____________________ .(3) 若A、D、F 都是短周期非金属元素单质,且A、D所含元素同主族,A、F 所含元素同周期,则反应①的化学方程式为____________________,B 固体属于__________晶体.5. (10 分)短周期常见元素形成的纯净物A、B、C、D、E 的转化关系如下图所示,物质 A 与物质 B 之间的反应不在溶液中进行( E 可.能.与A、B两种物质中的某种相同)。
高考化学与高无机综合推断有关的压轴题含答案解析

高考化学与高无机综合推断有关的压轴题含答案解析一、无机综合推断1.化合物甲由四种元素组成。
某化学研究小组按如图流程探究其组成:已知丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一。
请回答下列问题:(1)甲的化学式为____。
(2)甲发生爆炸反应的化学方程式为____。
(3)已知化合物甲中,有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,则爆炸反应中被氧化的元素与还原产物的物质的量之比为____。
【答案】AgOCN 2AgOCN=2Ag+N2↑+2CO↑ 1:2【解析】【分析】已知丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一,由此可知丁是氮气,丙是一氧化碳。
根据流程图可知氮气的物质的量为0.01mol,一氧化碳的物质的量为n(CO)= (3-2.16-0.0128)g0.02mol28g/mol⨯=,由此可知甲中C、N、O的原子个数比为1:1:1,化合物由四种元素组成,已知化合物中有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,撞击甲容易发生爆炸生成三种物质,则甲中应该有一种金属元素,设甲的化学式为R(CNO)x,R的相对原子质量为M,根据反应2R(CNO)x=2R+2xCO+xN2,有2M+84x x=30.01,所以M=108x,设x=1,2,3,……,当x=1时,M=108,R为银元素,当x取2、3……时,没有对应的金属元素的相对原子质量符合要求,所以甲为AgOCN。
【详解】(1)由分析可知,甲的化学式为AgOCN,故答案为:AgOCN;(2)由分析可知,乙为银单质,丙为一氧化碳,丁为氮气,则甲发生爆炸反应的化学方程式为2AgOCN=2Ag+N2↑+2CO↑,故答案为:2AgOCN=2Ag+N2↑+2CO↑;(3)根据爆炸反应方程式可知,爆炸反应中被氧化的元素为氮元素,共2mol,还原产物为银单质和一氧化碳,共4mol,则爆炸反应中被氧化的元素与还原产物的物质的量之比为1:2,故答案为:1:2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学无机推断题总结三(含答案)阳光老师:祝你学业有成题号一总分得分一、推断题(本大题共16小题,共160.0分)1.已知A、B为常见的浓酸溶液;X、Y、Z、W均为氧化物,其中X是红棕色气体,Y的固体可用于人工降雨,W既能使澄清石灰水变浑浊,又能使品红溶液褪色。
根据如图所示转化关系(反应条件略),回答下列问题:(1)Y是__________(填化学式)。
(2)将B露置在空气中一段时间,溶液质量增加但溶液浓度降低,表明B具有________性;利用这种性质可以进行______(填字母)实验操作。
a.干燥二氧化硫b.检验Ba2+c.干燥氨气d.钝化铝片(3)写出X与Z的反应方程式:________________________________。
(4)W具有漂白性,氯水也有漂白性,两者同时使用,漂白效果将_________(填“增强”或“减弱”),原因是____________(用化学方程式表示)。
(5)反应①中氧化产物和还原产物的物质的量之比为__________。
【答案】(1)CO2(2)吸水;a(3)3NO2+H2O=2HNO3+NO(4)减弱;SO2+Cl2+2H2O=2HCl+H2SO4(5)1:4【解析】【分析】本题是对化学物质的推导知识的考查,是中学化学的重要题型,难度较大。
关键是掌握化学物质的性质和化学物质间的关系,侧重知识的能力考查。
【解答】依据流程图和A、B为常见的浓酸溶液;X、Y、Z、W均为氧化物,其中X是红棕色气体,所以X是二氧化氮,Y的固体可用于人工降雨,所以Y是二氧化碳,W既能使澄清石灰水变浑浊,又能使品红溶液褪色,W是二氧化硫,Z是水,A是浓硝酸,B是浓硫酸,据此答题。
(1)由以上分析知,Y是CO2;故答案为:CO2;(2)将浓硫酸露置在空气中一段时间,溶液质量增加但溶液浓度降低,表明B具有吸水;a.干燥二氧化硫,是利用浓硫酸的吸水性,故a正确;b.检验Ba2+,是利用硫酸根的性质,故b错误; c.浓硫酸不能干燥氨气,故c错误;d.钝化铝片,是利用浓硫酸的强氧化性,故d错误;故答案为:吸水;a;(3)X与Z的反应方程式是:3NO2+H2O=2HNO3+NO;故答案为:3NO2+H2O=2HNO3+NO;(4)二氧化硫具有漂白性,氯水也有漂白性,两者同时使用,漂白效果将减弱,原因是:SO2+Cl2+2H2O=2HCl+H2SO4;故答案为:减弱;SO2+Cl2+2H2O=2HCl+H2SO4;(5)反应①的方程式是:C+4HNO3(浓),依据方程式氧化产物是CO2,还原产物是NO2,氧化产物和还原产物的物质的量之比为1:4;故答案为:1:4。
2.X、Y、Z三种物质存在如图所示转化关系。
(1)若X为黑色固体单质,A气态单质,则Z→Y的化学方程式为:______。
(2)若X为NaOH溶液,A为无色无味气体,则Y→Z的离子方程式为:______。
【答案】CO2+C− 高温 2CO CO2+CO32−+H2O=2HCO3−【解析】解:(1)若X为黑色固体单质,A气态单质,可知A为O2,X为C,Y为CO、Z为CO2,则Z→Y的化学方程式为:CO2+C− 高温 2CO,故答案为:CO2+C− 高温 2CO;(2)若X为NaOH溶液,A为无色无味气体,可知A为CO2、Y为Na2CO3、Z为NaHCO3,则Y→Z的离子方程式为:CO2+CO32−+H2O=2HCO3−,故答案为:CO2+CO32−+H2O=2HCO3−。
(1)若X为黑色固体单质,A气态单质,可知A为O2,X为C,Y为CO、Z为CO2;(2)若X为NaOH溶液,A为无色无味气体,可知A为CO2、Y为Na2CO3、Z为NaHCO3。
本题考查无机物的推断,题目比较基础,熟练掌握元素化合物知识即可解答,注意识记常见的连续反应、三角转化、特殊置换反应、特殊现象反应等。
3.下图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A是能使澄清石灰水变浑浊的无色气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体,请回答:(1)物质X是___________(填化学式,下同),A是_____,B是______。
(2)写出反应的化学方程式:C→E:________________________________;G→E:_______________________________ 。
【答案】(1)(NH4)2CO3;CO2;H2O(2)4NH3+5O24NO+6H2O;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O【解析】【分析】本题考查无机物的推断,注意元素化合物的性质应用,题目难度较大,本题解答时要善于抓住题中信息,为解答该题的关键,也是易错点,学习中要加强信息迁移能力的培养。
【解答】X为正盐,既能与盐酸反应生成气体A,又能与NaOH反应生成气体C,C是能使湿润的红色的石蕊试纸变蓝的无色气体,则C为NH3,而A是能使澄清石灰水变浑浊的无色气体,且A能与Na2O2反应,则A为CO2,X为(NH4)2CO3,由X分解可知B为H2O,A与过氧化钠反应生成D,则D为O2,氨气催化氧化生成E,所以E为NO,E与D反应生成F,F为NO2,F与水反应生成G,G为HNO3。
(1)物质X是(NH4)2CO3,A为CO2,B为H2O;(2)氨气与氧气在催化剂条件下反应的化学方程式为:4NH3+5O24NO+6H2O;Cu与稀硝酸反应的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
4.A、B、C、D四种物质之间有图5所示的转化关系.已知,A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体.请回答下列问题:①写出A和C的化学式:A______,C______.②B→C观察到的现象是______.③C→D的化学反应方程式是______,该反应的氧化剂是______,还原剂是______.④在图示D→C的过程中发生反应的化学方程式是______,其中,D表现出强______(填“氧化性”或“还原性”).【答案】N2;NO2;无色气体变为红棕色;3NO2↑+H2O=2HNO3+NO;NO2;NO2;Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;氧化性【解析】解:A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体,由转化关系可知,C为NO2,故A为N2,B为NO,D为HNO3,①由上述分析可知,A为N2,C为NO2,故答案为:N2;NO2;②B→C是NO与氧气反应生成NO2,观察到的现象是:无色气体变为红棕色,故答案为:无色气体变为红棕色;③C→D的化学反应方程式是:3NO2↑+H2O=2HNO3+NO,反应中NO2所含N元素化合价既升高又降低,NO2既是氧化剂又是还原剂,故答案为:3NO2↑+H2O=2HNO3+NO;NO2;NO2;④图示D→C的过程中发生反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应中HNO3所含N元素化合价降低,硝酸表现出强氧化性,故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;氧化性.A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体,由转化关系可知,C为NO2,故A为N2,B为NO,D为HNO3,据此解答.本题考查无机物推断,涉及N元素单质化合物性质、氧化还原反应等,比较基础,注意对基础知识的掌握.5.如表列出了A−G7种元素在周期表中的位置:(1)这7种元素中化学性质最不活泼的是______(填元素符号)。
(2)D元素的最高价氧化物对应水化物与氢氧化钠反应的离子方程式是______ 。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为______(填元素符号)。
(4)E元素氢化物的结构式是______ ,该氢化物在常温下跟B发生反应的化学方程式是______ 。
(5)F元素跟A元素形成化合物的电子式是______ ,高温灼烧该化合物时,火焰呈______ 色。
(6)C、D的单质作电极,稀硫酸作电解质溶液,构成原电池,其负极的电极反应式为:______ 。
【答案】(1)Ar;(2)Al(OH)3+OH−=AlO2−+2H2O;(3)K>Na>Mg;(4)H−O−H;2K+2H2O=2KOH+H2↑;(5);黄;(6)Mg−2e−=Mg2+【解析】【分析】本题考查元素周期表与元素周期律、常用化学用语、原电池等,难度不大,侧重对基础知识的巩固,注意把握元素周期表的结构。
【解答】由元素在周期表中位置,可知A为Na、B为K、C为Mg、D为Al、E为O、F为Br、G为Ar。
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,故答案为:Ar;(2)D元素的最高价氧化物对应水化物为Al(OH)3,与氢氧化钠反应生成偏铝酸钠与水,化学反应的离子方程式为:Al(OH)3+OH−=AlO2−+2H2O,故答案为:Al(OH)3+ OH−=AlO2−+2H2O;(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K> Na>Mg,故答案为:K>Na>Mg;(4)E元素氢化物在常温下跟B发生反应,是水与钾反应生成KOH与氢气,水的结构式为H−O−H,二者反应方程式为:2K+2H2O=2KOH+H2↑,故答案为:H−O−H;2K+2H2O=2KOH+H2↑;(5)F元素跟A元素形成化合物为NaBr,由钠离子与溴离子构成,其电子式为,含有钠元素,固体灼烧火焰为黄色,故答案为:;黄;(6)Mg、Al的单质作电极,稀硫酸作电解质溶液,构成原电池,Mg为负极,失去电子生成镁离子,电极反应式为:Mg−2e−=Mg2+,故答案为:Mg−2e−=Mg2+。
6.已知A为正盐,常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,气体B能使湿润红色石蕊试纸变蓝,气体E本身为无色气体,但是与空气接触会生成一种红棕色气体I,H为黄绿色气体。
F在常温下是一种无色液体。
C、J的水溶液分别为两种强酸。
图中反应条件(除加热外)均已略去。
(1)写出它们的化学式:A__________、C___________、J____________;(2)实验室制备气体B的化学方程式为:_______________________________________________________________________ _______________。
(3)写出B+D→E+F的化学方程式:_______________________________________________________________________ ____________________。
