高考化学一轮总复习:第十二章 物质结构与性质
第十二章物质结构与性质第九课时晶胞结构的分析与计算2课件-高三化学一轮复习

⑤金刚石型堆积 设原子半径为 R,由于原子在晶胞体对角线方向 上相切(相邻两个碳原子之间的距离为晶胞体对角线
的四分之一),可以计算出晶胞参数:a=b=c=8 3 3R, α=β=γ=90°。每个晶胞中包含八个原子。
η=8×a433πR3×100%=88×433πRR33×100%≈34.01%。 3
角度一 原子坐标ቤተ መጻሕፍቲ ባይዱ数的计算 [典题示例 4] (1)(2019·全国卷Ⅱ)一种四方结构的超导化合物
的晶胞如图 1 所示。晶胞中 Sm 和 As 原子的投影位置如图 2 所示。
图1
图2
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子
鸟不展翅膀难高飞。
人儿生童大不 有得无,行抱胸负一怀,,这般虽无寿关作百紧岁要为犹,为可拔无成也年高。人则设不可问胸无出大志现。 ,主要考查晶胞的微粒组成、晶胞的
桐山万里丹山路,雄风清于老风声
人雄若鹰密有 必志须度,比万鸟、事飞可得微为高。,粒因为间它的的猎物距就是离鸟。、空间占有率、原子分数坐标等内容,如 2020
[解析] (1)根据图 1 中原子 1 的坐标为12,12,12,可看出原子 2 的 z 轴为 0,x、y 轴均为12,则原子 2 的坐标为12,12,0;原子 3 的 x、y 轴均为 0,z 轴为12,则原子 3 的坐标为0,0,12。(2)D 与 周围 4 个原子形成正四面体结构,D 与顶点 A 的连线处于晶胞体对 角线上,过面心 B、C 及上底面面心原子的平面且平行侧面将晶胞 2 等分,同理过 D 原子的且平行侧面的平面将半个晶胞再 2 等分, 可知 D 处于到各个面的14处,则 D 原子的坐标参数为14,14,14。
人教版2020高考化学第12章(物质结构与性质)第2节2)分子的立体构型讲与练(含解析)

第12章(物质结构与性质)李仕才第二节分子结构与性质考点二分子的立体构型1.用价层电子对互斥理论推测分子的立体构型(1)理论要点①价层电子对在空间上彼此相距最远时,排斥力最小,体系的能量最低。
②孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角越小。
(2)价层电子对数的确定方法其中:a是中心原子的价电子数(阳离子要减去电荷数、阴离子要加上电荷数),b是1个与中心原子结合的原子提供的价电子数,x是与中心原子结合的原子数。
(3)价层电子对互斥模型与分子立体构型的关系2.用杂化轨道理论推测分子的立体构型(1)杂化轨道概念:在外界条件的影响下,原子内部能量相近的原子轨道重新组合的过程叫原子轨道的杂化,组合后形成的一组新的原子轨道,叫杂化原子轨道,简称杂化轨道。
(2)杂化轨道的类型与分子立体构型(3)由杂化轨道数判断中心原子的杂化类型杂化轨道用来形成σ键和容纳孤电子对,所以有公式:杂化轨道数=中心原子的孤电子对数+中心原子的σ键个数。
代表物杂化轨道数中心原子杂化轨道类型CO20+2=2 spCH2O 0+3=3 sp2CH40+4=4 sp3SO21+2=3 sp2NH31+3=4 sp3H2O 2+2=4 sp3(4)3.等电子原理原子总数相同,价电子总数相同的粒子具有相似的化学键特征,它们的许多性质相似,如CO和N2。
等电子体的微粒有着相同的分子构型,中心原子也有相同的杂化方式。
常见等电子体与空间构型微粒通式价电子总数立体构型CO2、CNS-、NO+2、N-3AX216e-直线形CO2-3、NO-3、SO3AX324e-平面三角形SO2、O3、NO-2AX218e-V形SiO4-4、PO3-4、SO2-4、ClO-4AX432e-正四面体形PO3-3、SO2-3、ClO-3AX326e-三角锥形CO、N2AX 10e-直线形CH4、NH+4AX48e-正四面体形判断正误(正确的打“√”,错误的打“×”)1.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对。
2023年高三化学一轮专题复习题:物质结构与性质(含答案)

2023届高考化学一轮专题复习题:物质结构与性质1.(2022·吉林省实验中学模拟预测)铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。
铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
回答下列问题:(1)基态铝原子的核外电子排布式为___________。
(2)基态氮原子的价层电子排布图为___________(填编号)。
A.B.C.D.(3)化合物I中碳原子的杂化轨道类型为___________,化合物II中阳离子的空间构型为___________。
(4)化合物III中O、F、S电负性由大到小的顺序为___________。
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________。
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。
①晶体中与Al距离最近的Al的个数为___________。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为(34,14,14),原子2的坐标为(14,14,34),则原子3的坐标为_____。
①已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为N A,则晶体的密度为______g·cm-3(列出计算式)。
2.(2022·山东·烟台市教育科学研究院一模)含铜物质在生产生活中有着广泛应用。
回答下列问题:(1)基态Cu原子的电子所占据的最高能层符号为____;基态Cu+较基态Cu2+稳定的原因是____;Cu2O和Cu2S都是离子晶体,熔点较高的是____。
(2)CuSO4稀溶液中存在[Cu(H2O)6]2+,[Cu(H2O)6]2+的空间构型为____;下列对[Cu(H2O)6]2+中Cu2+杂化方式推断合理的是____(填标号)。
A.sp3 B.sp3d C.sp3d2 D.dsp2(3)Cu2+可形成[Cu(en)2NH3](BF4)2,其中en代表H2N—CH2—CH2—NH2。
高三化学一轮复习第12章物质机构与性质(选修)第二讲分子结构与性课件

种元素的原子。②A、B可以相同,也可以不同。
(3)特征 具有一定的 方向性和 饱和 性。
(4)分类 氢键包括 分子内
氢键和 分子间 氢键两种。
(5)分子间氢键对物质性质的影响 主要表现为使物质的熔、沸点 升高 ,对电离和溶解度等产
生影响。
6.相似相溶原理 非极性溶质一般能溶于 非极性溶剂 ,极性溶质一般能溶 于 极性溶剂 。如果存在氢键,则溶剂和溶质之间的氢键 作用力越大,溶解性 越好 。
2.共价键的类型
分类依据
形成共价键 的原子轨道
重叠方式
形成共价键 的电子对是
否偏移
原子间共用 电子对的数
目
σ键
π键 极性 键 非极性 键 单键 双键 三键
类型 电子云“ 头碰头 ”重叠
电子云“ 肩并肩 ”重叠
共用电子对发生__偏__移____ 共用电子对不发生__偏__移___ 原子间有 一对 共用电子对 原子间有两对共用电子对 原子间有 三对共用电子对
配位数是4时:平四面面正体方,形如,[Z如nC[lP4]t2C-l4]2-
5.结构和性质
6.配合物异构立体异构几光何学异构异构 构造异构
列举配合物在生产和实验中的重要用途。 提示 (1)湿法冶金;(2)分离和提纯;(3)合成具有特殊功 能的分子;(4)检验离子的特效试剂;(5)作掩蔽剂;(6)作 有机沉淀剂;(7)萃取分离;(8)作催化剂。
第二讲 分子结构与性质
1.了解共价键的形成,能用键能、键长、键角等说明简单 分子的某些性质。
2 . 了 解 杂 化 轨 道 理 论 及 常 见 的 杂 化 轨 道 类 型 (sp, sp2 , sp3)。
3.能用价层电子对互斥理论或者杂化轨道理论推测常见的 简单分子或离子的立体构型。
高中化学知识点总结(第十二章 物质结构与性质-选择性必修二)
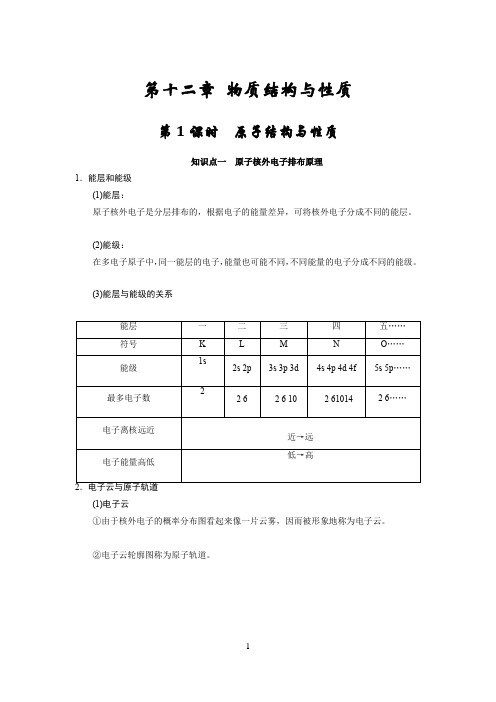
第十二章物质结构与性质第1课时原子结构与性质知识点一原子核外电子排布原理1.能层和能级(1)能层:原子核外电子是分层排布的,根据电子的能量差异,可将核外电子分成不同的能层。
(2)能级:在多电子原子中,同一能层的电子,能量也可能不同,不同能量的电子分成不同的能级。
(3)能层与能级的关系(1)电子云①由于核外电子的概率分布图看起来像一片云雾,因而被形象地称为电子云。
②电子云轮廓图称为原子轨道。
(2)原子轨道原 子 轨 道⎩⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎧轨道形状⎩⎪⎨⎪⎧ s 电子的原子轨道呈球形对称p 电子的原子轨道呈哑铃形各能级上的原子轨道数目⎩⎪⎨⎪⎧s 能级 1 个p能级 3 个d 能级5个f 能级7个……能量关系⎩⎪⎨⎪⎧①相同能层上原子轨道能量的高低:n s <n p <n d <n f②形状相同的原子轨道能量的高低: 1s <2s <3s <4s ……③同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如2p x 、2p y、2p z轨道的能量相等3.基态原子核外电子排布 (1)排布原则[提醒] 当能量相同的原子轨道在全满(p 6、d 10、f 14)、半满(p 3、d 5、f 7)、全空(p 0、d 0、f 0)时原子的能量最低,如24Cr 的电子排布式为[Ar]3d 54s 1,29Cu 的电子排布式为[Ar]3d 104s 1。
(2)填充顺序——构造原理(3)基态原子核外电子排布的表示方法3s23p4(1)电子的跃迁(2)不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。
知识点二原子结构与元素的性质1.原子结构与元素周期表的关系(1)主族(3)过渡元素(副族和第Ⅷ族):(n-1)d1~10n s1~2(Pd、镧系和锕系元素除外)。
3.元素周期表的分区与价电子排布的关系(1)周期表的分区(2)各区价电子排布特点4.电离能6.对角线规则在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,如。
高三化学总复习练习:第十二章 物质结构与性质(3)12-41

12-41[A层基础练]1.(2018·武汉模拟)下列有关晶体的说法中,不正确的是()A.晶体中一定存在化学键B.已知晶胞的组成就可推知晶体的组成C.分子晶体在晶体态或熔融态下均不导电D.原子晶体中只存在共价键,不可能存在其他类型的化学键【解析】稀有气体形成的晶体中只存在范德华力没有化学键,A错误;晶胞是描述晶体结构的基本单元,因此已知晶胞的组成就可推知晶体的组成,B正确;分子晶体在晶体态或熔融态下均不能电离出离子,不导电,C正确;原子间通过共价键形成的空间网状结构的晶体是原子晶体,因此原子晶体中只存在共价键,不可能存在其他类型的化学键,D正确.【答案】A2.(2018·邯郸模拟)关于晶体的下列说法正确的是()A.任何晶体中,若含有阳离子就一定有阴离子B.原子晶体中只含有共价键C.原子晶体的熔点一定比金属晶体的高D.离子晶体中只含有离子键,不含有共价键【解析】金属晶体是由金属阳离子和自由电子构成的,所以有阳离子不一定有阴离子,A错误;原子晶体中原子间以共价键相结合,B正确;金属晶体有的熔点很高如钨,所以原子晶体的熔点不一定比金属晶体的高,C错误;离子晶体中也可能含有共价键,如NaOH属于离子晶体,既含有离子键,又含有共价键,D错误。
【答案】B3.(2018·贵阳模拟)金属晶体中金属原子有三种常见的堆积方式,六方堆积(镁型)、面心立方堆积(铜型)和体心立方堆积(钾型),图(a)、(b)、(c)分别代表这三种晶胞的结构,其晶胞内金属原子个数比为()A.11∶8∶4 B.3∶2∶1C.9∶8∶4 D.21∶14∶9【解析】a中原子个数=12×错误!+2×错误!+3=6,b中原子个数=8×错误!+6×错误!=4,c中原子个数=1+8×错误!=2,所以其原子个数比是6∶4∶2=3∶2∶1。
【答案】B4.(2018·仙桃模拟)下面有关晶体的叙述中,错误的是() A.白磷晶体中,分子之间通过共价键结合B.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子C.在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或Na+)D.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏【解析】A项,白磷晶体为分子晶体,分子之间通过范德华力结合,错误;B项,金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子,正确;C项,在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或Na+),正确;D项,离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,分子间作用力被破坏,化学键不被破坏,正确。
高考化学一轮复习 第12章 物质结构与性质 第2讲 分子结构与性质PPT课件

(1)通过物质的结构式,可以快速有效地判断键的 种类及数目;判断成键方式时,需掌握:共价单键 全为σ键,双键中有一个σ键和一个π键,三键中有 一个σ键和两个π键。
(2)σ键比π键稳定。
题组二 键参数的应用 3.(教材改编)下列说法中正确的是( ) A.分子的键长越长,键能越高,分子越稳定 B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原 子间不能形成共价键 C.水分子可表示为H—O—H,分子的键角为180° D.H—O键键能为462.8 kJ·mol-1,即18 g H2O分解 成H2和O2时,消耗能量为2×462.8 kJ
对电子受激发而成为单电子,B项错误;因为单 键都是σ键,双键中有一个σ键和一个π键,σ键的 键能大于π键的键能,故双键键能小于单键键能的 两倍,C项错误;因为不同元素的电负性是不同 的,所以不同元素原子间的化学键至少有弱极性, D项正确。
答案:D
2.(1)Zn 的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2, 1 mol 该配合物中含有 σ 键的数目为________。 (2)CaC2 中 C22-与 O22+互为等电子体,O22+的电子式可表示 为 ____________ ; 1 mol O2 + 2 中 含 有 的 π 键 数 目 为 ________。 (3)下列物质中,①只含有极性键的分子是______,(填字母, 下同)②既含离子键又含共价键的化合物是________;
【典例1】 (高考组合题)(1)(2015·新课标Ⅰ卷)碳在 形成化合物时,其键型以共价键为主,原因是 ________。CS2分子中,共价键的类型有________。
(2)(2014·新课标Ⅰ卷)1 mol乙醛分子中含有的σ键的数 目为________。
(3)(2014·新课标Ⅱ卷)O、N、C的氢化物分子中既含 有极性共价键、又含有非极性共价键的化合物是 _________(填化学式,写出两种)。
人教版高中化学高考第一轮复习专题12《物质结构和性质》测试卷(解析版)

人教版高中化学高考第一轮复习专题12《物质结构与性质》测试卷一、单选题(共15小题)1.只有阳离子而没有阴离子的晶体是()A.金属晶体B.原子晶体C.离子晶体D.分子晶体2.下列有关电子云和原子轨道的说法正确的是()A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云B. s轨道呈球形,处在该轨道上的电子只能在球壳内运动C. p轨道呈纺锤形,随着电子层的增加,p能级原子轨道也在增多D.与s轨道相同,p轨道的平均半径随电子层的增大而增大3.在乙烯分子中有5个σ键和1个π键,它们分别是()A. sp2杂化轨道形成σ键,未杂化的2p轨道形成π键B. sp2杂化轨道形成π键,未杂化的2p轨道形成σ键C. C—H之间是sp2杂化轨道形成σ键,C—C之间是未杂化的2p轨道形成π键D. C—C之间是sp2杂化轨道形成σ键,C—H之间是未杂化的2p轨道形成π键4.下列关于σ键和π键的理解不正确的是()A.σ键能单独形成,而π键一定不能单独形成B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转C.HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的D.气体单质中一定存在σ键,可能存在π键5.用过量的硝酸银溶液处理含有0.01 mol氯化铬(CrCl3·6H2O)的水溶液,生成0.02 mol AgCl沉淀,此氯化铬最可能是()A. [Cr(H2O)6]Cl3B. [Cr(H2O)5Cl]Cl2·H2OC. [Cr(H2O)4Cl2]Cl·2H2OD. [Cr(H2O)3Cl3]·3H2O6.对Na、Mg、Al的有关性质的叙述正确的是()A.碱性:NaOH<Mg(OH)2<Al(OH)3B.第一电离能:Na<Mg<AlC.电负性:Na>Mg>AlD.还原性:Na>Mg>Al7.下列各微粒属于等电子体的是()A. N2O4和NO2B. CH4和NH3C. C2H6和N2HD. CO2和NO28.下列粒子中可能存在配位键的是( )A. CO2B. H3O+C. CH4D. H2SO49.有X,Y,Z,W,M五种短周期元素,其中X,Y,Z,W同周期,Z,M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高,硬度大,是一种重要的半导体材料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学一轮总复习:第十二章物质结构与性质目录第1节原子结构与物质的性质第2节分子结构与性质第3节晶体结构与性质第1节原子结构与物质的性质1.在多电子原子中,轨道能量是由以下哪些因素决定( )①能层②能级③空间伸展方向④自旋状态A.①②B.①④C.②③D.③④答案 A解析在多电子原子中,轨道能量是由主量子数和角量子数决定,n代表主量子数,主要是决定原子的电子占据哪个电子能层。
主量子数越大则电子占据更高的电子能层,原子的能量越高;主量子数越小则电子占据更低的电子能层,原子的能量越低;l代表角量子数,主要决定原子的电子占据同一个电子层的哪个亚电子层。
主量子数相同时,电子都处在同一个电子层。
此时,角量子数越大,则电子占据更高的能级,原子的能量越高;角量子数越小,则电子占据更低的能级,原子的能量越低;所以轨道能量由电子能层和电子能级决定。
2.根据泡利的原子轨道能级图和“能级交错”现象,原子轨道的能量高低顺序是:ns<(n-3)g<(n-2)f<(n-1)d<np(n为能层序数,g能级中有9个轨道),则未来的第八周期应包括的元素的种类是( )A.32 B.50C.64 D.128答案 B解析第七周期排满时,最后一种元素的价电子排布为7s27p6,第八周期排满时最后一种元素的价电子排布为8s28p6,从8s1到8s28p6,其中间增排了8s25g1~186f147d108p6,核电荷数增加了50,故第八周期元素有50种。
3.下列说法中正确的是( )A.3p2表示3p能级有两个轨道B.M能层中的原子轨道数目为3C.1s22s12p1表示的是激发态原子的电子排布D.处于同一轨道上的电子可以有多个,它的运动状态完全相同答案 C解析A项,3p能级有三个轨道,3p2表示3p能级有两个电子,而不是两个轨道,故A项错误;B项,M层有s、p、d能级,s能级有1个轨道、p能级有3个轨道、d能级有5个轨道,轨道数=1+3+5=9,故B项错误;C项,1s22s12p1,根据能量最低原理,其基态应为1s22s2,1个2s电子被激发到2p能级上为激发态,故C项正确;D项,同一轨道上最多排2个电子,其自旋方向相反,所以它们的状态并不完全相同,故D项错误。
4.下列电子层中,包含有f能级的是( )A.K电子层B.L电子层C.M电子层D.N电子层答案 D解析A项,K能层是第一能层,只有1个能级,1s能级,故A项不选;B 项,L能层是第二能层,含有2个能级,分别是2s、2p能级,故B项不选;C 项,M能层是第三能层,含有3个能级,分别是3s、3p、3d能级,故C项不选;D项,N能层是第四能层,含有4个能级,分别是4s、4p、4d、4f能级,故D 项选。
5.下列现象和应用与电子跃迁无关的是( )A.激光B.焰色反应C.燃烧放热D.霓虹灯答案 C解析A项,电子跃迁产生光子与入射光子具有相关性。
即入射光与辐射光的相位相同。
如果这一过程能够在物质中反复进行,并且能用其他方式不断补充因物质产生光子而损失的能量。
那么产生的光就是激光,与电子跃迁有关,故A 项错误;B项,当碱金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使火焰呈现颜色,与电子跃迁有关,故B项错误;C项,燃烧放热是化学能转化为热能,与电子跃迁无关,故C项正确;D项,各种气体原子的能级不同,跃迁时发射光子的能量各异,因此利用不同气体可以制作五颜六色的霓虹灯,与电子跃迁有关,故D项错误。
6.下列变化中释放能量的是( )A.1s22s22p63s1→1s22s22p6 B.N≡N(g)→N(g)+N(g)C.2px 22py12pz1→2px12py12pz2 D.2H(g)→H—H(g)答案 D解析A项,1s22s22p63s1→1s22s22p6,由基态转化成激发态,需要吸收能量,故A项错误;B项,N≡N(g)→N(g)+N(g),化学键的断裂,吸收能量,故B项错误;C项,2px 22py12pz1→2px12py12pz2,由于电子的跃迁发生在能量相同的能级中,故无能量变化,故C项错误;D项,2H(g)→H—H(g),化学键的形成,放出能量,故D项正确。
7. (1)某储氢材料是短周期金属元素M的氢化物。
M的部分电离能如下表所示:I1/ (kJ·mol-1) I2/(kJ·mol-1)I3/(kJ·mol-1)I4/(kJ·mol-1)I5/(kJ·mol-1)738 1 451 7 733 10 540 13 630于”“小于”或“等于”)738 kJ·mol-1,原因是__________________________________________________。
(2)第一电离能介于B、N之间的第二周期元素有________种。
(3)如图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是________(填“A”“B”“C”或“D”)。
答案(1)Mg 小于Mg、Al位于同一周期,Mg最外层电子排布式为3s2,而Al最外层电子排布式为3s23p1,当3p处于全充满、半充满或全空时较稳定,因此,失去p能级的1个电子相对比较容易,故Al原子的第一电离能小于738kJ·mol-1(2)3 (3)D解析(1)M的第三电离能突增,则M最外层有2个电子,故M为Mg。
(2)同一周期中元素的第一电离能随原子序数递增,呈现逐渐升高的趋势,但是在第二周期中,Be的第一电离能大于B,N的第一电离能大于O,故第一电离能介于B和N之间的有Be、C、O三种。
(3)A为N,A、C为第ⅤA族元素,其第一电离能大于第ⅥA族的,同一主族从上往下第一电离能逐渐减小,所以D的电离能最小。
8.对碳原子核外两个未成对电子的描述,正确的是( )A.电子云形状不同B.自旋方向相同C.能量不同D.在同一轨道答案 B解析A项,碳原子核外两个未成对电子,都属于2p轨道,p轨道沿x、y、z轴的方向电子云密度大,呈现哑铃型,则电子云形状相同,故A项错误;B项,p轨道又分三个轨道,不同电子优先占据空轨道,并且自旋方向相同,所以碳原子核外两个未成对电子,自旋方向相同,故B项正确;C项,碳原子核外两个未成对电子,都属于2p轨道,能量相同,故C项错误;D项,p轨道又分三个轨道,不同电子优先占据空轨道,所以碳原子核外两个未成对电子,不在同一轨道,故D项错误。
9.下列说法中,正确的是( )A.s区和p区都是主族元素,d区都是副族元素B.同一主族元素,从上到下,元素的第一电离能依次增大C.同电负性变化规律一样,从左到右,同周期元素的第一电离能依次增大D.原子轨道能量比较:E(3d)>E(4s)>E(3s)答案 D解析A项,s区为ⅠA~ⅡA主族元素(包含He),p区包含ⅢA~ⅦA族以及零族元素(除He外),d区包含副族和第Ⅷ族,故A项错误;B项,同一主族元素,从上到下,元素的第一电离能依次减小,故B项错误;C项,从左到右,同周期元素的第一电离能依次增大趋势,但出现反常,当原子轨道中电子处于全满、半满时最稳定,第ⅡA族元素原子的ns轨道上电子排布达到全满,第VA族元素的p轨道达到半满,处于稳定状态,难失去电子,第一电离能ⅡA>ⅢA,VA>VIA,故C项错误;D项,原子轨道能量比较,E(3d)>E(4s)>E(3p)>E(3s),故D项正确。
10.下列元素性质的递变规律正确的是( )A.第一电离能:N>O>C B.电负性:F>N>OC.最高正价:F>O>Si D.原子半径:P>N>C答案 A解析A项,第VA族大于相邻主族原子的电离能,第一电离能:N>O>C,故A项正确;B项,同周期非金属性增强,电负性:F>O>N,故B项错误;C 项,F、O元素无最高正价,故C项错误;D项,同一周期元素原子半径从左到右逐渐减小,同主族原子半径依次增大,原子半径:P>C>N,故D项错误。
11.已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。
请根据下表数据判断,错误的是( )A.元素XB.元素Y是ⅢA族元素C.元素X与氯形成化合物时,化学式可能是XClD.若元素Y处于第三周期,它可与冷水剧烈反应答案 D解析X为第ⅠA族元素,Y为第ⅢA族元素;D项,若元素Y处于第三周期,则Y为Al,Al不与冷水反应。
12.硼及其化合物在生产、生活中有着广泛的应用。
(1)Ga与B同主族,Ga的基态原子的电子排布式为________________________,最高能层上的未成对电子数为________。
(2)从原子结构的角度分析,B、C、N、O元素的第一电离能由大到小的顺序为________。
(3)已知H3BO3与足量KOH溶液反应的离子方程式为H3BO3+OH-===B(OH)4-,写出硼酸的电离方程式:______________________________________。
(4)硼氢化钠(NaBH4)是一种常用的还原剂,其中Na、B、H元素中电负性最大的是________;硼氢化钠在热水中生成硼酸钠和氢气,写出该反应的化学方程式:________________________________________________。
答案(1)1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1 1(2)N>O>C>B(3)H3BO3H2BO3-+H+或H3BO3+H2O B(OH)4-+H+(4)H NaBH4+4H2O===Na[B(OH)4]+4H2↑解析(1)Ga与B同主族,处于Al元素的下一周期,则Ga原子核外电子数为13+18=31,结合核外电子排布规律可知,Ga基态原子核外电子排由式为1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1,其外围电子排布式为4s24p1,最高能层为N层,其中4s轨道排满2个电子,4p轨道上的1个电子未成对,则其最高能层上的未成对电子数为1。
(2)同周期元素原子的第一电离能随原子序数的递增呈增大趋势,但ⅡA>ⅢA,ⅤA>ⅥA族;B、C、N、O元素同处于第二周期,则第一电离能由大到小的顺序为N>O>C>B。
(3)H3BO3与足量KOH溶液发生中和反应,生成相应的硼盐酸和水,离子方程式为H3BO3+OH-===B(OH)4-,则H3BO3电离生成H2BO3-或B(OH)4-,电离方程式为H 3BO3H2BO3-+H+或H3BO3+H2O B(OH)4-+H+。
