1 工程热力学基本概念 (1)
工程热力学-01 基本概念及定义

平衡状态1
p1 v1
p
p2
2
压容图 p-v图
平衡状态2
p1
1
p2 v2
O
v2
v1
v
12
1-4 状态方程式
在平衡状态下,由气态物质组成的系统,只要知道两个独立的 状态参数,系统的状态就完全确定,即所有的状态参数的数值随之 确定。这说明状态参数间存在某种确定的函数关系,状态参数之间 存在着确定的函数关系,这种函数关系就称为热力学函数。
(2)当系统处于热力学平衡状态时,只要没有外界的影响, 系统的状态就不会发生变化。
(3)整个系统可用一组具有确定数值的温度、压力及其他参
? 数来描述其状态。
10
经验表明,确定热力学系统所处平衡状态所需的独立状 态参数的数目,就等于系统和外界间进行能量传递方式的数 目。对于工程上常见的气态物质组成的系统,系统和外界间传递 的能量只限于热量和系统容积变化所作的功两种形式,因此只需 要两个独立的状态参数即可描述一个平衡状态。
3、平衡状态、稳定状态、均匀状态
(1)关于稳定状态与平衡状态
稳定状态时,状态参数虽不随时间改 变,但它是依靠外界影响来维持的。而平 衡状态是不受外界影响时,参数不随时间 变化的状态。
85℃ 20℃
90℃
15℃
铜棒
平衡必稳定,稳定未必平衡。
(2)关于均匀状态与平衡 水
质统称为外界。 通常选取工质作为热力学系统,把高温热源、低温热源
等其他物体取作外界。
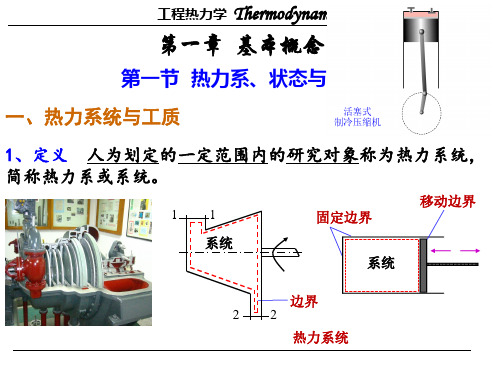
3、边界 ——热力学系统和外界之间的分界面称为边界。
边界可以是固定的,也可以是移动的; 边界可以是实际的,也可以是假想的。
3
二、热力学系统的分类 依据——有无物质或能量的交换
工程热力学 基本概念

C 表的读数 pgc= pc-B=9.013-1.013=8bar 1-6、一气缸活塞装置内的气体由初态 p1=0.3MPa 。 V1=0.1m 3 ,缓慢膨胀到 V2=0.2m3 , 若过程中压力和体积间的关系为 pVn=常数,试分别求出: (1)n=1.5;( 2)n=1.0 ;( 3)n=0 时的膨胀功。 解:选气缸内的气体为热力系 (1)由 p1V1n p 2 V2n C1 得
30 103 J 30kJ
W pdV
V1V2V2源自V1C2 dV V
C 2 ln
V2 V p1V1 ln 2 V1 V1
. .
= ( .´ )´ . ln
20.79103 J 20.79kJ
(3)对 n=0 时,即 p1 =p2=C 3,则
W =ò
V
V
pdV = p (V - V ) = ( .´ ) (. - .)
一、基本概念 1-1、密闭容器内气体的绝对压力不变。试问其表压力是否有可能变化? 答:由绝对压力 p 和表压力 pg 的关系式 p=pamb +pg 可知,当环境压力 pamb 变化时,其表 压力也可能变化。 1-2、热力系与外界在没有能量和物质交换的情况下,热力系的状态能否发生变化? 答:在系统与外界没有作用的条件下,当系统处于平衡状态时,其状态就不可能再发生 变化;当系统处于非平衡状态时,其状态还会变化。 1-3、判断下列过程中哪些是( 1)可 逆 的 ; (2)不可逆的; ( 3)可以是可逆的,并扼要 说明不可逆的原因。 (1)对刚性容器内的水加热,使其在恒温下蒸发。 (2)对刚性容器内的水作功,使其在恒温下蒸发。 (3)对刚性容器中的空气缓慢加热,使其从 50℃升温到 100℃。 解: ( 1)可以是可逆过程,也可以是不可逆过程,取决于热源温度与水温是否相等。若 两者不等,则存在外部的传热不可逆因素,便是不可逆过程。 (2)对刚性容器的水作功,只可能是搅拌功,伴有摩擦扰动,因而有内不可逆因素, 是不可逆过程。 (3)可以是可逆的,也可以是不可逆的,取决于热源温度与空气温度是否相等或随时 保持无限小的温差。 1-4、某电厂锅炉出口蒸汽压力由压力表读得 141kgf/cm2 ,汽轮机进口蒸汽压力表指示 值 135 kgf/cm2 ,凝汽器真空为 718mmHg ,炉膛内烟气的真空为 10mmH2O ,送风机的表压 力为 350 mmH2O 。 若当地大气压为 755 mmHg, 试确定各处的工质的绝对压力(用 Pa,MPa)。 解:1 mmHg=133.32Pa;1 mmH2 O =9.81Pa ;1 kgf/cm2=9.81 104Pa; 环境压力:pb =755133.32=100656.6 Pa 锅炉出口蒸汽压力:pB=pg1+pb=1419.81104 +100656.6=13932756.6 Pa =13.93 MPa 汽轮机进口蒸汽压力:pT =pg2+pb =1359.81104+100656.6=13344156.6 Pa =13.34 MPa 凝汽器压力:pc= pb - pv1=100656.6-718133.32=4932.84 Pa =0.0049 MPa 炉膛内烟气压力:pY = pb- pv2=100656.6-109.81=100558.5 Pa =0.1 MPa 送风机压力 pF=pg3 +pb =3509.81+100656.6=104090.1 Pa =0.1 MPa 1-5、如图所示。容器被一刚性壁分为两部分。 C 压力表 A 的读数为 6.3bar ;表 B 的读数为 1.7bar ; 大气压力为 1.013105Pa。试求:两部分容器内气体 的绝对压力及表 C 读数。 解:由题意可知表 B 的环境压力 pbB =pa,表 A 和表 C 的环境压力均为大气压力 B 右侧容器中的气体绝对压力 pa 为:pa =B+p gA =1.013+6.3=7.313bar 左侧容器中的气体绝对压力 pc 为:pc=pbB+pgB =7.313+1.7=9.013bar B A
工程热力学_基本概念

广延性参数:整个系统的某广延性参数值等于系 统中各单元体该广延性参数值之和,如系统的容 积、内能、焓、熵等。在热力过程中,广延性参数 的变化起着类似力学中位移的作用,称为广义位 移。
所吸收或放出的热量。
4.定压比热: c p
q p dT
dh dT
表明单位物量的气体在定压情况下升高或降低 1K
所吸收或放出的热量。
5.梅耶公式:
3
cp cv R
c' p c'v 0 R
Mc p Mcv MR R0
6.比热比:
c p c' p Mc p cv c'v Mcv
p
gi
Ri R
p
混合气体的比热容:
c g1c1+g2c2 +
n
gncn gici i 1
4
混合气体的容积比热容:
c ' r1c'1+r2c'2 +
n
rnc 'n ric 'i i 1
混合气体的摩尔比热容:
n
n
Mc M gici xiMici
i 1
制冷系数:
1
q2 w0
q2 q1 q2
式中
q1—工质向热源放出热量; q2—工质从冷源吸取热量;
w0—循环所作的净功。
供热系数:
2
q1 w0
q1 q1 q2
式中
工程热力学概念整理

⼯程热⼒学概念整理⼯程热⼒学与传热学概念整理⼯程热⼒学第⼀章、基本概念1.热⼒系:根据研究问题的需要,⼈为地选取⼀定范围内的物质作为研究对象,称为热⼒系(统),建成系统。
热⼒系以外的物质称为外界;热⼒系与外界的交界⾯称为边界。
2.闭⼝系:热⼒系与外界⽆物质交换的系统。
开⼝系:热⼒系与外界有物质交换的系统。
绝热系:热⼒系与外界⽆热量交换的系统。
孤⽴系:热⼒系与外界⽆任何物质和能量交换的系统3.⼯质:⽤来实现能量像话转换的媒介称为⼯质。
4.状态:热⼒系在某⼀瞬间所呈现的物理状况成为系统的状态,状态可以分为平衡态和⾮平衡态两种。
5.平衡状态:在没有外界作⽤的情况下,系统的宏观性质不随时间变化的状态。
实现平衡态的充要条件:系统内部与外界之间的各种不平衡势差(⼒差、温差、化学势差)的消失。
6.强度参数:与系统所含⼯质的数量⽆关的状态参数。
⼴延参数:与系统所含⼯质的数量有关的状态参数。
⽐参数:单位质量的⼴延参数具有的强度参数的性质。
基本状态参数:可以⽤仪器直接测量的参数。
7.压⼒:单位⾯积上所承受的垂直作⽤⼒。
对于⽓体,实际上是⽓体分⼦运动撞击壁⾯,在单位⾯积上所呈现的平均作⽤⼒。
8.温度T:温度T是确定⼀个系统是否与其它系统处于热平衡的参数。
换⾔之,温度是热⼒平衡的唯⼀判据。
9.热⼒学温标:是建⽴在热⼒学第⼆定律的基础上⽽不完全依赖测温物质性质的温标。
它采⽤开尔⽂作为度量温度的单位,规定⽔的汽、液、固三相平衡共存的状态点(三相点)为基准点,并规定此点的温度为273.16K。
10状态参数坐标图:对于只有两个独⽴参数的坐标系,可以任选两个参数组成⼆维平⾯坐标图来描述被确定的平衡状态,这种坐标图称为状态参数坐标图。
11.热⼒过程:热⼒系从⼀个状态参数向另⼀个状态参数变化时所经历的全部状态的总和。
12.热⼒循环:⼯质由某⼀初态出发,经历⼀系列状态变化后,⼜回到原来初始的封闭热⼒循环过程称为热⼒循环,简称循环。
13.准平衡过程:由⼀系列连续的平衡状态组成的过程称为准平衡过程,也成准静态过程。
1.2工程热力学基础知识

热力学相关的能量的总和. 热力学相关的能量的总和.
真空
真空
p1 V1
p2 V2
绝热系A
绝热系A
上面图示中的闭口绝热系A 上面图示中的闭口绝热系A中的黄色方块是一团 气体,它从状态1变化到状态2 气体,它从状态1变化到状态2,很显然,按照理 想气体状态方程进行分析,由于气体膨胀对外做 功,我们会得到u 功,我们会得到u1<u2的结论,但是根据能量守恒 定律,工质与外界无能量交换,因此工质的能量 总和应当不变,再经过进一步分析,我们会得到 u1+p1V1=u2+p2V2 即H1=H2的结论.
二,热力学第一定律及其应用
热力学第一定律其实就是能量守恒定律在热力学 领域中的应用,由于热力学领域总是把某一系统 作为研究对象,所以强调的是系统和外部环境的 总的能量守恒. 在对单一热力系统进行分析的时候,系统本身能 量变化 ,系统与外界的功交换 量变化E,系统与外界的功交换W,系统与外 界的热交换 界的热交换Q,还有涉及物质进出系统带来和带 出的能量 出的能量e之间满足下列关系:
(五)热力过程
热力过程: 热力过程:系统从一个状态变化到另外一个状态 的时候经历的所有的中间状态的集合称为热力过 程,简称过程.如果系统经历一系列过程最终又 回到初始状态,则说这些过程构成一个热力循环 回到初始状态,则说这些过程构成一个热力循环. 热力循环. 准静态过程:在一个热力过程中,初始状态和最 准静态过程:在一个热力过程中,初始状态和最 终状态都是平衡态,从初始状态变化到最终状态 说明了原有平衡被打破,然后经历一些列变化最 说明了原有平衡被打破,然后经历一些列变化最 后形成了新的平衡.这个变化不会是一瞬间完成 后形成了新的平衡.这个变化不会是一瞬间完成 的,因此意味着在这两个状态之间,系统经历了 一些列连续的,依次相差为无穷小的平衡状态, 一些列连续的,依次相差为无穷小的平衡状态, 这个过程称为准静态过程.例如系统原来的状态 用参数表示为(A,B,C,D,E,F),最终状态表示为 用参数表示为(A,B,C,D,E,F),最终状态表示为 (A',B',C',D',E',F'),如果该过程是准静态过程, ,B',C',D',E',F' 那么6 那么6个参数的变化全部是连续的,如果表示在状 态参数坐标图上,有关6 态参数坐标图上,有关6个参数的曲线全部应当是 连续的.
工程热力学(基本概念)
国际实用温标的固定点
平衡状态
平衡氢三相点 平衡氢沸点 氖沸点 氧三相点 氧冷凝点
国际实用温标指定
值
T,K
t,℃
13.81 -259.34
20.28 -252.87
20.102 -246.048
54.361 -218.789
90.183 -182.962
平衡状态
水三相点 水沸点
锌凝固点 银凝固点 金凝固点
一、热力过程
定义:热力系从一个状态向另一个状态变化时所经 历的全部状态的总和。
二、准平衡(准静态)过程
准平衡过程的实现
工程热力学 Thermodynamics
二、准平衡(准静态)过程
定义:由一系列平衡态组成的热力过程 实现条件:破坏平衡态存在的不平衡势差(温差、
力差、化学势差)应为无限小。 即Δp→0 ΔT→0 (Δμ→0)
工程热力学 Thermodynamics
三、可逆过程
力学例子:
定义: 当系统完成某一热力过程后,如果有可能使系统再
沿相同的路径逆行而恢复到原来状态,并使相互中所涉 及到的外界亦恢复到原来状态,而不留下任何变化,则 这一过程称为可逆过程。
实现条件:准平衡过程加无耗散效应的热力过程 才是可逆过程。
工程热力学 Thermodynamics
用来实现能量相互转换的媒介物质称为工质。
理想气体
工 质
实际气体
蒸气
工程热力学 Thermodynamics
二、平衡状态
(一)热力状态:热力系在某一瞬间所呈现的宏观
物理状况。(简称状态)
(二)平衡状态 1、定义:一个热力系统,如果在不受外界影响的条件下,
系统的状态能够始终保持不变,则系统的这种状态称为平衡 状态。
热工基础 1 第一章 基本概念
平衡不一定均匀,单相平衡态则一定是均匀的
平衡:时间上 均匀:空间上
Fundamentals of thermal engineering
热 工 基 础
1-2 平衡状态和状态参数
2、基本状态参数 热力学中常用的状态参数有压力、温度、比体 积、比热力学能、比焓、比熵等,其中可以直接测 量的状态参数如压力、温度、比体积,称为基本状 态参数。 (1)压力 单位面积上所受到的垂直作用力(即压强)
ds 0 , q 0 , 系统吸热; ds 0 , q 0 , 系统放热。 ds 0 , q 0 ,系统绝热,定熵过程。
比体积和密度二者相关,通常以比体积作为状态参数 。
Fundamentals of thermal engineering
热 工 基 础
1-3 状态方程与状态参数坐标图 1 状态公理 对于和外界只有热量和体积变化功(膨胀功或 压缩功)的简单可压缩系统,只需两个独立的参数 (如p、v;p、T 或v、T)便可确定它的平衡状态。
温度相等
热平衡
Fundamentals of thermal engineering
热
工基Βιβλιοθήκη 础1-2 平衡状态和状态参数
② 热力学温标(绝对温标) 英国物理学家开尔文(Kelvin)在热力学第二定 律基础上建立,也称开尔文温标。用符号 T 表示, 单位为 K(开)。
热力学温标取水的三相点为基准点,并定义其 温度为273.16 K。温差1K相当于水的三相点温度的 1/273.16.。
规定:系统对外界作功“+”,外界对系统作功“-”
膨胀:dv > 0 , w > 0
Fundamentals of thermal engineering
工程热力学第1章-基本概念
两者关系:
v
1
河北理工大学
1-4 平衡状态
工程热力学
一、平衡状态(thermodynamic equilibrium state)
1.定义:无外界影响系统保持状态参数不随时间而改变的状态
热平衡(thermal equilibrium) : 在无外界作用的条件下,系统内部、系统与外界 处处温
度相等。
河北理工大学
四、逆向循环(reverse cycle)
▲制冷循环(refrigeration cycle) ▲热泵循环(heat-pump cycle)
工程热力学
一般地讲:输入净功; 在状态参数图逆时针运行; 吸热小于放热。
河北理工大学
五、循环经济性指标:
收益 代价
动力循环: 热效率(thermal efficiency)
河北理工大学
三、热量(heat)
1.定义:仅仅由于温差而 通过边界传递的能量。
2.符号约定:系统吸热“+”; 放热“-”
3.单位: J kJ
4.计算式及状态参数图
(T-s图上)表示
2
Q TdS
(可逆过程)
1
δQ TdS
热量是过程量
河北理工大学
工程热力学
四、热量与功的异同:
1.均为通过边界传递的能量;
热力学温标单位:开尔文,K。水的三相 点的温度,即固相、液相和气相平衡共 存状态的温度作为基准点,并规定为 273.16K。
t T 273.15
C
K
河北理工大学
河北理工大学
工程热力学
工程热力学
华氏温标和摄氏温标
{t} ℃=5/9[{t} ℉-32] {t} ℉ =9/5{t} ℃ +32
工程热力学基本概念1绝热刚性容器内的气体通过阀门向
工程热力学第一章基本概念1-1绝热刚性容器内的气体通过阀门向气缸充气。
开始时气缸内没有气体,如图1.1所示。
气缸充气后,气体推动气缸内的活塞向上移动,如图1.2所示。
设管道阀门以及气缸均可认为是绝热的。
若分别选取开口系统与闭口系统,试说明它们的边界应该如何划定?这些系统与外界交换的功量与热量又如何?解:(1)若以容器内原有的气体作为分析对象,属于闭口系统。
容器放气前,边界如图1.1中的虚线所示。
放气后边界如图1.2中的虚线所示。
气体对活塞作的功W是闭口系统与外界交换的功量。
气体通过活塞与外界交换的热量Q是此闭口系统的传热量。
图1.1 图1.2图1.3 图1.4(2)若以容器放气后残留在容器内的气体作为分析对象,同样也是闭口系统。
这时放气前的边界如图1.3中的虚线所示。
放气后的边界如图1.4的虚线表示。
残留气体对离开容器的那部分放逸气体所作的功,是本闭口系统与外界交换的功,残留气体与放逸气体之间交换的热量是本系统的传热量。
(3)类似地若以放逸气体为分析对象,同样也是闭口系统。
其边界将如图1.3和图1.4中的点划线所示。
此闭口系统与外界交换的功量除了与残留气体之间的功量(大小与第二种情况的相同,方向相反)外,还应包括对活塞所作的功。
同样,除了与残留气体之间的传热量(大小与第二种情况的相同,方向相反)外,还应包括通过活塞与外界交换的热量。
(4)若以容器或气缸为分析对象,则均属开口系统,容器的壁面或气缸与活塞的壁面为其边界。
前者以对放逸气体作出的流动功与传热量为系统与外界交换的功量与热量,后者以对活塞及管道内气体的功量与热量为系统与外界交换的功量与热量。
1-2温度为100℃的热源,非常缓慢地把热量加给处于平衡状态下的0℃的冰水混合物,试问:1、冰水混合物经历的是准静态过程吗?2、加热过程是否可逆?解:此热力过程为准静态过程,因为此热力过程的弛豫时间很短,热源非常缓慢地把热量加给冰水混合物,则冰水混合物重建热力平衡的时间远远小于传热过程对冰水混合物平衡状态的破坏,所以可以近似地把此热力过程看作是准静态过程。
工程热力学---第1章 基本概念
pv RgT
实际气体(real gas; imperfect gas)的状态方程
范德瓦尔方程
R—K方程
a p 2 v b v
RgT
a p 0.5 v b T v(v b)
RgT
(a,b为物性常数)
27
三、状态参数坐标图
一简单可压缩系只有两个独立参数,所以 可用平面坐标上一点确定其状态,反之任一状 态可在平面坐标上找到对应点,如:p-v、T-s。
a)刚性的或可变形的或有弹性的 b)固定的或可移动的 c)实际的或假想的
边界示意图
10
汽缸-活塞装置(闭口系例)
11
汽车发动机(开口系示例)
12
热力系分类
按照组元和相数分 单元系 多元系 按系统与外界能质交换分 单相系 复相系
闭口系—closed system 控制质量CM) —没有质量越过边界 开口系—open system (控制体积CV) —通过边界与外界有质量交换
所有状参一一对应相等
简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
状态法则:系统独立状态参数的数目N等于系统对外所 作广义功的数目n加1,即N=n+1.
20
基本状态参数
温度
热力学第零定律(R.W. Fowler in 1931) 如果两个系统分别与第三个系统处于 热平衡,则两个系统彼此必然处于热平衡。
dx 0
ห้องสมุดไป่ตู้
2、分类 #可逆循环与不可逆循环,状态参数坐标图上表示。 正向循环:输出功,热能 目的 机械能 Q 高温热源
逆向循环:消耗功,低温热源
二、正向循环(动力循环)
wnet t 1 q1
6 6 6
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Proportional to the quantity of the system Example: volume, energy, …
比参数
Specific property
两个广度参数之比,是强度参数。
Ratio between two extensive properties Example: density, specific volume, …
相平衡 Phase
化学平衡 Chemical
系统内无温差
No difference of temperature
系统内无压差
No difference of pressure
相间无化学势差
No difference of chemical potential
反应物生成物间无化学势差
No difference of chemical potential
系统和环境(外界)的分界面 叫做边界或者控制面。
The interface separates the system from its surroundings.
It can be real or imaginary.
Classification (热力系统分类)
按有无物质交换 封闭系统 Closed System 敞开系统 Open System
有缘学习更多+谓ygd3076考证资料或关注桃报:奉献教育(店铺)
Thermodynamic System
封闭系统:与外界只有热或功的能 量交换而无物质交换的系统。 Mass cannot cross the boundaries of a closed system, but energy can.
Equation of State (状态方程)
自由度 (Degree of freedom)
热力系统中描述状态所需的独立强度变量数。 The number of intensive properties required to fix the state of a system.
相律 (Phase rule)
Dimensional Homogeneity, SI units
Secondary or derived dimensions such as volume, velocity, energy, …
Equilibrium state (平衡状态)
系统的宏观状态不随时间而变。
A state in which the system is not capable of spontaneous change from one state to another state.
参数/性质 用来描述系统所处状态的宏观物理量。
Property Any characteristic of a system is called a property.
基本参数
Basic Property
导出参数
Derived Property
直接测量
directly measured
计算获得
calculated from basic ones
因其质量恒定,又叫控制质量系统 (control mass)。
边界可以是固定的,也可以有位 移或变形的。 A closed system with a moving boundary.
Thermodynamic System
敞开系统:与外界既有能量交换又有 物质交换的系统。 Both mass and energy can cross the boundaries of an open system.
简单系统
Simple
与外界只交换热量和一种形式功的热 力系统。
Only heat and one type of work can cross its boundary.
绝热系统
Adiabatic
与外界没有热量交换的热力系统。 No heat can cross its boundary.
孤立系统
Isolat ( y )x dy
Intensive & extensive properties (强度参数与广度参数)
强度参数
Intensive
广度参数
Extensive
与所含物质数量无关。
Independent of the quantity of the system Example: temperature, pressure, …
T (R) 1.8 t(o C)
Density, Specific Volume and Specific Gravity
密度 (Density): mass per unit volume
m
(kg/m3 )
V
比容 (Specific Volume): Volume per unit mass, the reciprocal of density
系统内推动力或者势差为 0。
In an equilibrium state there are no unbalanced driving forces (or potentials) within the system.
A system at two different states.
Note:
动态平衡,宏观状态不变。
因其体积固定,又叫控制容积系统 (control volume, CV)。
A control volume with fixed A control volume with real
and moving boundaries.
and imaginary boundaries.
Thermodynamic System
热力学第零定律 The zeroth law of thermodynamics
如果两个系统分别与另一系统处于热平衡,这两个系统 也处于热平衡。 If two bodies are in thermal equilibrium with the third body, they are also in thermal equilibrium with each other.
pg pa pb
pv pb pa
pb
pv
Atmosphere
真空度
pa
pb
大气压
绝对压力
Absolute Vacuum
pa 0
绝对真空
pg
表压
pb
大气压
pa
绝对压力
Absolute Vacuum
Temperature (温度)
表示物体冷热程度的参数。
A measure of “hotness” or “coldness”.
有缘学习更多+谓ygd3076考证资料或关注桃报:奉献教育(店铺)
Dimensions and Units (量纲与单位)
量纲 单位
Any physical quantity can be characterized by dimensions. The magnitudes assigned to the dimensions are called units.
Pressure (压力)
沿垂直方向上作用在单位面积上的力。
A normal force exerted on a fluid per unit area.
SI
N Pa m2
bar 105Pa
Pressure Measurement
Absolute, Gage and Vacuum Pressures
v1
比重 (Specific Gravity): the ratio of densities between a substance
and water at 4oC.
SG
a dimensionless quantity
Water
Characteristics of State Property (状态参数的特性)
按能量交换形式
简单系统 Simple System 绝热系统 Adiabatic System 孤立系统 Isolated System
按工质状况
单组分系统 Single Component System 多组分系统 Multi-Component System 单相系统 Single Phase System 多相系统 Multi-phase System
oF
K
朗肯温标
Rankine scale
R
水的沸点 100.00
Boiling or steam point
212.00
373.15
671.67
水三相点 0.01
Triple point
水的冰点
Freezing or ice point 0.00
32.02 32.00
273.16 273.15
491.69 491.67
基本概念
Basic Concepts
Outline
1.1 热力系统 • Definition of Thermodynamic System 1.2 热力状态 • Concepts of State and its properties • Pressure, Temperature and Specific Volume 1.3 热力过程 • Quasi-equilibrium Process and Reversible Process • Thermodynamic Cycle
与外界既无能量交换也无物质交换的 热力系统。
Neither mass nor energy can cross its boundary.
Thermodynamic State
