化学平衡图像分析经典例题与习题附答案.docx
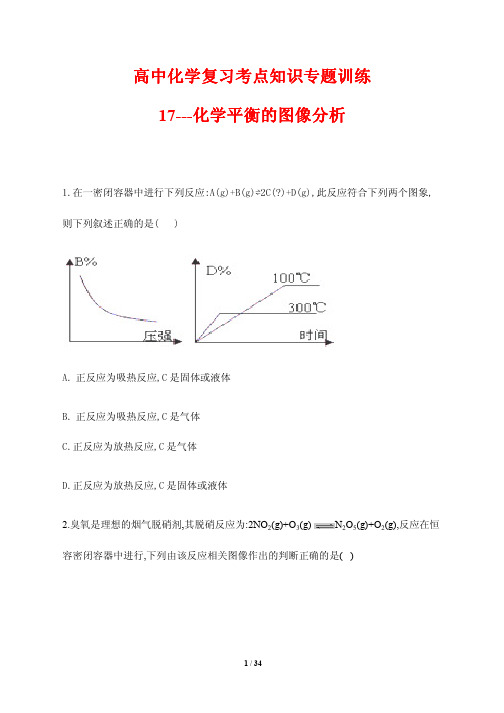
选修四《化学平衡图像及等效平衡》专题及答案

化学平衡图像及等效平衡昨天专题一、选择题(每小题5分,每小题有1-2个正确选项)1.向某密闭容器中充入1mol CO和2mol H2O(g),发生反应:CO+H2O(g)催化剂高温CO2+H2。
当反应达到平衡时,CO的体积分数为x。
若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是() A.0.5mol CO+2mol H2O(g)+1mol CO2+1mol H2B.1mol CO+1mol H2O(g)+1mol CO2+1mol H2C.0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4mol H2D.0.5mol CO+1.5mol H2O(g)+0.5mol CO2+0.5mol H22.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是()A.CO2(g)+2NH3(g)CO(NH2)2(s)+H2O(g);ΔH<0B.CO2(g)+H2(g)CO(g)+H2O(g);ΔH>0C.CH3CH2OH(g)CH2===CH2(g)+H2O(g);ΔH>0D.2C6H5CH2CH3(g)+O2(g)2C6H5CH===CH2(g)+2H2O(g);ΔH<03.用来表示可逆反应2A(g)+B(g)2C(g)(正反应为放热反应),下图表示的图像中正确的为()4.如下图所示,φ(X)为气态反应物在平衡时混合物中的体积分数,T为温度。
符合该曲线的反应是()A.2NH3(g)N2(g)+3H2(g)(正反应为吸热反应)B.H2(g)+I2(g)2HI(g)(正反应为放热反应)C.4NH3(g)+5O2(g)4NO(g)+6H2O(g)(正反应为放热反应) D.C(s)+H2O(g)H2(g)+CO(g)(正反应为吸热反应)5.在恒温、恒容下,有反应:2A(g)+2B(g)C(g)+3D(g),现从两条途径分别建立平衡。
化学平衡图像专题(超详细版)

v
v正
v逆
T1
T2
T
判断正反应是放热还是吸热?
正反应吸热
精选课件
28
五、其它: 对于反应mA(g)+nB(g)
v
v正 v逆
pC(g)+qD(g)
T 判断正反应是放热还是吸热?
正反应吸热
精选课件
29
例10 甲图中C%表示反应物的百分含量,t表示反应时 间,乙图中v表示反应速率,p表示压强,T1、T2表示
,并作出其随反应温度(T)变化的关系图。下列示意图中
,可能与实验结果相符的是 BD
精选课件
32
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
精选课件
30
五、其它:
对于反应mA(g)+nB(g)
pC(g)+qD(g)
C%
A%
450℃
T
•正反应放热
P1
P
•m+n<p+q
精选课件
31
12.(2009年广东卷)取5等份NO2 ,分别加入温度不同、 容积相同的恒容密闭容器中,发生反应:
2NO2(g)
N2O4(g) H <0
反应相同时间后,分别测定体系中NO2的百分量(NO2%)
v
v逆
v
v正
v逆
v正
t1
t2 t
t1
t2 t
若对以上反应已知m+n>p+q,平衡后降
低压强时,画出相关精选的课件v – t图。
8
对于反应A(g)+3B(g) 2C(g)+D(g)(正反应 放热)有如下图所示的变化,请分析引起平衡
高中化学复习考点知识专题训练17---化学平衡的图像分析(含答案解析)
A.反应的 ∆H < 0
B.在 0~60s 时段,反应速率 v ( N2O4 ) = 0.001 mol ⋅ L−1 ⋅ s−1
C. 该温度下,平衡常数 K =. T1 时平衡后将温度变为 T2 ,测得 c ( N2O4 ) 降低,则 T1 > T2
21.一定温度下,在 2 L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲 线如图所示。下列描述正确的是( )
已知:气体分压 ( p分 ) =气体总压 ( p总 ) ×体积分数。下列说法正确的是( )
、 A.550℃时,若充入惰性气体, v正 v逆 均减小,平衡不移动
B.650℃时,反应达平衡后 CO2 的转化率为 40.0% C.T℃时,若充入等体积的 CO2 和 CO ,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数 K P = 23.04P总
(1) CO2 催化加氢生成乙烯和水的反应中,产物的物质的量之比 n(C2H4 ) : n(H2O) =__________。当反应达到平衡时,若增大压强,则 n(C2H4 ) ___________(填“变大”
“变小”或“不变”)。
(2)理论计算表明,原料初始组成 n(CO2 ) : n(H2 ) = 1: 3,在体系压强为 0.1MPa,反应
℃ C. T1 时,若 c起始 (H2 ) = 2c起始 (CO) = 2 mol / L ,平衡常数 K > 10
D.图中 P 点所示条件下,延长反应的时间能提高 CO 转化率 19.一定量的 CO2 与足量的碳在体积可变的恒压密闭容器中发生反应: C(s) + CO2 (g) 2CO(g) ,平衡时,体系中气体体积分数与温度的关系如图所示,下列 说法错误的是( )
化学平衡图像题解法例析

t
T1、P2
T1、P1
T2、P2
2.在密闭容器中进行下列反应:M(g)+ N(g) R(g)+2L此反应符合右图,下列叙述正确的是( )
D
随堂测试:
1、正反应是 反应 (放热、吸热) m+n p +q (> = < )
v
0 t1 t2 t3 t4 t5 t6 t
0~t1、t2~t3、 t3~t4 、t5~t6
t1:升高温度,
A
随堂测试:
t3:使用催化剂,
t4:减小体系压强
某密闭容器中充入等物质的量的A和B,一定 温度下发生反应A(g)+xB(g) 2C(g),达到平衡后, 在不同的时间段,分别改变影响反应的一个条件, 测得容器中物质的物质的量浓度、反应速率分别随 时间的变化如下图所示:
可逆反应 mA(g) + nB(g) pC(g) +qD(g)
C%
t
T1
T2
1、T1 T2 ( > = < ) 正反应是 反应 (放热、吸热)
B%
t
T1
T2
2、T1 T2 ( > = < ) 正反应是 反应 (放热、吸热)
6
④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
C
(1)A、B、C、D、E五点中,尚未达到化学平衡状态的点是______。 (2)此可逆反应的正反应是______反应(填“放热”或“吸热”)。
在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应,并分别在t秒时测定其中NH3的体积分数,绘图如右:
(1)看起点和终点
分清反应物和生成物,浓度(或物质的量)减小的是反应物,增大的是生成物,生成物多数是以原点为起点。
《化学反应速率化学平衡图像》习题及答案

化学反响速率、化学均衡图像一、ν-t 图像或 c-t 图像1. ν-t 图像:分清正逆反响,分清各要素(浓度、温度、压强、催化剂)对反响速率和均衡挪动的影响。
【练习1】对于反响2SO2(g)+O 2(g)2SO3(g)△ H<0,填写改变的条件及均衡挪动的方向。
t1时,,均衡向挪动。
t2时,,均衡向挪动。
t3时,,均衡向挪动。
t4时,,均衡向挪动。
小结:改变条件,图像一点保持连续;改变,两点突变,_____________ 使正逆反响速率同样程度的增大而均衡不挪动。
【练习 2】对达到均衡状态的可逆反响X+Y Z+W ,在其余条件不变的状况下,增大压强,反响速率变化如右图所示,则图像中对于X 、Y 、 Z、 W 四种物质的齐集状态为()A . Z、 W 均为气体, X 、 Y 中有一种是气体B . Z、 W 中有一种是气体,X、 Y 皆非气体C.X、Y、Z、W 皆非气体D . X 、 Y 均为气体, Z 、W 中有一种为气体【练习 3】在密闭容器,必定条件下进行反响,mA(g)+nB(g)pC(g)+qD(g) ,若增大压强或高升温度,从头达到均衡,变化过程均如右图所示,则对该反响表达正确的是()A .正反响是吸热反响B.逆反响是吸热反响C. m+n>p+q D .m+n<p+q【练习4】应 N 2(g)+3H 2(g)2NH 3(g)△ H<0在某一时间段中反响速率与反响过程的曲线关系如图,则图中氨的百分含量最低的时间段是() ,氨的百分含量最高的时间段是()A.t - t1 B.t - t3C.t - t4D. t - t0 2 3 5 62.c-t 图像:分清反响物和生成物,浓度减小的为反响物,浓度增大的为生成物,分清耗费浓度和增添浓度,反响物的耗费浓度和生成物的增添浓度之比,等于化学方程式中各物质的化学计量数之比。
【练习 5】今有 X ( g) +Y(g) 2Z(g) △ H<0 。
化学平衡图像专题(精选)

【达标检测16】----化学平衡图像问题一、选择题1、下图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断(AB )A、正反应是放热反应B、若A、B是气体,则D是液体或固体C、逆反应是放热反应.D、A、B、C、D均为气体2、在密闭容器中充入A、B或G、H进行可逆反应:aA(气)+bB(气)gG(气)+hH (气);△H=QkJ/mol ,图甲、图乙分别表示在虚线所示部位改变温度(T)或压强对化学平衡与反应速率的影响(t表示时间),则下列结论中正确的是( A )A、开始时充入G和H a+b<g+h Q<0B、开始时充入G和H a+b<g+h Q>0C、开始时充入G和H a+b>g+h Q>0D、开始时充入A和B a+b>g+h Q>03、可逆反应A(气)+2B(气)nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( C )A、P1>P2,n >3B、P1>P2,n <3C、P1<P2,n >3D、P1<P2,n <34、如下图所示a曲线表示一定条件下可逆反应X(g)+Y(g)2Z(g)+W(s)△H <0的反应过程。
若使a曲线变成b曲线,可采取的措施是(AD )A、加入催化剂B、增加Y的浓度C、降低温度D、增大体系压强5、反应A(g)+B(g)C(g)+D(g);△H>0分别在673K和373K时进行,得C 的体积分数和时间的关系曲线如下图所示,其中能正确表示此反应的图象是( C )6、在容器相同的五个容器中,分别充入同量的N2和H2,在不同温度下任其反应:N2+3H22NH3,分别在同时刻测得其中NH3的体积百分比,连成如下图所示曲线,不正确的叙述是( C )。
A、放热反应B、E、F二点尚未达到化学平衡状态C、H、I二点尚未达到化学平衡状态D、G、H、I三点已达到化学平衡状态7、反应:L(s)+ a G(g) b R(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强P1>P2,X轴表示温度,Y轴表示平衡混合气中G的体积分数。
化学平衡图像题_(含答案)(可编辑修改word版)

化学反应速率化学平衡之图像题一、选择题1.(2012·武汉模拟)如图为某化学反应的速率与时间的关系示意图。
在t1时刻升高温度或者增大压强。
速率的变化都符合的示意图的反应是( )A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0B.2SO2(g)+O2(g) 2SO3(g) ΔH<0 C.H2(g)+I 2(g) 2HI(g) ΔH>0 D.C(s)+H 2O(g) CO(g)+H2(g) ΔH>0第1 题图第2 题图2.可逆反应m A(g) n B(g)+p C(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )A.m>n,Q>0 B.m>n+p,Q>0 C.m>n,Q<0 D.m<n+p,Q<03.在密闭容器中进行如下反应:H2(g)+I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示,符合图示的正确判断是( ) A.T1>T2,ΔH>0 B.T1>T2,ΔH<0 C.T1<T2,ΔH>0 D.T1<T2,ΔH<0第3 题图第4 题图4.(2011·陕西四校联考)在一密闭容器中有如下反应:L(s)+a G(g) b R(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( ) A.正反应为放热反应B.化学方程式中的计量数a>bC.G 的转化率随温度升高而减小D.增大压强,容器内气体质量不变5.下图是表示外界条件(温度和压强)变化对反应的影响,L(s)+G(g)2R(g),浓度ZX△H >0,在图中 y 轴是指( )A.平衡混合物中 R 的质量分数B. 平衡混合物中 G 的质量分数C.G 的转化率D. L 的转化率Yy第 5 题图温X第 6 题图6. 在一定条件下,固定容积的密闭容器中反应:2NO 2(g )O 2(g )+ 2NO (g );△H >0,达到平衡。
高考化学小题精练系列专题34化学平衡图像(含解析)

专题34 化学平衡图像(满分42分时间20分钟)姓名:班级:得分:1.在密闭容器中,反应2X(g)+ Y 2(g) 2XY(g)△H<0,达到甲平衡。
在仅改变某一条件后,达到乙平衡,下列分析正确的是A.图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低C.图Ⅱ中,t时间是增大了压强D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲【答案】D考点:考查化学平衡图像分析。
2.如图是关于反应A2(g)+B2(g) 2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是A .温度、压强不变,充入一些A 2(g)B .压强不变,降低温度C .压强、温度不变,充入一些与之不反应的惰性气体D .升高温度,同时加压 【答案】A【考点定位】考查化学反应速率与化学平衡【名师点晴】该题的难点是压强对平衡状态的影响,特别是“惰性气体”对化学平衡的影响:①恒温、恒容条件:原平衡体系−−−−→−充入惰性气体体系总压强增大→体系中各组分的浓度不变→平衡不移动。
②恒温、恒压条件:原平衡体系−−−−→−充入惰性气体容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。
3.在某容积一定的密闭容器中,有下列的可逆反应:A (g)+B (g)xC (g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数)A .P 3>P 4,y 轴表示B 的转化率 B .P 3<P 4,y 轴表示B 的体积分数C .P 3<P 4,y 轴表示混合气体的密度D .P 3<P 4,y 轴表示混合气体的平均摩尔质量 【答案】A【考点定位】考查化学平衡图象【名师点晴】本题旨在考查学生对化学平衡图象的理解.解答这类图象题,首先要“译”出其化学含义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第12讲 化学平衡图像分析
❖ 例题
1、已知某可逆反应mA(g)+nB(g)pC(g)+Q 在密闭容器中进行反应,测得在不同时间t 、温度T 和压强P 与反应物B 在混合气中的百分含量B%的关系曲线如图所示.
A. T 1<T 2, P 1>P 2, m +n >P, Q <0
B. T 1>T 2, P 2>P 1, m +n <P, Q <0
C. T 2>T 1, P 2>P 1, m +n <P, Q <0
D. T 1>T 2, P 2>P 1, m +n >P, Q >0
2、如图所示,a 曲线表示一定条件下可逆反应:X(g)+Y(g)2Z(g)+W(s)+Q 的反应过程中X 的转化率和时间的关系. 若使a 曲线变为b 曲线,可采取的措施是
A. 加入催化剂
B. 增大Y 的浓度
C. 降低温度
D. 增大体系压强
3、可逆反应N 2+3H 22NH 3+Q,从反应开始经t 1秒达平衡状态,因条件改变,平衡在t 2秒时发生移动,在t 3
秒时,又达到新的平衡状态. 试根据t 2-t 3秒曲线判断,
下列图1、图2所表示的平衡移动方向和变化条件各是
什么?
图1
图2
4、气态反应A +B C +D,其它条件不变,在有催化剂条件(a)时和无催化剂条件(b)时的反应过程中,有关的量(纵坐标)随时间(横坐标)的变化情况错误的是
A B
C D
5、右图为条件一定时,反应2NO +O 22NO 2+Q(Q >0)中NO 的最大转化率与温度变化关系曲线图,图中有A 、B 、C 、D 、E 五点,其中表示未达到平衡状态,且V 正<V 逆的点是
A. B 和C
B. A 和E
C. E
D. A 和C 6、下图表示外界条件(温度、压力)的变化对下列反应的影响. L (s )+G (g )2R(g)-Q(吸热)在图中Y 轴是指
A. 平衡混合气中R 的质量分数
B. 平衡混合气中G 的体积分数
C. G 的转化率
D. L 的转化率
7、在容积相同的五个密闭容器中分别放入同量的A 2和B 2,在不同温度下同时任其发生反应:A 2(g )+3B 2(g) 2AB 3(g ),分别在某一同时刻测得其中AB 3所占的体积分数变化如图所示. 下列说法不正确的是
A. 正反应是放热反应
B. E 、F 二点尚未达到平衡
C. H 、I
二点尚未达到平衡
D. G
、H 、
I 三点可能已达平衡状态
参考答案
1B 2AD 3升温;增大N 2浓度 4AD 5C 6B 7C
❖习题
1、如右图所示表示平衡混合物中x的百分含量在不同
的压强下,随温度变化的情况,在下列平衡体系中,x
可以代表用下横线标明的物质(反应中各物质为气态)
的是
A.N2+2H22NH3 △H<0
B.H2+I22HI △H<0
C.2SO32SO2+O2 △H>0
D.4NH3+5O24NO+6H2O △H<0
2、在溶积固定的4L密闭容顺中,进行可逆反应:X(气)
+2Y(气)2Z(气)并达到平衡,在此过程中,以Y
的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系
如右图,如图中阴影部分面积表示
A.X的浓度的减少B.Y的物质的量的减少
C.Z的浓度的增加D.X的物质的量的减少
3、今有反应X(g)+Y(g)2Z(g)+ △H<0若反应开始经
t1秒后达到平衡,又经t2秒后,由于反应条件的改变使
平衡破坏,则t3时又达到平衡,如图表示,试分析,以
t2到t3秒曲线变化的原因是
A.增大了X和Y的浓度B.使用了催化剂
C.增加了反就体系的压强D.升高了反应的温度
4、对达到平衡状态的可逆反应X+Y Z+W,在其
他条件不变的情况下,增大压强,反应速率变化图象如
右图所示,则图象中关于X、Y、Z、W四种物质的聚
集状态为
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
5、已知可逆反应aA+bB cC中,物质的含量A%
和C%随温度的变化曲线如图所示,下列说法正确的是
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到过化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
6、右图表示反应N2(g)+3H2(g)2NH3(g);
ΔH=-92. 2kJ/mol。
在某段时间t0~t6中反应速率与反
应过程的曲线图,则氨的百分含量最高的一段时间是
A.t0~t1B.t2~t3C.t3~t4D.t5~t6
7、在一定条件下,将X和Y两种物质按不同的比例放
入密闭容器中反应,平衡后测得X,Y的转化率与起始
时两物质的物质的量之比n x/n y的关系如图所示,则,
Y的反应方程式可表示为
A.2X+Y3Z B.3X+2Y2Z
C.X+3Y Z D.3X+Y Z
8、对于可逆反应:A2(g)+3B2(g)2AB3(g)(正反应
放热),下列图象中正确的是
A B
C D
参考答案
1D 2C 3D 4A 5B 6A 7D 8AB
精品资料。
