国家药审中心待确认纳入CTD格式品种排序20121120
关于按CTD格式撰写化学药品注册申报资料有关事项的通知

关于按CTD格式撰写化学药品注册申报资料有关事项的
通知
国食药监注[2010]387号
2010年09月25日发布各省、自治区、直辖市食品药品监督管理局(药品监督管理局):
为提高我国药物研发的质量和水平,逐步实现与国际接轨,国家食品药品监督管理局在研究人用药品注册技术要求国际协调会(ICH)通用技术文件(Common Technical Docume nt,简称CTD)的基础上,结合我国药物研发的实际情况,组织制定了《化学药品CTD格式申报资料撰写要求》,现予以发布,并将有关事宜通知如下:
一、《药品注册管理办法》附件2化学药品注册分类3、4、5和6的生产注册申请的药学部分申报资料,可参照印发的CTD格式整理提交,同时提交电子版。
申请临床试验阶段的药学资料,暂不按CTD格式提交资料。
二、《药品注册管理办法》附件2化学药品注册分类1和2的临床试验申请和生产注册申请的药学资料,暂不按CTD格式提交资料。
三、为鼓励CTD格式提交申报资料,并稳步推进该项工作,目前拟采取以下方式。
(一)按《药品注册管理办法》附件2申报资料要求提交的生产注册申请申报资料仍予接收。
(二)技术审评部门将对提交CTD格式申报资料的注册申请单独按序进行审评。
国家新药评审中心多肽药物已有批准文号与在审品种信息
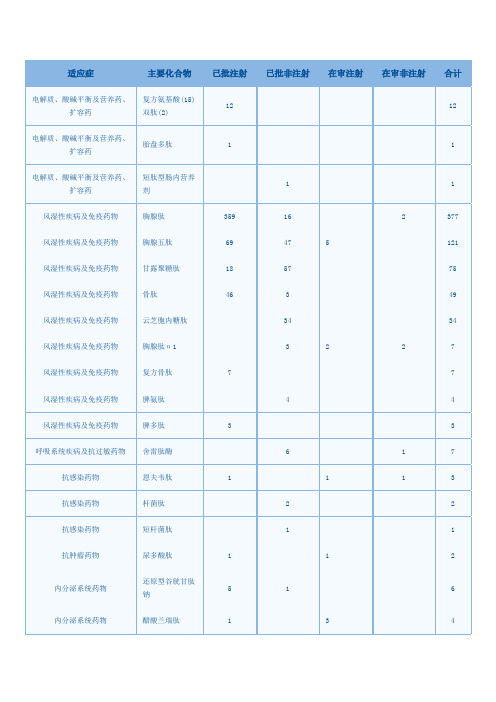
电解质、酸碱平衡及营养药、扩容药复方氨基酸(15)双肽(2)12 12电解质、酸碱平衡及营养药、扩容药胎盘多肽 1 1电解质、酸碱平衡及营养药、扩容药短肽型肠内营养剂1 1风湿性疾病及免疫药物胸腺肽359 16 2 377 风湿性疾病及免疫药物胸腺五肽69 47 5 121 风湿性疾病及免疫药物甘露聚糖肽18 57 75 风湿性疾病及免疫药物骨肽46 3 49 风湿性疾病及免疫药物云芝胞内糖肽34 34 风湿性疾病及免疫药物胸腺肽α1 3 2 2 7 风湿性疾病及免疫药物复方骨肽7 7 风湿性疾病及免疫药物脾氨肽 4 4 风湿性疾病及免疫药物脾多肽 3 3 呼吸系统疾病及抗过敏药物舍雷肽酶 6 1 7 抗感染药物恩夫韦肽 1 1 1 3 抗感染药物杆菌肽 2 2 抗感染药物短杆菌肽 1 1 抗肿瘤药物尿多酸肽 1 1 2内分泌系统药物还原型谷胱甘肽钠5 1 6内分泌系统药物醋酸兰瑞肽 1 3 4内分泌系统药物帕瑞肽 3 3 内分泌系统药物诺利糖肽 1 1 2 内分泌系统药物醋酸普兰林肽 1 1 2 内分泌系统药物艾塞那肽 2 2 皮肤科及五官科药物眼氨肽20 8 28 皮肤科及五官科药物复方氨肽素11 11 皮肤科及五官科药物氨碘肽 1 3 4 神经系统疾病药物肌氨肽苷50 50 神经系统疾病药物脑苷肌肽 6 6 神经系统疾病药物复方曲肽 3 3 神经系统疾病药物复方脑肽节苷脂 3 3 神经系统疾病药物薄芝糖肽 2 2神经系统疾病药物复方天麻蜜环糖肽生殖系统疾病药物蹄甲多肽10 10 消化系统疾病药物醋酸奥曲肽35 17 4 1 57 消化系统疾病药物肝水解肽28 28 消化系统疾病药物还原型谷胱甘肽19 3 1 1 24 消化系统疾病药物谷胱甘肽 4 2 6 消化系统疾病药物氨肽素硫酸锌 5 5 消化系统疾病药物免疫7肽 1 1 2消化系统疾病药物五肽胃泌素 1 1 2 血液系统疾病药物抑肽酶49 7 56 血液系统疾病药物氨肽素30 30 血液系统疾病药物聚明胶肽12 12 血液系统疾病药物依替巴肽 1 1 2 血液系统疾病药物爱啡肽 1 1 2 循环系统疾病药物胰激肽原酶12 28 40 循环系统疾病药物心肌肽 1 1 镇痛药及麻醉科用药科博肽 5 4 9 镇痛药及麻醉科用药鹿瓜多肽7 7。
汇总:292个一致性评价药品的批文数量

汇总:292个一致性评价药品的批文数量
导读月初,CFDA公布了关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》的有关事项(征求意见稿),要求凡在2007年10月1日前批准上市的、列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂,原则上应在2018年年底前完成一致性评价。
随着首批仿制药一致性评价292种基药目录药品清单出炉,各种话题热议不断。
尽管一致性评价、292种基药目录已成为烂熟于心的医药热搜词,但业内人士真正被问到292个品种具体批文数量有多少,从中能读懂什么,恐怕无从可知。
近日,药智君通过对药智药品注册与受理数据库数据统计,292种基药目录药品的批文总数共计20815份批文,排名前20的药品有10338份,约占比例50%。
其中,中间品种(批文数量排名为146)批文数量仅17份。
此外,笔者还发现了一些新的信息,之前不少行业人士片面认为品种序号是CFDA随意排列的,其实不然。
图表显示,292个品种批文数量的排名与国家既定的原文序号基本相似,前20位则完全一致。
从排序这件小事不难读懂CFDA对批文数量的良苦用心和高度关注。
292个品种的批文数量排名(左)及原文序号(右)。
CTD格式资料要求问题解答

CTD格式资料要求问题解答2012年01月16日14:35:25 作者:医药技术服务中心文档来源:审评中心1. 目前提交的CTD格式资料是否只是相当于原来药学部分的7-15号资料,其余部分是否仍按原格式撰写?药学部分是否还单独撰写7号资料?CTD格式是否须提交纸质资料?答:是的,目前仅药学部分研究资料可按照CTD格式撰写提交,其余部分包括《药品注册管理办法》附件二规定的综述资料、药理毒理研究资料和临床试验资料仍按照原格式撰写提交。
CTD格式药学部分相当于《药品注册管理办法》附件二规定的药学研究资料的7-15号资料。
采用CTD格式申报,药学部分资料应按照国家食品药品监督管理局2010年9月25日发布的“关于按CTD格式撰写化学药品注册申报资料有关事项的通知”(国食药监注[2010]387号)附件要求撰写,不需要单独撰写《药品注册管理办法》附件二规定的7号资料,但需要注意按要求提交“CTD格式申报主要研究信息汇总表”。
2. 如果在申报临床阶段提交CTD格式资料是否接受?按注册分类3准备申报资料的进口药原有资料是CTD格式的,是否要求IND阶段提交附件2格式的,NDA阶段提交CTD格式?答:无论进口申请还是国内申请,现阶段申请人可自主选择申报资料的提交格式,在申报临床阶段提交CTD格式资料可以接受。
需要强调的是,无论选用CTD格式还是《药品注册管理办法》附件二格式,需要提交的研究数据和信息要求是一致的,审评中掌握的尺度和标准也是一致的。
3. 3,4,5类申报生产时是否还要按照CTD格式重新整理并提交完整的药学研究资料?答:无论注册分类、申报阶段如何,申请人如选用CTD格式,则应该按照CTD格式要求整理并提交完整的药学研究资料。
4.CTD纸质资料能否分册撰写装订?有无分册的原则?答:CTD格式申报资料以及主要研究信息汇总表均须提交纸质资料,可以视情况分册装订。
如需分册,注意在申报资料封面上注明“第册,共册”。
通用技术文件

通用技术文件美国、欧盟和日本为主的三方在NDA巽写和编纂QR按照《联邦管理法》要求,也采取最新的ICH建立并广泛实施的《通用技术文件》简称CTD模莫式。
药物档案(DMF)是NDA部分资料申报的形式之一,用以支撑临床研究申请(川D)和新药申请(NDA和ANDA申请,DMF概念及申报的信息在本书第六章有详细介绍。
申报材料形式可采用如面,也可采用电子申报。
FDA目前鼓励电子申报,因容易检索,加快评审速度。
一、通用技术文件(CTD)简介随着当今全球经济发展的一体化,贸易壁垒越来越小,制药工业的质量管理规范(GMP GLR GCP等)、电子商务和电子文件的盛行和成熟•使全球性药品监管的协调统一也纳人各个国家的议事日程。
“人用药品注册技术和规范国际协调协会”ICH)经过多年的协商讨论,指导委员会(St~~rlng Commit rex~)在2000 年11月正式建议新药申请采纳通用技术文件”(C M nm㈣Te hnicd Documen,简称CTD形式。
CTD是全球性药品申报撰写的大变革,主要美国、日本和欧洲共同体三个国家和地区为主体制定的统一性医药申请组织格式。
目前,多数制药企业都在按CTD形式向ICH成员国家申报药品入市申请。
加拿大作为ICH的观察国,目前已经全面实行CTD。
CTD具有统一的新药申请组装设计(包括临床、非临床和化学生产控制信息),旨在口丁满足ICH 成员国家和地区的申报要求,而无需对每个国家的申报进行重新组编,以节省人力和物力资源。
然而,各国的药管部门各有其特殊的申报要求基于这些差异,申报各国的CTD)也随之需要进行一定程度的微小改动,但这种统一形式的CTD小修改工作量很小,最大限度地减小了药品申报资料编撰的人力和财力,并缩短审批时间。
CTD还为正在迅速发展的医药电子申报和市批蔓定了基础。
在日益更新完善的药品监管事务领域中-CTD)统一格式的施行还使各国药品监管部之间的信息相互交流、药品审批部门和申报者之间的交流,以及DMF寺有者与用户之间的交流变得更加简单化。
药品审批流程+受理号含义+评审时间

药品审批流程药品审批受理号2005年以后受理号分为四部分,第一部分是申请的基本信息(四位字母),第二部份是年份(第五、六位),第三部分是流水号(第七至十一位),第四部分(十二、十三位)是受理单位标识。
药品、辅料注册申请受理号共十三位,药包材注册申请受理号共十二位。
前面的四位字母意思分别是第一位:C表示国产,J表示进口第二位:X表示新药,Y表示已有国家标准(即仿制药)第三位:H表示化学药品,Z表示中药,S表示生物制品,F表示辅料第四位:L表示申请临床,S表示申请上市(即生产),B表示补充申请,Z表示再注册,F 表示分包装如“CXHL0600001甘”表示国产新药化学药品临床申请,是2006年受理的该类型第一个注册申请,甘肃省局上报;“JYHF0600001桂”表示进口已有国家标准化学药品分包装申请,是2006年受理的该类型第一个注册申请,广西区局上报。
2005年以前受理号的大体意思是:X:表示申请国产注册或补充(新药)Y:表示申请国产注册或补充(已有国家标准,即仿制药)FX:申请仿制(西药)FZ:申请仿制(中药)FX、FZ前面加B,即BFX或BFZ即为补充申请的意思BFX/BFZ:申请仿制补充(西药/中药):申请新药证书及生产(化药)CXL:申请新药临床研究(化药)CXZ:申请新药试生产转正式生产(化药)CXS、CXL、CXZ或CX后面加B即为补充的意思CZS:申请新药证书及生产(中药)CZL:申请新药临床研究(中药)CZZ:申请新药试生产转正式生产(中药)CZS、CZL、CZZ或CZ后面加B即为补充的意思J:为申请进口注册或补充B:申请进口药品补充A:申请进口药品注册证AS:申请进口药品注册证(生物制品)AZ:申请进口药品注册证(中药)H:申请进口药品注册证换发HS:申请进口药品注册证换发(生物制品)HZ:申请进口药品注册证换发(中药)CSS:申请生物制品试生产转正式生产CSL:申请生物制品临床研究CSZ:申请生物制品试生产转正式生产CSS、CSL、CSZ、CS后面加B即为补充的意思药品审评时间本文讨论的药品审评时间,指申报临床或生产的药品品种从进入药审中心到得出审评结论的时间,这其中包含了每个受理号等待审评的时间,以及技术审评所需花费的时间。
Am04 仿制药质量和疗效一致性评价品种分类指导意见

仿制药质量和疗效一致性评价品种分类指导意见为进一步推动仿制药质量和疗效一致性评价(以下简称一致性评价)工作的开展,现对品种的分类情况提出如下指导意见:一、原研进口上市品种。
无需开展一致性评价,经国家食品药品监督管理总局审核确定发布后,可选择为参比制剂。
二、原研企业在中国境内生产上市的品种。
原研企业在中国境内生产上市的品种,经国家食品药品监督管理总局审核确定发布后,可选择为参比制剂。
三、进口仿制品种。
(一)上市前按照与原研药品质量和疗效一致原则申报和审评的,由企业提交申请,国家食品药品监督管理总局行政事项受理服务和投诉举报中心接收资料,国家食品药品监督管理总局药品审评中心审核并提出意见,报国家食品药品监督管理总局发布。
(二)上市前未按照与原研药品质量和疗效一致原则申报和审评的,需按有关规定开展一致性评价。
四、国内仿制品种。
上市前按照与原研药品质量和疗效一致原则申报和审评的,按照上述第三条第一款规定的程序执行;未按照与原研药品质量和疗效一致原则申报和审评的,需按照有关规定开展一致性评价。
五、改规格、改剂型、改盐基的仿制品种。
需按照国家食品药品监督管理总局发布的《仿制药质量和疗效一致性评价工作中改规格药品(口服固体制剂)评价一般考虑》《仿制药质量和疗效一致性评价工作中改剂型药品(口服固体制剂)评价一般考虑》《仿制药质量和疗效一致性评价工作中改盐基药品评价一般考虑》等指导原则开展一致性评价。
六、国内特有品种。
由企业选择可重新开展临床试验证明其安全有效性,并参照《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)》提交申请,后续审核通过后视同通过一致性评价;企业未选择重新开展临床试验的,国家食品药品监督管理总局对外公布其缺乏有效性数据,不建议使用。
七、遇有重大技术性问题和分歧意见,召开专家委员会论证。
关于进一步做好289基药目录中国内特有品种一致性评价工作有关事宜的通知为落实总局《关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017年第100号)的要求,进一步推动国内特有品种的评价工作,我办梳理了289目录中的国内特有品种,初步形成了特有品种名单(见附件)。
CTD详细模版

######片申报资料(药学部分)目录3.2.P.1 剂型及产品组成 (2)3.2.P.2 产品开发 (3)3.2.P.2.1 处方组成 (3)3.2.P.2.1.1 原料药 (3)3.2.P.2.1.2 辅料 (4)3.2.P.2.2 制剂 (4)3.2.P.2.2.1 处方开发过程 (4)3.2.P.2.2.2 制剂相关特性 (13)3.2.P.2.3 生产工艺的开发 (19)3.2.P.2.4 包装材料/容器 (22)3.2.P.2.5 相容性 (22)3.2.P.3 生产 (22)3.2.P.3.1 生产商 (22)3.2.P.3.2 批处方 (22)3.2.P.3.3 生产工艺和工艺控制 (23)3.2.P.3.4 关键步骤和中间体的控制 (24)3.2.P.3.5 工艺验证和评价 (25)3.2.P.4 原辅料的控制 (30)3.2.P.5 制剂的质量控制 (30)3.2.P.5.1 质量标准 (30)3.2.P.5.2 分析方法 (30)3.2.P.5.3 分析方法的验证 (33)3.2.P.5.4 批检验报告 (90)3.2.P.5.5 杂质分析 (93)3.2.P.5.6 质量标准制定依据 (94)3.2.P.6 对照品 (96)3.2.P.7 稳定性 (97)3.2.P.7.1 稳定性总结 (97)3.2.P.7.2 上市后的稳定性研究方案及承诺 (98)3.2.P.7.3 稳定性数据 (98)附件 (112)申报资料正文3.2.P.1 剂型及产品组成######片是一种独特的具有高度血管选择性的长效二氢吡啶类钙离子拮抗剂,是心血管治疗药物中比较理想的长效降压药,也是近几年来世界处方量最大的高血压和心绞痛治疗药物。
######最早由美国##公司研制开发成功,1990年在英国和爱尔兰首先投放市场。
1992年7月获得美国FDA 批准在美国上市,后在许多国家上市,目前已在全世界几十个国家和地区上市销售。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
受理号
CXHL1100180 CXHL1100181 CYHS1100091 CYHS1100170 CYHS1100169 CYHS1100168 CXHL1100235 CYHS1100326 CYHS1100327 CXHL1100234 JXHS1100075 CYHS1100251 CYHS1100053 JXHS1100080 JXHS1100081 CYHS1100147 CYHS1100564 CYHS1100148 JXHS1100082 CYHS1100154 CYHS1100153 CYHS1100087 CYHS1100040 CYHS1001259 CYHS1100039 布洛芬注射液 布洛芬注射液
21
CXFL1100004
药用辅料
新药
2011-05-27
22 23 24
CYHS1100289 CYHS1100058 JXHS1100073
化药 化药 化药
仿制 仿制 进口
6 6
2011-05-27 2011-05-27 2011-06-03
1
序号
25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49
6 6 6 6 6 6 6 6 6
2011-08-05 2011-08-08 2011-08-08 2011-08-08 2011-08-08 2011-08-08 2011-08-17 2011-08-22 2011-08-23
3
序号
75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99
药品名称
药品类型
化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药
申请类型
仿制 仿制 仿制 仿制 仿制 进口 进口 仿制 仿制 仿制 新药 仿制 仿制 新药 仿制 仿制 仿制 仿制 新药 进口 新药 进口 新药 仿制 进口
药品类型
化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药
申请类型
仿制 仿制 仿制 仿制 仿制 仿制 仿制 仿制 仿制 仿制 仿制 新药 仿制 仿制 仿制 仿制 新药 仿制 新药 仿制
承办日期
2011-03-22 2011-03-22 2011-04-22 2011-04-22 2011-04-22 2011-04-22 2011-04-22 2011-04-22 2011-04-22 2011-05-10 2011-05-10 2011-05-11 2011-05-24 2011-05-24 2011-05-25 2011-05-25 2011-05-27 2011-05-27 2011-05-27 2011-05-27
药品类型
化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药
申请类型
仿制 仿制 仿制 进口 仿制 新药 仿制 仿制 仿制 仿制 仿制 仿制 仿制 进口 进口 进口 仿制 仿制 仿制 仿制 仿制 仿制 仿制 仿制 仿制
2
序号
50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74
受理号
CYHS1100018 CYHS1100041 CYHS1100017 JXHL1100226 CYHS1001260 CXHS1100095 CYHS1100456 CYHS1100578 CYHS1100515 CYHS1100513 CYHS1100514 CYHS1100618 CYHS1100097 JXHS1100088 JXHS1100090 JXHS1100092 CYHS1100732 CYHS1100718 CYHS1100152 CYHS1100151 CYHS1100269 CYHS1100720 CYHS1100461 CYHS1100580 CYHS1100230
6 6
2011-07-01 2011-07-01 2011-07-05 2011-07-05
6 6 6
2011-07-05 2011-07-05 2011-07-05 2011-07-05
6 6 6 6 6 6
2011-07-07 2011-07-07 2011-07-12 2011-07-12 2011-07-12 2011-07-12
药品名称
缬沙坦氨氯地平片 盐酸贝那普利片 单硝酸异山梨酯氯化钠注射液 硝苯地平控释片 更昔洛韦氯化钠注射液 多索茶碱葡萄糖注射液 环孢素软胶囊 环孢素软胶囊 多索茶碱氯化钠注射液 卡培他滨片 卡培他滨 替加环素 盐酸法舒地尔 盐酸法舒地尔注射液 卡培他滨片 卡培他滨 注射用紫杉醇胶束 拉米夫定片 富马酸替诺福韦二吡呋酯 拉米夫定片 甲氧基聚乙二醇 2000-聚丙交酯(53/47) 两嵌段共聚物 拉米夫定片 盐酸托烷司琼注射液 硫酸氢氯吡格雷
药品名称
药品类型
化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药
申请类型
新药 新药 仿制 仿制 仿制 仿制 新药 仿制 仿制 新药 进口 仿制 仿制 进口 进口 仿制 仿制 仿制 进口 仿制 仿制 仿制 仿制 仿制 仿制
药品名称
非洛地平缓释片 复方乳酸钠葡萄糖注射液 米力农注射液 硝酸咪康唑栓 氟伐他汀钠胶囊 右兰索拉唑缓释胶囊 注射用奥沙利铂 消旋α -生育酚 注射用奥沙利铂 精氨酸 注射用头孢哌酮钠他唑巴坦钠 替加环素 瑞舒伐他汀钙片 卡培他滨片 卡培他滨 卡培他滨片 美洛昔康分散片 无水碳酸钠 甲磺酸伊马替尼 阿立哌唑片 阿立哌唑片 阿立哌唑 左乙拉西坦片 注射用多西他赛干乳剂 甲磺酸伊马替尼片
药品类型
化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药 化药
申请类型
仿制 仿制 仿制 仿制 仿制 进口 仿制 仿制 仿制 仿制 仿制 新药 仿制 仿制 仿制 仿制 仿制 仿制 新药 仿制 仿制 仿制 仿制 新药 仿制
注射用替加环素 长春西汀注射液 长春西汀注射液 长春西汀注射液 小儿盐酸克林霉素棕榈酸酯颗粒 缬沙坦胶囊 缬沙坦胶囊 卡络磺钠颗粒 盐酸头孢吡肟 奥拉西坦 复方乳酸钠葡萄糖注射液 碘帕醇 雷贝拉唑钠 注射用头孢唑林钠 氨苯砜 注射用头孢唑林钠 富马酸喹硫平 注射用盐酸头孢替安 盐酸头孢替安 米力农 哌拉西林钠/他唑巴坦钠 酒石酸长春瑞滨 他唑巴坦钠
注册类型Байду номын сангаас
3.3 3.3 6 6 6 6 5 6 6 5
承办日期
2011-06-09 2011-06-09 2011-06-13 2011-06-13 2011-06-13 2011-06-13 2011-06-22 2011-06-22 2011-06-22 2011-06-22 2011-06-23
受理号
CYHS1100499 CYHS1001224 CYHS1100697 CYHS1001355 CYHS1100490 JXHL1100317 CYHS1100666 CYHS1100870 CYHS1100667 CYHS1100548 CYHS1100684 CXHS1100121 CYHS1100242 CYHS1101026 CYHS1101024 CYHS1101025 CYHS1100241 CYHS1100098 CXHS1100191 CYHS1101058 CYHS1101056 CYHS1101055 CYHS1100433 CXHL1100388 CYHS1101059
注册类型
6 6 6
承办日期
2011-07-12 2011-07-12 2011-07-12 2011-07-12
6 3.1 6 6 6 6 6 6 6
2011-07-12 2011-07-14 2011-07-15 2011-07-18 2011-07-19 2011-07-19 2011-07-20 2011-07-22 2011-07-22 2011-07-25 2011-08-04 2011-08-04
4
序号
100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124
受理号
CYHS1101057 CYHS1100949 CYHS1100502 CYHS1100888 CYHS1100605 JXHS1100098 JXHL1100318 CYHS1100436 CYHS1100434 CYHS1100435 CXHS1100078 CYHS1100706 CYHS1100276 CXHL1100389 CYHS1100119 CYHS1100227 CYHS1100228 CYHS1100729 CXHS1100189 JXHL1100336 CXHS1100190 JXHS1100104 CXHS1100188 CYHS1100628 JXHL1100334 阿立哌唑片 培哚普利片
药品名称
头孢丙烯干混悬剂 哌拉西林钠 头孢丙烯干混悬剂 阿哌沙班片 酒石酸长春瑞滨注射液 牛磺熊去氧胆酸 马来酸噻吗洛尔滴眼液 富马酸替诺福韦二吡呋酯片 瑞格列奈片 瑞格列奈片 瑞格列奈片 牛磺熊去氧胆酸胶囊 精氨酸 西司他丁钠 阿奇霉素(供注射用) 酒石酸麦角胺 琥珀酸甲泼尼龙 盐酸氨溴索口服溶液 头孢美唑钠 注射用头孢美唑钠 硫酸氢氯吡格雷片 盐酸氨溴索口服溶液 盐酸氨溴索注射液 哌拉西林 瑞舒伐他汀钙片
