(完整版)常见的酸和碱(常见的碱)
常见的酸碱盐知识点归纳

第五单元常见的酸和碱第一节生活中的酸和碱一.溶液酸碱性1.酸:电离时生成的阳离子全部是氢离子的化合物。
H2SO4=2 H++SO42-;HCl= H++Cl-;HNO3= H++NO3-。
一般命名为“某酸”2.碱:电离时生成的阴离子全部是氢氧根离子的化合物。
NaOH=Na++OH-;Ca(OH)2=Ca2++2OH-。
一般命名为“氢氧化某”。
3.酸性溶液:含大量氢离子(H+)的溶液,有酸味。
如食醋、柠檬汁、西红柿等4.碱性溶液:含大量氢氧根离子(OH-)的溶液,有滑腻感和涩味。
如肥皂、洗衣粉等洗涤剂5.中性溶液:〔H+〕浓度和〔OH-〕浓度相等,溶液既不显酸性也不显碱性。
如食盐氯化钠溶液,蔗糖溶液等【知识解读】(1)酸:①电离出的阳离子只有H+,电离出的阴离子叫做酸根,氯离子(Cl-)又叫盐酸根;②酸是由H+和酸根阴离子构成的;③酸一般命名为“xx酸”:H2SO4-硫酸;HCl-盐酸;HNO3-硝酸。
(2)碱:①电离出的阴离子只有OH-,叫做氢氧根离子;②碱是由金属阳离子和OH-离子构成的;③碱一般命名为“氢氧化x”。
NaOH-氢氧化钠;Ca(OH)2-氢氧化钙;Cu(OH)2-氢氧化铜。
(3)酸(碱)的溶液,一定显酸(碱)性;但是,酸(碱)性的溶液不一定是酸(碱)的溶液。
如纯碱碳酸氢钠的溶液显碱性,但是纯碱不是碱而是盐。
二.溶液酸碱性的检验1.尝味道:有酸味的溶液显酸性;有滑腻感和涩味的溶液显碱性。
注意:只能用于鉴别生活中的可食用的物质,2.酸碱指示剂(1)酸碱指示剂:能检验溶液酸碱性的试液。
常用的酸碱指示剂有石蕊和酚酞。
(2)紫色石蕊试液遇酸变红,遇碱变蓝,中性不变色仍为紫色;无色酚酞试液遇酸和中性不变色仍为无色,遇碱变为红色。
注意:酸碱指示剂变色的原因,是因为酸碱指示剂与酸(或碱)电离出的H+(或OH-)发生作用,导致其存在的形式发生了变化,而出现指示剂的颜色变化。
所以,①溶液变色时酸碱指示剂变色,而不是酸或碱变色;②不是所有的酸或碱都能使酸碱指示剂变色。
常见的酸和碱ppt课件

一些碱性清洁剂可以去除污渍和异味,保持环境清洁卫生 。
酸碱平衡与健康
人体的酸碱平衡对于维持正常的生理功能非常重要,过酸 或过碱的环境都会影响健康。因此,保持合理的饮食和生 活习惯对于维持酸碱平衡非常重要。
感谢您的观看
THANKS
碱的定义
碱是一种化合物,其溶液能吸收 氢离子(H+),从而显示出碱
性。
碱在水溶液中完全电离,产生阴 离子(OH-)和阳离子(金属离
子或铵根离子)。
常见的碱有氢氧化钠(NaOH) 、氢氧化钙(Ca(OH)2)和氨水
(NH3·H2O)等。
酸碱指示剂
酸碱指示剂是一种化学试剂,用于指示溶液的酸 碱度。
当指示剂遇到酸时,颜色会发生变化,通常由蓝 色变为红色;当遇到碱时,颜色也会发生变化, 通常由红色变为蓝色。
酸和碱的应用
酸在工业上的应用
酸用于金属表面处理
通过酸洗去除金属表面的锈迹和氧化物,提高金属的耐腐蚀性和 美观度。
酸用于制造颜料和染料
许多颜料和染料是通过酸催化合成的,如苯胺黑和酞菁蓝等。
酸用于石油工业
酸化是一种常用的提高油井产量的方法,通过向油层注入酸液,溶 解油层中的岩石颗粒,提高油层的渗透性。
氢氧化铁
溶解性
不溶于水,不溶于酸
用途
用于净水剂、染料等
腐蚀性
对皮肤和黏膜有刺激和腐蚀作用
04
酸和碱的性质
酸的性质
酸能使酸碱指示剂变色
酸能与活泼金属反应,生成 盐和氢气
02
01
酸能与金属氧化物反应,生
成盐和水
03
酸能与碱反应,生成盐和水
04
05
酸能与某些盐反应,生成另 一种盐和另一种酸
常见的酸和碱

• 知识掌握
氢氧化钠 氢氧化钙 白色 粉末状固体 无味 微溶
氨水 无色 液体 有气味 易溶
氢氧化钠、 氢氧化钙、 状态Βιβλιοθήκη 氨水物理 气味 性质的比 溶解性 较
俗名 烧碱、氨水 露置在空 气中发生 的变化 烧碱的溶解 情况
颜色
白色 片状固体 无味 易溶
烧碱、火碱 熟石灰、消石灰 苛性钠
烧碱露置在空气中,表面出现潮湿,这个现象称 为潮解。同时氢氧化钠也会吸收空气中的二氧 化碳而发生化学变化,生成碳酸钠。 氨水露置在空气中,会使其溶质质量分数变小。 放出大量的热,水溶液具有滑腻感。
大红花、紫罗兰 ⑴上表中能做酸碱指示剂的花汁是____________ ; ⑵将厨房中的少量白醋滴入大红花的花汁中,可以 橙色 看到的现象是_________; ⑶若将紫罗兰提取液滴入氯化钠溶液中,则可看到 紫色 的现象是____________。
实验步骤:在盛有少量稀硫酸的试管中滴入几 滴氯化钡的溶液,观察现象
现象 分析
有白色沉淀生成 H2SO4+BaCl2=BaSO4↓+2HCl
巩固练习:
下表是四种花的提取液实验(酒精用于提取花中的色素)
酒精中 大红花 紫罗兰 万寿菊 粉红色 紫色 黄色 酸溶液中 橙色 红色 黄色 碱溶液中 绿色 蓝色 黄色
三、溶液酸碱度的表示法
酸性溶液的pH值<7 碱性溶液的pH值>7 中性溶液的pH值=7
酸性越强,PH越小 碱性越强,PH越大
(如NaCl溶液、 Na2SO4溶液的PH=7)
【思考】 如何测定溶液的PH
测定PH最简便的方法是:使用PH试纸
【方法】将被测液体滴到pH试纸上,把试纸显示 的颜色与标准比色卡比较。
《常见的酸和碱》说课稿

《常见的酸和碱》说课稿(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如工作总结、实习报告、合同协议、条据书信、职业规划、规章制度、心得体会、应急预案、教学资料、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, our store provides various types of classic sample texts for everyone, such as work summaries, internship reports, contract agreements, document letters, career planning, rules and regulations, experiences, emergency plans, teaching materials, other sample texts, etc. If you want to learn about different sample formats and writing methods, please pay attention!《常见的酸和碱》说课稿《常见的酸和碱》说课稿(精选6篇)作为一名老师,时常需要用到说课稿,编写说课稿是提高业务素质的有效途径。
初中中考化学知识点常见的酸和碱
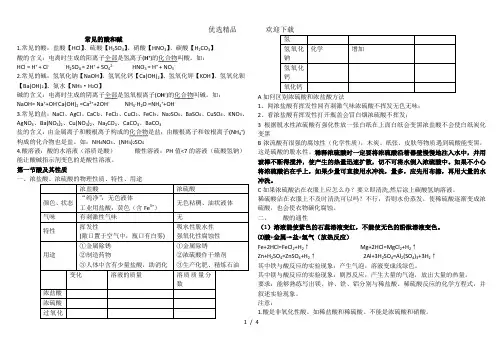
常见的酸和碱1.常见的酸:盐酸【HCl】、硫酸【H2SO4】、硝酸【HNO3】、碳酸【H2CO3】酸的含义:电离时生成的阳离子全部是氢离子(H+)的化合物叫酸。
如:HCl = H+ + Cl- H2SO4 = 2H+ + SO42- HNO3 = H+ + NO3-2.常见的碱:氢氧化钠【NaOH】、氢氧化钙【Ca(OH)2】、氢氧化钾【KOH】、氢氧化钡【Ba(OH)2】、氨水【NH3·H2O】碱的含义:电离时生成的阴离子全部是氢氧根离子(O H-)的化合物叫碱。
如:NaOH= Na++OH-Ca(OH)2 =Ca2++2OH-NH3·H2O =NH4++OH-3.常见的盐:NaCl、AgCl、CaCl2、FeCl2、CuCl2、FeCl3、Na2SO4、BaSO4、CuSO4、KNO3、AgNO3、Ba(NO3)2、Cu(NO3)2、Na2CO3、CaCO3、BaCO3盐的含义:由金属离子和酸根离子构成的化合物是盐;由酸根离子和铵根离子(NH4+)构成的化合物也是盐。
如:NH4NO3、(NH4)2SO44.酸溶液:酸的水溶液(溶质是酸)酸性溶液:PH值<7的溶液(硫酸氢钠)能让酸碱指示剂变色的是酸性溶液。
第一节酸及其性质一、浓盐酸、浓硫酸的物理性质、特性、用途1.4.8.A如何区别浓硫酸和浓盐酸方法1、闻浓盐酸有挥发性闻有刺激气味浓硫酸不挥发无色无味;2、看浓盐酸有挥发性打开瓶盖会冒白烟浓硫酸不挥发;3 根据脱水性浓硫酸有强化性放一张白纸在上面白纸会变黑浓盐酸不会使白纸炭化变黑B浓流酸有很强的腐蚀性(化学性质),木炭、纸张、皮肤等物质遇到硫酸能变黑,这是硫酸的脱水性。
稀释浓硫酸时一定要将浓硫酸沿着器壁慢慢地注入水中,并用玻棒不断得搅拌,使产生的热量迅速扩散,切不可将水倒入浓硫酸中。
如果不小心将浓硫酸沾在手上,如果少量可直接用水冲洗,量多,应先用布擦,再用大量的水冲洗。
初中化学常见的酸和碱

初中化学常见的酸和碱一、酸1. 定义酸是在水溶液中电离出的阳离子全部是氢离子(H⁺)的化合物。
2. 常见的酸盐酸(HCl)物理性质无色、有刺激性气味的液体,浓盐酸具有挥发性,打开瓶盖会看到瓶口有白雾出现,这是因为挥发出的氯化氢气体与空气中的水蒸气结合形成盐酸小液滴。
工业盐酸因含有杂质(如Fe³⁺)而略显黄色。
化学性质与酸碱指示剂反应:使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应(如锌):Zn + 2HCl = ZnCl₂+ H₂↑。
与金属氧化物反应(如氧化铁):Fe₂O₃+ 6HCl = 2FeCl₃+ 3H₂O,此反应常用于除铁锈。
与碱反应(如氢氧化钠):HCl + NaOH = NaCl + H₂O,这是中和反应的典型例子。
与某些盐反应(如碳酸钙):CaCO₃+ 2HCl = CaCl₂+ H₂O + CO₂↑,可用于实验室制取二氧化碳。
硫酸(H₂SO₄)物理性质无色、粘稠、油状液体,不易挥发。
浓硫酸具有吸水性,可作干燥剂。
浓硫酸溶于水时放出大量的热,因此稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并不断搅拌,切不可将水倒入浓硫酸中。
化学性质与酸碱指示剂反应:同盐酸,使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应(如锌):Zn + H₂SO₄ = ZnSO₄+ H₂↑。
与金属氧化物反应(如氧化铜):CuO + H₂SO₄ = CuSO₄+ H₂O。
与碱反应(如氢氧化钡):H₂SO₄+ Ba(OH)₂ = BaSO₄↓+ 2H₂O,此反应会生成白色沉淀硫酸钡。
与某些盐反应(如氯化钡):H₂SO₄+ BaCl₂ = BaSO₄↓+ 2HCl,可用于检验硫酸根离子。
硝酸(HNO₃)物理性质无色液体,有刺激性气味,具有挥发性。
化学性质与酸碱指示剂反应:使紫色石蕊试液变红,无色酚酞试液不变色。
具有强氧化性,与金属反应时一般不生成氢气。
例如,铜与稀硝酸反应:3Cu + 8HNO₃(稀)= 3Cu(NO₃)₂+ 2NO↑+ 4H₂O;铜与浓硝酸反应:Cu + 4HNO₃(浓)= Cu(NO₃)₂+ 2NO₂↑+ 2H₂O。
(完整版)初中化学酸和碱知识点总结
第十单元酸和碱课题 1 常见的酸和碱一、酸、碱、盐1、酸:阳离子只含氢离子的化合物。
生活中常见的酸有:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、碳酸(H2CO3)、醋酸(CH3COOH)等,一般说酸时写名称不写化学式。
2、碱:阴离子只含氢氧根离子的化合物。
生活中常见的碱有:氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3.H2O)等。
3、盐:由金属(或铵根)离子和酸根离子构成的化合物。
如:氯化钠(食盐)[ NaCl]、硫酸铜(CuSO4)、碳酸钙(CaCO3)等。
4、能够导电的物质:酸、碱、盐的水溶液,金属,石墨等。
(金属能导电是因为其中存在自由移动的电子;酸、碱、盐溶液能导电是因为有自由移动的离子。
二、酸碱指示剂1、酸碱指示剂(简称指示剂):是指与酸性或碱性溶液作用而显示不同顔色的物质。
2、常见的指示剂有紫色石蕊溶液和无色酸酞溶液;紫色石蕊遇酸变红,遇碱变蓝;无色酚酞遇碱变红,遇酸不变色。
三、生活中常见的酸1、盐酸(HCl):氯化氢气体的水溶液,人的胃液中含有盐酸。
1、物理性质:纯净的盐酸是无色,有刺激性气味和酸味的液体,工业盐酸因含有杂质而略带黄色。
2、浓盐酸有挥发性,打开浓盐酸瓶盖后瓶口有白雾是因为挥发出的氯化氢气体与空气中水蒸气结合形成的盐酸小液滴。
盛放浓盐酸的试剂敞口放置会导致溶液质量减少,溶质质量分数变小。
3、盐酸是重要的化工产品,用途:①、金属表面除锈、②、制造药物、③、胃液中的盐酸可帮助消化。
2、硫酸(H2SO4):汽车的铅蓄电池中含有盐酸。
1、物理性质:纯净的浓盐酸是无色、粘稠、油状的液体,不易挥发,有酸味。
2、浓硫酸:①、有很强的吸水性,常用作某些气体的干燥剂;将盛放浓硫酸的容器敞口放置其溶液质量会增加,溶质质量分数会减小,是因为浓硫酸吸收空气中的水蒸气使溶剂质量增加。
②、浓硫酸有很强的腐蚀性(脱水性),能夺取纸张、木材里的水分,生成黑色的炭,使用时要十分小心。
常见的酸和碱
二.常见的酸
1.几种常见的酸
盐酸 颜色、状态 打开瓶盖 后的现象 气味
无色、液体
硫酸
无色、液体
白雾
无明显现象 无味
刺激性气味
浓硫酸具有吸水性, 在实验室可以用浓硫酸做--------干燥剂
如何嗅药品的气味?
生活中的一些物质含有酸
食醋中含有醋酸 柠檬、柑橘等水果中含有柠檬酸
汽车用铅蓄电池中含有硫酸
2NaOH + SO2 = Na2SO3 + H2O 2NaOH + SO3 = Na2SO4 + H2O Ca(OH)2+SO2=CaSO3+H2O Ca(OH)2+SO3=CaSO4+H2O
【思考】不同的酸为什么有相似的化学性质? 不同的碱为什么也有相似的化学性质?
二、碱的化学性质
(3)酸跟碱发生的反应:
A. Fe和H2SO4 C. Zn和HNO3 B. Al和浓H2SO4 D. Ag和稀HCl
反馈练习2:不能由金属跟稀硫酸直 接反应制得的物质是 ( C )
A. MgSO4
C. CuSO4
B. FeSO4
D. Al2(SO4)3
反馈练习 3 :向放有锈铁钉的试管中加 入过量盐酸,充分反应。预测反应现象, 并写出有关反应的化学方程式:
(1)浓硫酸有腐蚀性-----脱水性
浓硫酸具有吸水性, 在实验室可以用浓硫酸做--------
干燥剂
但不是所有气体的干燥剂,如氨气
2.浓硫酸的腐蚀性 实 验 放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上 写字 用小木棍蘸少量浓硫酸
由黄色变成穿洞,并变成黑色
浓 硫 酸 稀 释 的 错 误 操 作
(4)酸跟碱发生的反应:
(完整版)常见的酸和碱复习、
教学案例主备人:备课组成员:年级组:九年级组课题:常见的酸和碱授课时间:复习(学习)目标:(第一课时)1.复习回顾根据原子团和化合价书写物质的化学式,并能够根据酸碱盐的定义准确判断物质所属的类别。
2.复习回顾酸和碱的通性,巩固典型的反应方程式和反应现象,熟悉检验鉴别、除杂等常见的题型(第二课时)针对学生易错、学有难度的知识点进行讲解(习题课)教学重点:1、常见碱的化学性质;2、培养学生的解题能力。
教学难点:常见碱的化学性质教学方法:教师引导,进行学法指导学习方法:学生自主复习基础知识、学生互学、小组交流讨论教学用具:多媒体课件。
教学课时:2课时第一课时板块一、溶液的酸碱性和酸碱度1.测定溶液的酸碱性一般用_______________;测定溶液的酸碱度最常用的是__________;它的使用方法是:__________________________________________________________。
pH<7的溶液呈______性,能使紫色石蕊试液变_____色,_______使无色酚酞试液变色;pH>7的溶液呈______性,能使紫色石蕊试液变_____色,使无色酚酞试液变_______色。
2.正常雨水呈_____性,其原因是______________________________(用方程式表示),酸雨的pH_________。
3.举例说明下列说法是否正确:(1)酸性溶液一定是酸溶液,碱性溶液一定碱溶液_____________________________ (2)pH试纸用水润湿后测量pH值,对结果没有影响___________________________板块二、酸碱盐的定义、化学式的书写及溶解性2.在括号中写出下列常见物质的颜色:(1)一般溶液如纯碱溶液、盐水等()多数固体如:烧碱、氧化镁等();大多数金属()(2)四氧化三铁、二氧化锰、氧化铜、碳粉等固体(),氢氧化铜();氢氧化铁();高锰酸钾固体();碱式碳酸铜();氧化铁();铜();硫酸铜、氯化铜、硝酸铜等铜盐溶液();氯化铁、硫酸铁、硝酸铁等铁盐溶液();氯化亚铁、硫酸亚铁等盐溶液();高锰酸钾溶液()板块三、酸的通性、浓酸的性质1.浓酸的性质:①浓盐酸:_____色___________气味;打开瓶盖,瓶口有_____说明它有______性,敞口放置一段时间后,溶液质量________,溶质质量___________,溶质质量分数____________。
常见的酸和碱(酸)
CuO+H2SO4=CuSO4+H2O
(4)酸溶液能与碱反应: 酸+碱→盐+水
与稀盐酸反应 与稀硫酸反应 氢氧化 NaOH+HCl=NaCl+H O 2NaOH+H2SO4=Na2SO4 2 +2H2O 钠溶液
Ca(OH)2+2HCl=CaCl2+ Ca(OH)2+H2SO4=CaSO4 熟石灰 2H2O +2H2O
三.活学活用
7.先用稀硫酸在普通的纸(主要由纤维组成)上写好字,然 后在酒精灯火焰上(隔开一定距离)慢慢烘干.这时纸上写 字的地方因炭化变成焦黑,原来写的字迹就清楚地显出 来.试说明其中的道理. 答:稀硫酸受热水分蒸发变成浓硫酸,浓硫酸有强烈的 腐蚀性,能夺取纸张里的水分,生成黑色的炭.
我入水中较安全; 水入我中真危险。 我与水合多放热;
一、常见的酸 人体胃液中有盐酸; 汽车用的电瓶(蓄电池)中有硫酸; 酸雨中含有及少量的硝酸和硫酸; 正常雨水中含有碳酸
一、常见的酸
1.几种常见的酸 盐酸(HCl)、硫酸(H2SO4)、 碳酸(H2CO3)、醋酸(CH3COOH)、柠檬酸
浓盐酸、浓硫酸的物理性质 浓盐酸 颜色、状态 浓硫酸
无色、液体,工 无色、粘稠、 业盐酸略显黄色 油状的液体 (因含Fe3+) 无明显现象 打开瓶盖后的 冒白雾 (有挥发性) (难挥发) 现象
2Al+6HCl=2AlCl3+3H2↑
铁
铝
(3)酸与金属氧化物反应
酸+金属氧化物→盐+水 化学方程式
现象
铁锈+稀盐 铁锈逐渐消失, 酸 溶液由无色变
黄色
Fe2O3+6HCl=2FeCl3+3H2O
铁锈+稀硫 酸
铁锈逐渐消失, 溶液由无色变 黄色
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验内容
现象与结论
氢氧化钙在水中的溶解情况
Байду номын сангаас
微溶于水
Company Logo
阅读并思考
1、氢氧化钙的性质
腐蚀性
2、氢氧化钙的用途:
氢氧化钙在建筑上常用来与粘土和沙子混 合来砌砖、抹墙、是利用它能与空气中的 二氧化碳反应生成坚硬的碳酸钙。工业上 用熟石灰作原料来制作氢氧化钠。农业上 用它来降低土壤的酸性,改良土壤的结构 ,还用它来配制农药波尔多液(原料是熟 石灰和硫酸铜)
Company Logo
白色固体
易溶于水放出大量的热
强腐蚀性 火碱、烧碱、苛性钠
①常作干燥剂
强吸水性
不能干燥酸性气体: HCl、CO2、SO2等 ②易潮解,易变质,保存氢 氧化钠要密封。
③称量氢氧化钠时,不能放
在纸上称量,应放在玻璃器
Company Logo
肥皂
印染
石油
氢氧化钠 含NaOH [NaOH] 用途
造纸
纺织
Company Logo
2. 氢氧化钙[ Ca(OH)2 ]
探究:在蒸发皿上放少量生石灰,加少 量水,观察现象。 实验内容 现象 结论 方程式
皿中
Company Logo
白色固体
微溶于水,其水溶液即澄清石灰水
溶解度温度的升高反而减小。
熟石灰、消石灰(石灰浆的主要成分)
其制法: 生石灰与水反应
同时放出大量的热
CaO+H2O=Ca(OH)2
Company Logo
液体干燥剂
固体干燥剂
装置 图
→→
干 燥 剂 浓硫酸
氧化钙与
生石灰与水反应得到氢氧
水反应 放热 化钙
CaO+H2O=Ca(OH)2
利用生石灰能与水反应的性质猜想生石灰的用途
某些气体的干燥剂
Company Logo
氢氧化钙的物理性质
观察颜色、状态
白色 粉末状固体
探究:在试管中加一些固体氢氧化钙, 加入水,振荡,观察它的溶解过程。
6.氨水露置在空气中,其溶质质量分数怎样 变化?
Company Logo
氢氧化钠 Na OH 氢氧化钡 Ba(OH)2
白色固体,易溶于水
氢氧化钙 Ca(OH)2
氢氧化镁 Mg(OH)2
氢氧化铜 Cu(OH)2 氢氧化铁 Fe(OH)3
白色固体,微溶于水 白色固体,难溶于水
课题1 常见的 酸和碱
Company
LOGO
你已经知道哪些碱?
Company Logo
你应该知道
氢氧化钠俗称烧碱、火碱
或苛性钠,是一种重要的碱。
石灰水和氨水都呈碱性,这是 因 为 石 灰 水 中 含 有 碱 —— 氢 氧 化钙,氧氧化钙俗称消石灰或
熟 石 灰 。 氨 水 ( NH3 的 水 溶 液 NH3·H2O )也是碱。碱有哪些重 要的性质呢?
蓝色固体,难溶于水
红褐色固体,难溶于水
氨水NH3·H2O无色液
Company Logo
1.氢氧化钠、氢氧化钙在组成和 结构上有什么相似之处?
2.那么氢氧化钠、氢氧化钙化学 性质有没有相似之处?为什么?
可干燥物
不可干燥物
中性或 酸性气体
NH3
固体 氧化钙、氢氧化钠、 氯化钙 碱石灰
大多 数气体
中性或碱性气体
NH3
HCl、SO2、CO2
Company Logo
归纳与小结
实验内容
实验现象
烧碱
消石灰
氨水
烧碱、消石 氨水物理性 质的比较
颜色 状态 气味 溶解性
白色 片状固体
3.氢氧化钠有强烈的_腐__蚀___性,所以俗称 _烧__碱__、__火_碱__或_苛__性_钠__。使用时要十分小心,
防止眼睛、皮肤、衣服被它腐蚀。称量氢氧
化钠时,不能放在纸上称量,应放在玻璃器
皿中
Company Logo
4.氢氧化钙是 色 体, 溶于水
5.氢氧化钙俗称
无味 易溶
白色 粉末状固体
无味 微溶
无色 液体 有气味 易溶
俗名
烧碱、火碱、 苛性钠
熟石灰、消石灰
烧碱、氨水 烧碱露置在空气中,表面出现潮湿,这个现象称
露置在空气 为潮解。同时氢氧化钠也会吸收空气中的二氧化
中发生的变 碳而发生变质,生成碳酸钠。
化
氨水露置在空气中,会使其溶质质量分数变小。
烧碱的溶解 放出大量的热,水溶液具有滑腻感。 情况
或 _______,它
可由_____与____ 反应得到,方程式
_____________
6.对皮肤、衣服也有 作用,使用时注
意安全.
7.氨水呈 性,化学式
氨水
易
。应
保存,放在阴凉
处。
Company Logo
简答题
1.如果不慎将碱液沾到皮肤上,应如何处理? 2.氢氧化钠有哪些重要用途? 3.炉具清洁剂可去除油污的原理? 4.氢氧化钠应该怎样保存?为什么? 5.为什么生石灰放入水中,可将鸡蛋煮熟?
氢氧化钠易溶于水
Company Logo
阅读并思考
1、氢氧化钠的性质以及据此性质的注意事项
①强烈腐蚀性-----使用时防 止眼睛、皮肤、衣服被腐 蚀.实验时最好戴防护眼镜
2、若不慎沾到皮肤上应该怎么处理?
用较多的水冲洗,再涂上硼酸溶液
3.归纳氢氧化钠的用途
①化工原料②去油污③可做某些气体干燥剂
Company Logo
课题1 常见的 酸和碱
Company
LOGO
巩固复习
1.氢氧化钠是_白__色__固_体__,,__易__ 溶于水,且 溶解时__放__出__大__量_的__热____。
2.潮解:某些固体吸收_空__气__中__的_水__分_,表面
潮湿并逐渐溶解,这种现象叫 。氢氧化钠 可作某些气体的干__燥__剂__。
Company Logo
1. 氢氧化钠(NaOH) 密封保存
实验 现象 观察 白色固体
分析
放表面 皿上
放入水 中
表面潮湿 氢氧化钠吸收空气
并逐渐溶 中的水分
解(潮解)同时氢氧化钠也会吸收
气体干燥 空气中的二氧化碳而发
剂
生变质,生成碳酸钠。
发热
氢氧化钠溶于水时放热
