反应工程课后习题
反应工程课后答案
第二章均相反应动力学1、有一反应在间歇反应器中进行,经过8min后,反应物转化掉80%,经过18min后,转化掉90%,求表达此反应的动力学方程式。
3、在间歇反应器中有一级液相可逆反应,初始反应时C A0=0.5mol/L,C P0=0反应8min后,A的转化率为1/3,而平衡转化率是2/3,求此反应的动力学方程式.解:根据一级可逆反应积分式5、恒温恒容的气相反应A →3P,其动力学方程为,在反应过程中系统总压p t及组分A的分压均为变量,试推导的表达式.解:8、纯气相组分A在一等温等容间歇反应器中按计量式进行反应,实验测得如下数据,时间/min 0 2 4 6 8 10 12 14 ∝分压p A/MPa 0.1 0.08 0.0625 0.051 0.042 0.036 0。
032 0.028 0。
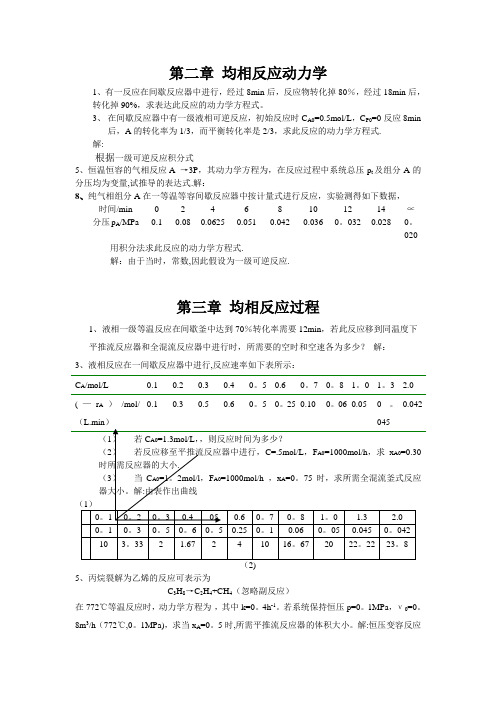
020 用积分法求此反应的动力学方程式.解:由于当时,常数,因此假设为一级可逆反应.第三章均相反应过程1、液相一级等温反应在间歇釜中达到70%转化率需要12min,若此反应移到同温度下平推流反应器和全混流反应器中进行时,所需要的空时和空速各为多少?解:3、液相反应在一间歇反应器中进行,反应速率如下表所示:C A/mol/L 0.1 0.2 0.3 0.4 0。
5 0.6 0。
7 0。
8 1。
0 1。
3 2.0(—r A)/mol/(L.min)0.1 0.3 0.5 0.6 0。
5 0。
25 0.10 0。
06 0.05 0。
0450.042(2)5、丙烷裂解为乙烯的反应可表示为C3H8→C2H4+CH4(忽略副反应)在772℃等温反应时,动力学方程为-,其中k=0。
4h-1。
若系统保持恒压p=0。
1MPa,ν0=0。
8m3/h(772℃,0。
1MPa),求当x A=0。
5时,所需平推流反应器的体积大小。
解:恒压变容反应8、一级反应A→P,在一体积为VP的平推流反应器中进行,已知进料温度为150℃,活化能为84kJ·mol—1,如改用全混流反应器,其所需体积设为Vm,则Vm/Vp应有何关系?当转化率为0.6时,如果使Vm=Vp,反应温度应如何变化?如反应级数分别为n=2,1/2,−1时,全混流反应器的体积将怎样改变?解:PPT课件答案1、在间歇反应器中进行液相反应A+B→P,C A0=0.307mol/L,测得二级反应速率常数k=61.5×10—2L/(mol·h),计算当C B0/C AO=1和5时,转化率分别为0.5,0.9,0。
反应工程课后习题参考答案

1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)反应的选择性;(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol 时,则反应器的进料组成为2由甲醇的转化率达72%2y x +=72%; 4.27x=69.2% 解得x=18.96; y=0.77 所以,反应器出口气体组成为: CH 3OH:%100221004.27⨯++--y x yx =6.983%空气:%1002210023279.54⨯++--y x y x =40.19% 水: %10022100281.17⨯++++y x y x =34.87%HCHO: %10022100⨯++y x x=17.26%CO 2: %10022100⨯++y x y=0.6983%1.2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图放空气体 Akmol/h原料气和冷凝分离后的气体组成如下:组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 21.460.82CH40.55 3.62N22.92 10.29粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
(完整版)化学反应工程习题

化学反应工程习题第一部分:均相反应器基本理论1、试分别写出N 2+3H 2=2NH 3中用N2、H 2、NH 3的浓度对时间的变化率来表示的该反应的速率;并写出这三种反应速率表达式之间的关系。
2、已知某化学计量式为S R B A 2121+=+的反应,其反应速率表达式为B AA C C r 5.02=,试求反应速率B r =?;若反应的化学计量式写成S R B A +=+22,则此时反应速率A r =?为什么?3、某气相反应在400 oK 时的反应速率方程式为221061.3AA P d dP -⨯=-τh kPa /,问反应速率常数的单位是什么?若将反应速率方程改写为21AA A kC d dn V r =⨯-=τh l mol ./,该反应速率常数k 的数值、单位如何?4、在973 oK 和294.3×103Pa 恒压下发生下列反应:C 4H 10→2C 2H 4+H 2 。
反应开始时,系统中含丁烷为116kg ,当反应完成50%时,丁烷分压以235.4×103Pa /s 的速率发生变化,试求下列项次的变化速率:(1)乙烯分压;(2)H 2的摩尔数;(3)丁烷的摩尔分率。
5、某溶液反应:A+B →C ,开始时A 与B 摩尔数相等,没有C ,1小时后A 的转化率为75%,当在下列三种情况下,2小时后反应物A 尚有百分之几未反应掉? (1)对A 为一级、B 为零级反应; (2)对A 、B 皆为一级反应; (3)对A 、B 皆为零级反应。
6、在一间歇反应器中进行下列液相反应: A + B = R A + R = S已知原料组成为C A0 = 2 kmol/m 3,C B0 = 4 kmol/m 3,C R0 = C S0 = 0。
反应混合物体积的变化忽略不计。
反应一段时间后测得C A = 0 .3 kmol/m 3,C R = 1.5 kmol/m 3。
计算这时B 和S 的浓度,并确定A 的转化率、生成R 的选择性和收率。
(完整版)化学反应工程课后习题答案.

积分之
2.10在催化剂上进行三甲基苯的氢解反应:
反应器进口原料气组成为66.67%H2,33.33%三甲基苯。在0.1Mpa及523K下等温反应,当反应器出口三甲基苯的转化率为80%时,其混合气体的氢含量为20%,试求:
(1)(1)此时反应器出口的气体组成。
(2)(2)若这两个反应的动力学方程分别为:
组分
摩尔分率yi0
摩尔数ni0(mol)
CH3OH
2/(2+4+1.3)=0.2740
27.40
空气
4/(2+4+1.3)=0.5479
54.79
水
1.3/(2+4+1.3)=0.1781
17.81
总计
1.000
100.0
设甲醇的转化率为XA,甲醛的收率为YP,根据(1.3)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数nA、nP和nc分别为:
组分
摩尔质量
摩尔分率yi
CO
28
15.49
H2
2
69.78
CO2
44
0.82
CH4
16
3.62
N2
28
10.29
总计
100
其中冷凝分离后气体平均分子量为
M’m=∑yiMi=9.554
又设放空气体流量为Akmol/h,粗甲醇的流量为Bkg/h。对整个系统的N2作衡算得:
5.38B/28×1000+0.1029A=2.92 (A)
20
30
40
50
60
70
试求当进口原料气体流量为50ml/min时CO的转化速率。
解:是一个流动反应器,其反应速率式可用(2.7)式来表示
化学反应工程 第二版课后习题

第一章习题1化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?2何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么? 3若将反应速率写成tc rd d AA -=-,有什么条件? 4为什么均相液相反应过程的动力学方程实验测定采用间歇反应器? 5现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)A+2B ↔C A+C ↔ D (2)A+2B ↔C B+C ↔D C+D→E (3)2A+2B ↔C A+C ↔D6 气相基元反应A+2B →2P 在30℃和常压下的反应速率常数k c =2.65×104m 6kmol -2s -1。
现以气相分压来表示速率方程,即(−r A )=k P p A p B 2,求k P =?(假定气体为理想气体)7有一反应在间歇反应器中进行,经过8min 后,反应物转化掉80%,经过18min 后,转化掉90%,求表达此反应的动力学方程式。
8反应A(g) +B(l)→C(l)气相反应物A 被B 的水溶液吸收,吸收后A 与B 生成C 。
反应动力学方程为:−r A =kc A c B 。
由于反应物B 在水中的浓度远大于A ,在反应过程中可视为不变,而反应物A 溶解于水的速率极快,以至于A 在水中的浓度恒为其饱和溶解度。
试求此反应器中液相体积为5m 3时C 的生成量。
已知k =1m 3kmol -1hr -1,c B0=3kmol·m -3,c A 饱和=0.02 kmol·m -3,水溶液流量为10m 3hr -1。
9反应O 2H N 2NO 2H 222+→+,在恒容下用等摩尔H 2,NO 进行实验,测得以下数据 总压/MPa 0.0272 0.0326 0.0381 0.0435 0.0543 半衰期/s26518613510467求此反应的级数。
化学反应工程课后习题答案

1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol设甲醇的转化率为X A,甲醛的收率为Y P,根据(1.3)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol所以,反应器出口气体组成为:1. 1.2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图原料气Bkg/h 粗甲醇Akmol/h100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 22.9210.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。
化学反应工程课后习题解答全解

min)
3-5 在等温全混流釜式反应器中进行下列液相反应:
A + B → P(目的)rP = 2cA [kmol/(m3.h)
2A → R
rR= 0.5cA [kmol/(m3.h)
cA0 = cB0 = 2kmol/m3.
试计算反应2h时A的转化率和产品P的收率。
解:A组分的总消耗速率
(-rA )= rP + 2rR = 2cA + cA = 3cA 将其代入CSTR设计方程
pA 1000 800 666.75 446.75 306.8 206.8 -dpA/dt 82.305 66.844 53.581 33.647 22.503 20.149
(4)对
rA
dpA dt
~
pA
分别取自然对数,得到数据如下表
pA 1000 800 666.75 446.75 306.8 206.8 -dpA/dt 82.305 66.844 53.581 33.647 22.503 20.149
nH2O 17.8082 x 2 y
Y x x 0.692,即 nC0H3OH 27.3979
x 18.961
又nCH3OH
27.3979 x
y
n0 CH3OH
(1
xCH3OH
)
7.6714
y (27.397918.961 7.6714) 0.768
rA k1cAcB k2cRcS 7cAcB 3cRcS
7cB0 (1 xB )(cA0 cB0 xB ) 3(cB0 xB )2
只能指定B的转化率为75%,计算空间时间
VR cB0 xBf
李绍芬《反应工程》课后习题答案

李绍芬《反应工程》课后习题答案1 绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1) (1) 反应的选择性;(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),组分 摩尔分率y i0 摩尔数n i0(mol) CH 3OH 2/(2+4+1.3)=0.2740 27.40 空气 4/(2+4+1.3)=0.5479 54.79 水 1.3/(2+4+1.3)=0.1781 17.81 总计 1.000 100.0A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 moln C =n A0(X A -Y P )=0.7672 mol结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol组分 摩尔数(mol ) 摩尔分率% CH 3OH 7.672 6.983 HCHO 18.96 17.26 H 2O 38.3 34.87 CO 2 0.7672 0.6983 O 2 0.8788 0.7999 N 2 43.28 39.391. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+ 242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩原料气 Bkg/h 粗甲醇 Akmol/h100kmol 放空气体原料气和冷凝分离后的气体组成如下:(mol )组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章1.在一管式反应器中等温下进行甲烷化反应:催化剂体积为10ml,原料气中CO含量为3%,其余为N2、H2,气体,改变进口原料气流量Q0 进行实验,测得出口CO 的转化率为:83.367.650.038.529.422.2X/%203040506070试求当进口原料气体流量为50ml/min 时的转化速率。
解:是一个流动反应器,由(2.7)式可知其反应速率为rA=-dFA/dVrFA= FA,0(1-XA)=Q0CA0(1-XA)dFA=-Q0CA0dXA故反应速率可表示为:rA= Q0CA0dXA/dVr=CA0dXA/d(Vr/ Q0)用XA-Vr/ Q0作图,过Vr/ Q0=0.20min的点作切线,即得该条件下的dXA/d(Vr/ Q0)值aVr/ Q0 min 0.12 0.148 0.2 0.26 0.34 0.45XA % 20 30 40 50 60 70由(2.6)式可知rA=-dCA/dt=-d{CA0(1-xa)/ dt= CA0 dXA/ dt代入速率方程式CA0 dXA/ dt=0.8 C2A0(1-XA)2化简整理得dXA/(1-XA)2=0.8CA0dt积分得0.8 CA0t= XA/(1-XA)=9.6解得XA=90.59%2.在进行一氧化碳变换反应动力学研究中,采用B106催化剂进行试验,测得正反应活化能为9.629×104J/mol,如果不考虑逆反应,在反应物料组成相同的情况下,试问反应温度为550℃时的速率比反应温度为400℃时的反应速率大多少倍?解:从题中可知,反应条件除了温度不同外,其他条件都相同,而温度的影响表现在反应速率常数k上,故可用反应速率常数之比来描述反应速率之比。
r550/r400=k550/k400=Aexp(-E/RT550)/ Aexp(-E/RT400)=eE/R(1/T400-1/T550)=23(倍)3.在一恒容反应器中进行下列液相反应式中分别表示产物R及D的生成速率。
反应用的原料为A与B的混合物,其中A的浓度为2,试计算A的转化率达到95%时所需的反应时间。
解:反应物A的消耗速率为两反应速率之和,即RA=rR+2rD=1.6CA+16.4C2A=1.6CA(1+10.25CA)利用(2.6)式-dCA/dt=1.6CA(1+10.25CA)积分得1.6t=+Ln{[(1-XA)+1/10.25CA0]/(1+1/10.25CA0)}= -Ln(1-XA)解之得t=0.6332/1.6=0.3958h4.甲烷与水蒸气在镍催化剂及750℃等温下的转化反应为:原料气中甲烷与水蒸气的摩尔比为1:4,若是这个反应对各反应物均为1级。
已知。
试求:(1)反应在恒容下进行,系统的初始总压为0.1013MPa,当反应器出口的CH4转化率为80%时,CO2,H2 的生成速率是多少?(2)反应在恒压下进行,其他条件如(1),的生成速率又是多少?解:(1)由题意可将反应速率表示为A+2B→B +4D rC=kCACB对于恒容过程,则有CA=CA0(1-XA)CB-=CB0-2CA0XACA0=PA0/RT=2.382×10-3mol/lCB0=4CA0=9.528×10-3 mol/l当XA=0.8时CA= CA0(1-XA)=4.764×10-4 mol/lCB-=CB0-2CA0XA=5.717×10-3 mol/lRC=rC=kCACB=5.447×10-6mol/(l?S)RD=4rC=2.179×10-5 mol/(l?S)(2)对于恒压过程,是个变容反应过程,由(2.49)式可求出总摩尔的变化数δA=∑t/A=(1+4-1-2)/1=2反应物A的原始分率:yA0=1/(1+4)=0.2由(2.52)式可得转化率为80%时的浓度:CA=CA0(1-XA)/(1+δA y A0 XA)=3.609×10-4mol/lCB-=(CB0-2CA0XA)/(1+δA yA0 XA)=4.331×10-3 mol/lrC= kCACB=3.126×10-6mol/(l?s)RC=rC=3.126×10-6mol/(l?s)5.在Pt 催化剂上进行异丙苯分解反应:以A、B及R 分别代表异丙苯,苯及丙烯,反应步骤如下:若表面反应为速率控制步骤,试推导异丙苯分解的速率方程。
解:根据速率控制步骤及定态近似原理,除表面反应外,其他两步过到平衡,描述如下:A+σAσKA=PAθν/θAθA= KA PAθνAσBσ+R rA=K1θA-K2PRθBBσB+σKB= PBθν/θBθB= KB PBθν以表面反应速率方程来表示整个反应的速率方程:rA= K1θA-K2PRθB由于θA+θB+θν=1将θA,θB代人上式得KA PAθν+ KB PBθν+θν=1整理得:θν=1/(1+KA PA+KB PB)将θA,θB,θν代人速率方程中rA=[k(PA-PBPR)/KP]/ (1+KA PA+KB PB)其中k= K1 KA,KP= K1 KA/ K2 KB6.设有反应A → B + D ,其反应步骤表示如下:若(1)是速率控制步骤,试推导其动力学方程。
解:先写出各步的速率式:(1)r1=KaA PAθν-KdAθA(2)r2=KsθA(3)r3=KdBθB-KaB PBθν由于(1)是速率控制步骤,第(2)是不可逆反应,其反应速率应等于(1)的吸附速率,故有;KaA PAθν-KdAθA= KsθA整理得:θA= KaA PAθν/(Ks+KdA)步骤(3)可按平衡处理:θB= KB PBθν因为θA+θB+θν=1,将θA,θB代人上式,得:θν=1/[1+KaA PA/ (Ks+KdA)+KB PB]最后将θA,θν代人,即得该反应的动力学方程式r1= Ks KaA PA/[ Ks+ KdA+ KaA PA+(Ks+ KdA)KB PB]第三章3.1拟在等温间歇反应器中进行氯乙醇的皂化反应:以生产乙二醇,产量为20 ,使用15%(质量分率)的水溶液及30%(质量分率)的氯乙醇水溶液作原料,反应器装料中氯乙醇与碳酸氢钠的摩尔比为1:1,混合液的密度为1.02。
该反应对氯乙醇和碳酸氢钠均为1级,在反应温度下反应速率常数等于5.2,要求转化率达到95%。
(1)若辅助时间为0.5h,试计算反应器的有效体积;(2)若装填系数取0.75,试计算反应器的实际体积。
解:(1)氯乙醇,碳酸氢钠和乙二醇的分子量分别为80.5,84,62每小时产乙二醇:20/62=0.3226kmol/h每小时需氯乙醇:0.3226×80.5/0.95×30%=91.11 kg/h每小时需碳酸氢钠:0.3226×84/0.95×15%=190.2kg/h原料体积流量:Q0=(91.11+190.2)/1.02=275.8l/h氯乙醇初始浓度:CA0=0.3226×1000/0.95×275.8=1.231mol/l反应时间:t= CA0=2.968h反应体积:Vt= Q0(t+t')=956.5 L(2)反应器的实际体积:V= Vt/j=1275 L3.2在间歇反应器中,在绝热条件下进行液相反应:其反应速率方程为:式中组分A及B的为单位,温度的单位为K,该反应的热效应等于-4000 。
反应开始时溶液中不含R,组分A和B的浓度均等于0.04,反应混合物的平均热容可按4.102计算。
反应开始时反应混合物的温度为50℃。
(1)试计算A的转化率达85%时所需的反应时间及此时的反应温度;(2)如果要求全部反应物都转变为产物R,是否可能?为什么?解:(1)T=T0+ CA0(-ΔHr)(XA-XA0)/=323+0.04×[-(-4000)] XA=323+39.01 XAt = CA0= CA0=91.32h(由数值积分得出)T=323+39.01×0.85=356.2 k(2)若A全部转化为R,即XA=1.0,则由上面的积分式知,t→∞, 这显然是不可能的。
3.3在一个体积为300 L的反应器中,86℃等温下将浓度为3.2 的过氧化氢异丙苯溶液分解:生产苯酚和丙酮。
该反应为1级反应,反应温度下反应速率常数等于0.08 s-1,最终转化率达98.9%,试计算苯酚的产量。
(1)如果这个反应器是间歇操作反应器,并设辅助操作时间为15 min;(2)如果是全混反应器;(3)试比较上述两问的计算结果;(4)若过氧化氢异丙苯浓度增加一倍,其他条件不变,结果怎样?解:(1) t= CA0= CA0=[Ln 1/(1-XA)]/k=56.37s=0.94minVr=Q0(t+t0)=300 LQ0=300/15.94=18.82 l/min苯酚浓度C苯酚=CA0XA=3.2×0.989=3.165 mol/l苯酚产量Q0C苯酚=18.82×3.165=59.56mol/min=335.9kg/h(2)全混流反应器Vr= Q0 CA0XAj/k CA0(1-XAj)= Q0 XAj/k(1-XAj)Q0= Vrk(1-XAj)/ XAj=0.2669 l/s=16.02 l/min 苯酚产量Q0C苯酚=16.02×3.1648=50.69mol/min=285.9kg/h(3)说明全混斧的产量小于间歇斧的产量,这是由于全混斧中反应物浓度低,反应速率慢的原因。
(4)由于该反应为一级反应,由上计算可知,无论式间歇斧或全混流反应器,其原料处理量不变,但由于CA0浓度增加一倍,故C苯酚也增加一倍,故上述两个反应器中苯酚的产量均增加一倍。
3.4在反应体积为490 cm3的CSTR中进行氨与甲醛生成乌洛托品的反应:以A代表NH3,B代表HCHO ,其反应速率方程为:式中。
氨水和甲醛水溶液的浓度分别为 4.06mol/L 和6.32 mol/L ,各自以1.50 的流量进入反应器,反应温度可取36℃,假设该系统密度恒定,试求氨的转化率XA 及反应器出口物料中氨和甲醇的浓度CA,CB。
解:CA0=4.06/2=2.03mol/l;CB0=6.32/2=3.16 mol/l; Q0=2×1.5=3.0cm3/sCA= CA0(1-XA); CB= CB0-6CA0 XA/4=3.16-1.5×2.03 XAk=1.42×103exp(-3090/309)=0.06447Vr= Q0 CA0xAf/k CA CB2= Q0 CA0xAf/[k CA0(1-XA)(CB0-6CA0 XA/4)2] 得490=3xAf/[0.06447(1-XAf)(3.16-1.5×2.03xAf)2]整理得:xAf3-3.075xAf2+3.162xAf-1.077=0得:xAf=0.821反应器出口A,B的浓度为:CA= CA0(1-XAf)=0.3634 mol/lCB= CB0-6CA0 XAf/4=0.6601 mol/l3.5等温下进行1.5级液相不可逆反应:A→B+C,反应速率常数等于,A的浓度为2 kmol/m3 的溶液进入反应装置的流量为1.5 m3/h 。
