产品稳定性试验方案
稳定性试验规定,稳定性指导原则,稳定性试验方法

FDA药物稳定性试验指导原则药品稳定性试验规定每年底制定下年度原料和制剂成品稳定性试验书面计划,内容包括:规格标准、检验方法、检验周期、每批数量、考查项目、考查频次、时间等。
经批准后执行,新开发的制剂品种在开发阶段应制定稳定性计划。
3 公司药品生产用原料稳定性试验可采用影响因素试验法:3.1 将一批供试品除去包装以后,平放在平皿中,在以下条件下按规定贮存,检测重点考查项目各项质量指标的变化情况。
重点考查项目包括:性状、熔点、含量、有关物质、吸湿性及根据药品性质选定的考查项目。
影响因素试验条件:3.1.1 暴露在常温空气中;3.1.2 高温试验,温度分别为60℃、40℃两个温度水平;3.1.3 高湿试验,湿度分别为90%±5%、75%±5%两个湿度水平;3.1.4 强光照射试验,照度为4500LX±500LX4 制剂稳定性试验:4.1 加速试验:取供试品三批,按市售包装,在温度40℃±2℃,相对温度75%±5%的条件下放置6个月,在第一个月、第二个月、第三个月、第六个月末取样检测各剂型规定的重点考查项目的质量指标变化情况。
片剂的重点考察项目为:性状、含量、有关物质、崩解时限或溶出度。
硬胶囊剂的重点考查项目为:外观、内容物色泽、含量、有关物质、崩解时限或溶出度、水份。
液体制剂的重点考察项目为:性状、相对密度、含量、pH值、微生物限度检查。
3个月后测试符合要求,有效期暂定为2年,6个月后测试符合要求有效期暂定为3年。
4.2 长期试验:取供试品三批,按市售包装,在规定保存条件下贮存,每年检测一次,重点考查项目的质量指标变化情况,观察3年的检验结果,以确定产品的贮存期或有效期。
5 严格按照批准的书面稳定性计划,做好试验记录,如发现异常情况,采取措施及时调整。
6 试验结束后,对试验结果进行数理统计后处理,评定并作出结论。
写出稳定性试验报告,所有资料归档保存。
产品稳定性试验考察方案

产品稳定性试验考察方案1 目的:通过稳定性试验提供产品在各种环境因素如温度、湿度和光等条件下影响下,其质量随时间变化的情况,并且由此建立所推荐的贮存条件、包装条件、有效期。
2 责任:质量部相关人员。
3 范围:适用于公司所有生产产品的稳定性考察或由其他原因(如有重大变更)引起的产品需要进行的稳定性考察。
4 内容:稳定性试验包括影响因素试验、加速试验与长期试验。
影响因素试验用一批供试品进行。
加速试验与长期试验要求用三批供试品进行。
4.1 影响因素试验是在比加速更剧烈条件下进行的,目的是了解影响产品稳定性的因素及可能的降解途径和降解产物,为产品贮存条件的确定等提供依据。
同时为加速试验和长期试验应采用的温度和湿度等条件提供依据。
供试品用1批进行,将供试品除去外包装,置适宜的开口容器中,进行高温试验,高湿度试验、低温试验与强光照射试验。
(1)高温试验供试品置60℃温度下放置10天,于第5天和第10天取样,按稳定性重点考察项目进行检测。
若供试品理化值低于规定限度则在40℃条件下同法进行试验。
若60℃无明显变化,不再进行40℃试验。
(2)高湿度试验供试品置恒湿密闭容器中,在25℃分别于相对湿度90%±5%条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目要求检测,同时准确称量试验前后供试品的重量,以考察供试品的吸湿潮解性能。
若吸湿增重5%以上,则在相对湿度75%±5%条件下,同法进行试验;若吸湿增重5%以下,其他考察项目符合要求,则不再进行此项试验。
(3)强光照射试验供试品开口放在装有日光灯的光照箱或其他适宜的光照装置内,于照度为4500 lx±500 lx的条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目进行检测,特别要注意供试品的外观变化。
(4)低温试验供试品置适宜的洁净容器中,-20℃温度下放置5天,于第5天取样,按稳定性重点考察项目进行检测。
若供试品含量低于规定限度则在-10℃条件下同法进行试验。
产品稳定性试验加速试验方案

文件制修订记录鉴于目前国家尚无出台食品添加剂稳定性试验指导原则,参照《中国药典》2020年版9001原料药物与制剂稳定性试验指导原则,根据公司产品质量稳定性考察计划,结合XXX产品特点和公司总部要求,现拟定XXX稳定性试验加速试验方案。
1、目的:在加速条件下进行加速试验,目的是通过加速产品的化学或物理变化,考察市售包装品在有效期内的质量稳定性,为产品设计、包装、运输、贮存提供必要的资料。
加速试验所用包装应采用模拟小包装,但所用材料与封装条件应与大包装一致。
2、范围:本方案适用于公司生产的市售包装XXX产品。
3、责任:质量部经理负责稳定性考察加速试验方案与报告的起草和批准,QC 人员按照本方案完成实验并报告检验结果。
4、质量标准依据与考察项目:5.1考察批次及样品数:本产品市售包装成品规格为25千克/铝箔袋,选择连续生产的三批模拟市售包装小袋(50g/铝箔袋)产品,每批次10袋,三批次共30袋。
5.2考察方法5.2.1贮存地点:XXX公司稳定性试验室。
5.2.2试验条件:在温度40℃±2℃、相对湿度75%±5%的条件下放置6个月。
在试验期间第1个月、2个月、3个月、6个月末分别取样一次,按稳定性考察项目检测。
在上述条件下,如6个月内供试品经检测不符合制订的质量标准,则应在中间条件下即在温度30℃±2℃、相对湿度65%±5%的情况下(可用Na2Cr04饱和溶液,30℃,相对湿度64.8%)进行加速试验,时间仍为6个月。
样品留样管理人员应在检测日的当天将样品取出交给检验人员,检验人员应在样品接收后立即安排进行测定,并将检验结果报告QC主管。
5.2.4合格标准5.2.4.1按照该稳定性考察方案完成所有测试,测试结果合格;5.2.4.2没有偏差,或者偏差的调查结果和产品质量无关。
6、产品稳定性考察报告6.1试验报告内容的要求应包括产品考察指标与合格标准、考察过程中出现的偏差及处理情况、数据统计、考察结论、附表(实验数据)。
产品稳定性试验方法
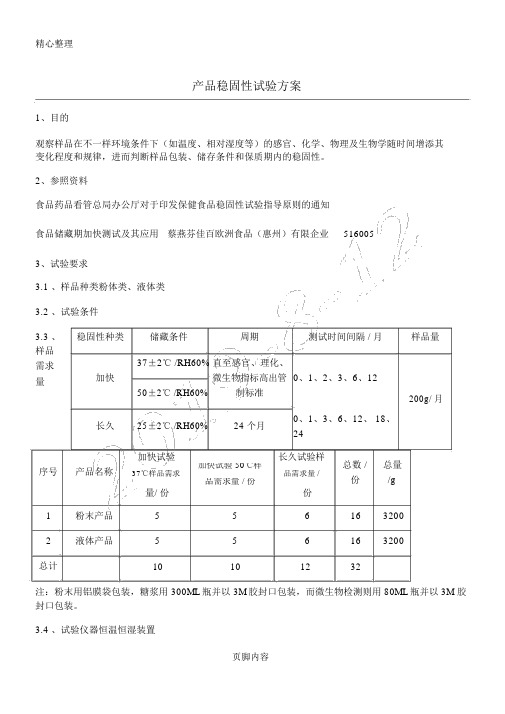
产品稳固性试验方案1、目的观察样品在不一样环境条件下(如温度、相对湿度等)的感官、化学、物理及生物学随时间增添其变化程度和规律,进而判断样品包装、储存条件和保质期内的稳固性。
2、参照资料食品药品看管总局办公厅对于印发保健食品稳固性试验指导原则的通知 食品储藏期加快测试及其应用 蔡燕芬佳百欧洲食品(惠州)有限企业 5160053、试验要求3.1 、样品种类粉体类、液体类3.2 、试验条件3.3 、 稳固性种类储藏条件 周期测试时间间隔 / 月样品量样品 37±2℃ /RH60% 直至感官、理化、需求加快微生物指标高出管 0、1、2、3、6、12量50±2℃ /RH60%制标准200g/ 月长久25±2℃ /RH60%24 个月0、1、3、6、12、 18、 24加快试验长久试验样总数 /总量序号产品名称加快试验 50℃样37℃样品需求品需求量 /份/g 品需求量 / 份份量/ 份1 粉末产品 5 5 6 16 32002 液体产品5 56 16 3200总计10101232注:粉末用铝膜袋包装,糖浆用 300ML 瓶并以 3M 胶封口包装,而微生物检测则用 80ML 瓶并以 3M 胶封口包装。
3.4 、试验仪器恒温恒湿装置页脚内容4、实验方案方案恒温恒湿箱加快试验长久试验同一批次的试验产品,温度30把留样室调整到试验所需的温方案一 1 个工作室度与50度两种不一样的环境轮番湿度,样品寄存于留样室进行做试验试验同一批次的试验产品,温度30把留样室调整到试验所需的温方案二 2 个工作室度与50度两种不一样的环境分别湿度,样品寄存于留样室进行在不一样的工作室同时进行试验试验一个工作室将设为温度30 度的环境做试验方案三 3 个工作室另一个工作室用作长久试验一个工作室将设为温度50 度的环境做试验注: 1、仪器尺寸的选择,因为实验室空间有限,在选购的恒温恒湿箱空间尺寸时有所限制,而我们企业的产品种类许多,试验时只好分批次来进行。
消毒产品稳定性测试方法

消毒产品稳定性测试方法1材料与方法1.1 试剂与药品1.2 器材1.3外观检查除测定有效成分含量或杀灭微生物效果外,还应观察记录消毒剂有无颜色变化;并且对液体消毒剂应观察记录有无沉淀或悬浮物产生,对片剂应观察记录外观性状是否完好。
性状变化的记录应写进检测报告。
1.4 影响因素试验用一批消毒剂原料药进行,将其置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤10mm厚的薄层,进行以下实验。
(1)高温试验消毒剂开口置于适宜的洁净容器中,60℃温度下放置10d,与第五、十天取样,按稳定性重点考察项目进行检查,同时准确称量试验前后消毒剂的重量,以考察消毒剂风化失重的情况。
若供试品有明显变化(如含量下降5%),则在40℃条件下同法进行试验。
若60℃无明显变化,不再进行40℃试验。
(2)高湿度试验消毒剂开口置于恒湿密闭容器中,25℃分别于相对湿度75%±5%及90%±5%条件下放置10d,与第五、十天取样,按稳定性重点考察项目进行检查,同时准确称量试验前后消毒剂的重量,以考察消毒剂吸湿潮解的情况。
(3)强度照射试验消毒剂开口置于光橱或其它适宜的光照仪器中,于强度为4500±500lx的条件下放置10d,与第五、十天取样,按稳定性重点考察项目进行检查;同时要注意消毒剂的外观变化。
1.5加速试验法:(1)取包装好的消毒剂,置37℃(对粉剂、片剂要求相对湿度>75%)恒温箱内3个月,或54℃恒温箱内14d。
于放置前、后分别测定消毒剂杀菌有效成分含量。
每次检测样品为三批,每批样品重复测2次,取其平均值即可。
(2)加速试验法结果评价以有效成分下降率超过10%为不符合要求。
若经37℃存放3个月的样本,其杀菌有效成分含量下降率≤10%,可将贮存有效期定为2年;经54℃存放 14d者,杀菌有效成分下降率≤10%,则贮存有效期可定为1年。
(3)未通过本试验的消毒剂,或需观察2年以上储存有效期的消毒剂,可按室温留样法测定其储存有效期。
稳定性试验计划

稳定性试验计划
1. 目的
稳定性试验旨在评估样品在特定环境条件下的质量变化情况,从而预测产品在建议的储存条件下的有效期。
2. 试验样品
- 样品描述(如批号、生产日期等)
- 样品数量
- 包装材料和容器
3. 储存条件
- 长期储存条件(25±2°/60±5%)
- 中期储存条件(30±2°/65±5%)
- 加速储存条件(40±2°/75±5%)
4. 试验时间点
- 初始时间点
- 3个月
- 6个月
- 9个月
- 12个月
- 18个月
- 24个月
- (根据具体情况设置时间点)
5. 评价指标
- 物理性状(颜色、气味、状态等)
- 化学鉴别
- 含量测定
- 其他指标(如需要)
6. 判据
按照相关法规和指导原则,制定合理的判据标准。
7. 样品处理
规定不同时间点取样、检测流程。
8. 报告
及时整理数据,按期编写稳定性试验报告。
以上为一般的稳定性试验计划框架,具体内容需根据产品特性和相关法规要求进行调整。
定期开展稳定性试验对于确保产品质量、评估有效期至关重要。
稳定性试验方案
原料药与药物制剂稳定性试验指导原则稳定性试验的目的是考察中药在温度、湿度、光线、微生物的影响下随时间变化的规律。
为中药的生产、包装、贮存、运输条件提供科学依据,同时根据试验结果建立药品的有效期。
稳定性试验的基本要求有以下几个方面:(1)稳定性试验包括加速试验与长期试验。
加速试验与长期试验要求用三批供试品进行。
(2)中药制剂的供试品应是放大试验的产品,其处方与工艺应与大生产一致。
每批放大试验的规模,丸剂应在10000g或10000丸左右、片剂10000片左右、胶囊剂10000粒左右,大体积包装的制剂(如静脉输液、口服液等)每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据情况,灵活掌握。
(3)供试品的质量标准应与各项基础研究及临床验证所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的容器和包装材料及包装方式应与上市产品一致。
(5)研究中药稳定性,要采用专属性强、准确、精密、灵敏的分析方法并对方法进行验证,以保证中药稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比大规模生产的数量要小,故申报者应在获得批准后,从放大试验转入大规模生产时,对最初通过生产验证的三批大规模生产的产品仍需进行加速试验与长期稳定性试验。
1、加速试验此项试验是在超常的条件下进行,其目的是通过加速中药的化学或物理变化,探讨中药的稳定性,为中药审评、工艺改进、包装、运输及贮存提供必要的资料。
供试品要求3批,按市售包装,在温度40℃±2℃,相对湿度75%±5%的条件下放置6个月。
所用设备应能控制温度±2℃,相对湿度±5%,并能对真实温度与湿度进行监测。
在试验期间第1个月、2个月、3个月、6个月末各取样一次,按稳定性重点考察项目检测。
在上述条件下,如6个月内供试品经检测不符合制订的质量标准,则应在中间条件下即温度30℃±2℃,相对湿度60%±5%的情况下进行加速试验,时间仍为6个月。
产品稳定性试验报告
产品稳定性试验报告一、试验概述本次试验旨在评估产品的稳定性,并检测其在不同环境条件下的表现。
试验包括以下内容:1. 温度试验:将产品暴露在不同温度条件下,观察其性能和功能是否受影响。
2. 湿度试验:将产品暴露在不同湿度条件下,评估其防潮性能和耐湿度能力。
3. 震动试验:通过模拟运输过程中的震动情况,检测产品的抗震能力和结构稳定性。
4. 可靠性试验:通过长时间连续运行产品,评估其稳定性和寿命表现。
二、试验结果1. 温度试验在不同的温度条件下,产品的性能和功能经过测试都保持正常。
无论是低温还是高温环境,产品仍然能够正常工作,没有出现异常情况。
2. 湿度试验在不同湿度条件下,产品经过测试显示出较强的防潮性能和耐湿度能力。
产品的外观和功能没有受到湿度的影响,继续保持正常工作。
3. 震动试验经过模拟的运输过程中的震动试验,产品表现出出色的抗震能力和结构稳定性。
无论在强烈震动的情况下,产品仍然能够保持正常工作,没有出现损坏或功能失效的情况。
4. 可靠性试验长时间连续运行试验结果显示,产品具有良好的稳定性和长寿命表现。
在持续运行的过程中,产品没有出现异常情况,并且保持了正常的功能和性能。
三、结论根据以上试验结果,我们可以得出以下结论:1. 产品具有良好的稳定性,能够在不同的环境条件下正常工作。
2. 产品具有较强的防潮性能和耐湿度能力,适用于湿度较高的环境。
3. 产品具有出色的抗震能力和结构稳定性,适用于运输过程中的震动环境。
4. 产品具有良好的可靠性和长寿命表现,能够持续运行而不受损坏或性能下降。
综上所述,产品稳定性试验结果显示,产品已经通过了各项试验,并且符合相关的稳定性要求。
产品具备良好的性能和可靠性,可以放心使用。
以上报告仅基于试验结果,不涉及实际产品使用情况。
如有其他问题或需要进一步了解,请及时联系我们。
生物制品生物技术产品的稳定性试验
⽣物制品⽣物技术产品的稳定性试验Q5c⼈⽤药品注册技术要求国际协调会ICH三⽅协调指导原则ICH指导委员会在1995年11⽉30⽇ICH进程第四阶段推荐采纳该指导原则由相应的ICH专家⼩组制定,按照ICH进程,已递交管理部门讨论。
在ICH进程第四阶段,最终草案被推荐给欧盟、⽇本和美国的管理机构采纳。
⽣物技术/⽣物制品质量:⽣物技术/⽣物制品稳定性试验1.引⾔由ICH三⽅协调制定的“新药原料及制剂稳定性试验”(1993年10⽉27⽇)的指导原则总体上适⽤于⽣物技术产品及⽣物制品。
然⽽,⽣物技术产品及⽣物制品确有其明显的特点,因此,在设计实验⽅案,确证在预期的贮藏期内制品的稳定性时,需要考虑这些特点。
由于这类制品的活性成分⼀般是蛋⽩质和/或多肽,因此,维持其分⼦构型,从⽽保持其活性取决于共价键和⾮共价键的作⽤⼒。
这些制剂对诸如温度变化、氧化、光照、离⼦含量及切割⼒等环境因素较为敏感,为保持其⽣物活性,避免降解,必须严格规定其贮藏条件。
稳定性的评价可能需要采⽤复杂的分析⽅法。
⽣物活性测定是稳定性研究的关键内容之⼀。
在制品纯度和分⼦特性允许的情况下,⽤适当的理化、⽣化和免疫化学的⽅法分析分⼦实体及定量检测降解产物也是稳定性研究的⼀部分。
申报者应根据以上所述的这些概念,提供能⽀持⽣物技术产品及⽣物制品稳定性的数据,同时还应考虑到许多外部条件亦会影响产品的效价、纯度和质量。
应根据长期、真实时间、真实条件的稳定性研究的初步数据制定原材料和制剂的贮藏期。
由此可见,合适的长期稳定性研究是成功开发上市产品的关键。
本⽂旨在指导申报者在产品上市申请时应提供的各类稳定性研究资料。
申报者还应认识到,稳定性数据在审评过程中需不断更新。
2. 附件的范围本附件适⽤于明确的蛋⽩质、多肽及其衍⽣物和含有这些衍⽣物的制剂以及从组织、体液、细胞培养物中分离或是⽤DNA 重组技术⽣产的产品。
因此,该⽂件涵盖了以下品种的稳定性资料的研究和申报:细胞因⼦类(⼲扰素、⽩介素、集落刺激因⼦、肿瘤坏死因⼦)、促红细胞⽣成素、纤溶酶原激活素、⾎浆因⼦、⽣长激素和⽣长因⼦、胰岛素、单克隆抗体和由明确的蛋⽩质和多肽构成的疫苗。
稳定性试验操作规程
稳定性试验操作规程稳定性试验操作规程一、试验目的和依据稳定性试验是针对某种物品或设备的稳定性能进行的试验。
通过试验可以确定物品或设备在正常使用条件下的稳定性是否满足要求,为产品的设计和改进提供依据。
本操作规程是根据国家相关标准和技术规范编制的。
二、试验设备和器材1. 试验设备:根据试验对象的特点和要求选择合适的试验设备。
2. 试验器材:包括温度计、压力计、电压表、电流表、功率表等必要的仪器和仪表。
三、试验条件和环境1. 试验条件:根据试验对象的特点和要求确定试验条件,包括试验温度、湿度、气压、负载等。
2. 试验环境:试验环境应符合相关标准和技术规范的要求,确保试验的可靠性和真实性。
四、试验方法和步骤1. 试验前准备:(1) 清理试验设备和器材,确保试验设备和器材的正常运行。
(2) 校准试验器材,确保其测量准确性。
(3) 检查试验对象的完整性和可靠性。
(4) 确定试验条件和环境。
2. 试验过程:(1) 将试验对象放置在试验设备中,并连接好相应的管道、电路等。
(2) 根据试验条件设置好试验设备和仪器的参数,如温度、压力、电压等。
(3) 开始试验,记录试验起始时间。
(4) 定期观察和记录试验设备和试验对象的运行情况,如温度变化、电流变化、压力变化等。
(5) 根据试验要求,进行试验负载、试验介质的更替等操作。
(6) 在试验持续时间内,定期进行数据记录,如每小时记录一次。
(7) 当试验结束时,记录试验结束时间。
3. 试验结束:(1) 停止试验设备和试验对象的运行,断开相应的管道、电路等连接。
(2) 将试验对象从试验设备中取出,检查试验对象的完整性。
(3) 整理试验数据,进行数据分析和处理。
(4) 编制试验报告,包括试验目的、试验条件、试验结果等内容。
(5) 对试验设备和器材进行清理和维护。
五、安全注意事项1. 严格按照试验操作规程进行试验,不得随意更改试验条件和环境。
2. 试验过程中,严禁对试验设备和器材进行胡乱操作和调整。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
产品稳定性试验方案1、目的
考察样品在不同环境条件下(如温度、相对湿度等)的感官、化学、物理及生物学随时间增加其变化程度和规律,从而判断样品包装、贮存条件和保质期内的稳定性。
2、参考资料
食品药品监管总局办公厅关于印发保健食品稳定性试验指导原则的通知
食品储存期加速测试及其应用蔡燕芬佳百欧洲食品(惠州)有限公司516005
3、试验要求
3.1、样品类型粉体类、液体类
3.2、试验条件
3.3、样品需求量
注:粉末用铝膜袋包装,糖浆用300ML瓶并以3M胶封口包装,而微生物检测则用80ML瓶并以3M胶封口包装。
3.4、试验仪器恒温恒湿装置
4、实验方案
注:1、仪器尺寸的选择,由于实验室空间有限,在选购的恒温恒湿箱空间尺寸时有所限制,而我们公司的产品种类较多,试验时只能分批次来进行。
(后附恒温恒湿箱的各种型号及市场价格)
2、仪器工作室的选择,由于试验有加速试验和长期试验,试验的时间较长,建议选购3个工作室的仪器较适合。
5、考察指标与检测方法应按照产品质量标准规定的方法,对样品的卫生学及其与产品质量有关的指标在保质期内的变化情况进行的检测。
6、数据记录、汇总。
