1蛋白质分离纯化
4.1.1蛋白质地分离与纯化方法
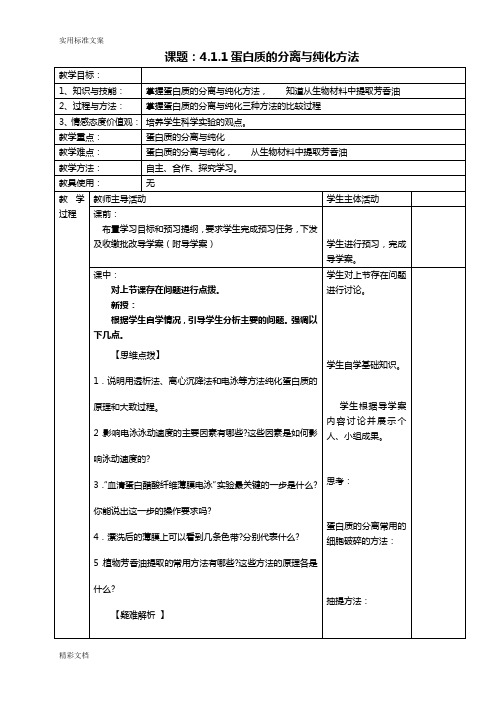
课题:4.1.1蛋白质的分离与纯化方法生物成分的分离与测定技术导学案一、学习目标:二、知道蛋白质的分离常用的细胞破碎的方法,蛋白质抽提方法,掌握蛋白质的分离与纯化方法。
二、知识构成:1.蛋白质的分离常用的细胞破碎的方法有:根据蛋白质的不同特性,分别可选择哪些抽提方法?、、蛋白质的纯化主要是根据之间以及之间在、、、等方面存在的差异进行的。
常用的方法包括、、等。
2.用电泳分离纯化蛋白质时,泳动速度主要取决于,即。
此外,、等因素对泳动速度也有影响。
3.血清蛋白醋酸纤维薄膜电泳的实验的基本步骤包括:、、、、、、、、、。
4.浸泡醋酸纤维薄膜前,用笔做记号是在(填“光泽面”或“非光泽面”);点样是在(填“光泽面”或“非光泽面”);平悬薄膜时,(填“光泽面”或“非光泽面”)朝上。
5.经电泳后,可以在薄膜上看到条色带,它们分别是、、、、。
'6.植物芳香油的提取方法有和等。
三、学法和自检:本节内容主要通过看书、分析蛋白质的提取、分离、纯化的不同方法。
动手试一试:[1]盐析法分离蛋白质的原理是( )A.破坏蛋白质的一级结构B.破坏蛋白质的二级结构C.破坏蛋白质水化膜而改变溶解度D.使蛋白质发生变性沉淀[2]利用透析法将蛋白质和其他小分子物质分离的原理是( )A. 利用蛋白质分子不能透过半透膜的特性B.利用蛋白质分子的水溶性C.利用蛋白质分子的胶体性D.利用蛋白质分子所带电荷[3].下列关于血清蛋白醋酸纤维薄膜电泳实验的说法不正确的是( )A.实验所用的巴比妥缓冲液的pH为8.6 B.点样是在薄膜的光泽面上进行的C.实验后可以得到五条色带D.整个实验最关键的步骤是点样[4].有一混合蛋白质溶液,各种蛋白质的pH分别为4.5、5.2、6.6、7.2,电泳时欲使其中三种泳向正极,则缓冲液的pH应该是( ) A.2.0 B.5.0 C.6.0 D.7.0四、、学习小结和课外作业:1、学习小结:2、上本作业:列举蛋白质粗提取时次报的破碎、蛋白质的抽提、纯化方法。
蛋白质的分离纯化(1)

白质的净电荷为零时的pH称等电点(pI)。
蛋白质等离子点: 没有其他盐类干扰时, 蛋白质质子供体基团解离出来
的质子数与质子受体基团结合的质子数相等时的pH称为等 离子点。
二、蛋白质的紫外吸收性质
蛋白质溶液能吸收一定波长的紫外光,主要是由带 芳香环的氨基酸决定的。其在280nm处对紫外吸收能力 的强弱顺序为:
电
电
泳
泳
方
方
向
向
等电聚焦电泳
SDS-PAGE
双向电泳后的凝胶经染色蛋白呈现二维分布图,水平方向反映 出蛋白在pI上的差异,而垂直方向反映出它们在分子量上的差别。
所以双向电泳可以将分子量相同而等电点不同的蛋白质以及等 电点相同而分子量不同的蛋白质分开。
5.层析聚焦(P310)
是根据蛋白质的等电点差异分离蛋白质混合物的柱层析方法。
(polyacrylaminde gel electrophoresis) 电泳
PAGE
样品浓缩成很薄的起始区带(0.1mm)
它以聚丙烯酰胺 凝胶为支持物,一般 制成凝胶柱或凝胶板 (不连续体系)。
浓缩胶 分离胶
凝胶的浓度(孔径大小)、 缓冲液组分和离子强度、 pH以及电场强度都是不同的
分离成单区带
依次洗脱收集后, 通过紫外吸收法测定吸 收峰。
这样大小不同的蛋白 质就被分离开来了。
(二)根据蛋白质溶解度不同的纯化方法
(蛋白质的胶体和沉淀性质)
主要方法: 1:等电点沉淀和PH值控制 2:蛋白质的盐溶和盐析 3:有机溶剂分级分离法 4:改变温度
1.等电点沉淀和PH值控制
即在不改变其它条件的情况下,PH处于等电点时的蛋白质 溶解度达到最低点。而位于等电点两侧的PH条件下蛋白质的溶
2009-1蛋白质的分离纯化)

目前经常使用的凝胶有
线形的 -1,6葡聚糖 交联葡聚糖 Sephadex 聚丙烯酰胺凝胶 (Bio-gel P) 1-氯-2,3-环氧丙烷
交联度大,网孔小,分级 分子量的范围偏窄,凝胶 颗粒吸水值也小,机械性 能好
商品名后的数字103为 该凝胶的排阻极限
丙烯酰胺(单体)
甲叉双丙烯酰胺(交联剂)
1、前处理:
动物材料:应先剔除结缔组织和脂肪组织
种子材料:应先去壳甚至去种皮以免受单宁等物质的污染, 油料种子:最好先用低沸点的有机溶剂如乙醚等脱脂。
组织和细胞的破碎
动物组织和细胞:
电动捣碎机(Waring blender) 匀浆器破碎 超声波处理(u1trasonication) 研磨的方法破碎 纤维素酶处理 超声波震荡 与砂研磨 高压挤压 溶菌酶处理(以分解肽聚糖)等
盐析沉淀的蛋白质保持着它的天然构象,能再溶解。
3、有机溶剂分级分离法
与水互溶的有机溶剂(如甲醇、乙醇和丙酮等)能使蛋白质 在水中的溶解度显著降低。 原因 改变了介质的介电常数
与蛋白质直接争夺水化水,致使蛋白质聚集而沉淀。
在室温下,这些有机溶剂不仅能引起蛋白质沉淀,而且伴 随着变性。
如果预先将有机溶剂冷却到−40℃至−60℃,然后在不
植物组织和细胞:
细菌细胞的破碎:
提取蛋白液
水溶性蛋白用中性缓冲溶液抽提, 酸性蛋白用稀碱性溶液抽提,
脂溶性蛋白用表面活性剂抽提等。
2、粗分级分离
盐析 方法 等电点沉淀 有机溶剂分级分离 蛋白质提取液体积较大,则可采用 超过滤 凝胶过滤 冷冻真空干燥 或其他方法(如聚乙二醇浓缩法) 特点 简便 处理量大 既能除去大量杂质(包 括脱盐),又能浓缩蛋 白质溶液
质存在于原液中,两次沉淀即可得到最大量的酶,而且由于在第
蛋白质的分离与纯化

(1)凝胶的选择:
。
(2)方法: 配置凝胶悬浮液:计算并称取一定量的凝胶浸泡于 中充分溶胀
后,配成
。
(3)凝胶色谱柱的装填方法
① 固定:将色谱柱处置固定在支架上
② 装填:将
一次性的缓慢倒入 内,装填时轻轻敲动色谱柱,
使凝胶填装均匀。
③ 洗涤平衡: 装填完毕后,立即用缓冲液洗脱瓶,在 高的操作压下,用
3、具体过程:
相对分子质量 较小的蛋白质
(1)
(2) (3) (4)
(5)
相对分子质量 较大的蛋白质
A B
A
的蛋白质由于
作用进入凝胶颗粒内部而被滞
留;
的蛋白质被排阻在凝胶颗粒外面,在了里之间
迅速通过。
B(1)
混合物上柱;
(2)洗脱开始,
的蛋白质扩散进入凝胶颗粒内;
的蛋白质被排阻于凝胶颗粒之外;
(3)
子
以及分子本身 、
的不同使带电分子产
生不同的
,从而实现样品中各种分子的分离。
3、分类: 琼脂糖凝胶电泳 聚丙稀酰胺凝胶电泳。
测定( 蛋白质相对分子质量 )通常用十二烷基硫酸钠(SDS)—聚丙稀酰胺凝胶
电泳。蛋白质在聚丙烯酰胺凝胶中的迁移率取决于它所带静电荷的多少以及分子的
大小等因素。为了消除静电荷对迁移率的影响可以在凝胶中加入
(4) 透析
2. 凝胶色谱制作
1)凝胶色谱柱的制作
① 取长40厘米,内径1.6厘米的玻璃管,两端需用砂纸磨平。
② 底塞的制作:打孔 挖出凹穴
安装移液管头部 覆
盖尼龙网,再用100目尼龙纱包好。
a、选择合适的的橡皮塞,中间打孔;
b、在橡皮塞顶部切出锅底状的 ,在0.5ml的 头部切
对蛋白质分离纯化的方法

对蛋白质分离纯化的方法
蛋白质分离纯化的方法有很多种,常用的方法如下:
1. 溶液的分离:利用差速离心、过滤或超滤等方法,将悬浮液或溶液中的蛋白质与其他组分分离开。
2. 色谱层析:将蛋白质溶液经过色谱柱,利用分子大小、电荷、亲疏水性等物理性质作用于柱内填充物,实现蛋白质的分离纯化。
3. 电泳:利用蛋白质在电场中的电荷性质以及大小和形状的差异,在凝胶电泳或毛细管电泳中进行分离纯化。
4. 凝胶过滤:利用凝胶的孔隙结构,根据蛋白质的分子大小将蛋白质分离开。
5. 亲和层析:利用蛋白质与亲和配体之间的特异性相互作用实现分离纯化。
6. 离子交换层析:利用蛋白质与离子交换树脂之间的电荷相互作用实现分离纯化。
7. 逆流电泳:利用蛋白质在电场中的电荷性质和溶液中的流动,通过逆流电泳系统实现蛋白质的分离纯化。
8. 蛋白质沉淀:利用加入盐、酸、有机溶剂等物质改变蛋白质的溶解度,使其沉淀下来。
以上是常用的蛋白质分离纯化方法,不同方法适用于不同的蛋白质特性和实验目的。
需要根据具体情况选择合适的方法进行操作。
蛋白质分离纯化的一般程序

蛋白质分离纯化的一般程序可分为以下几个步骤:(一)材料的预处理及细胞破碎分离提纯某一种蛋白质时,首先要把蛋白质从组织或细胞中释放出来并保持原来的天然状态,不丧失活性。
所以要采用适当的方法将组织和细胞破碎。
常用的破碎组织细胞的方法有: 1. 机械破碎法这种方法是利用机械力的剪切作用,使细胞破碎。
常用设备有,高速组织捣碎机、匀浆器、研钵等。
2. 渗透破碎法这种方法是在低渗条件使细胞溶胀而破碎。
3. 反复冻融法生物组织经冻结后,细胞内液结冰膨胀而使细胞胀破。
这种方法简单方便,但要注意那些对温度变化敏感的蛋白质不宜采用此法。
4. 超声波法使用超声波震荡器使细胞膜上所受张力不均而使细胞破碎。
5. 酶法如用溶菌酶破坏微生物细胞等。
(二) 蛋白质的抽提通常选择适当的缓冲液溶剂把蛋白质提取出来。
抽提所用缓冲液的pH、离子强度、组成成分等条件的选择应根据欲制备的蛋白质的性质而定。
如膜蛋白的抽提,抽提缓冲液中一般要加入表面活性剂(十二烷基磺酸钠、tritonX-100等),使膜结构破坏,利于蛋白质与膜分离。
在抽提过程中,应注意温度,避免剧烈搅拌等,以防止蛋白质的变性。
(三)蛋白质粗制品的获得选用适当的方法将所要的蛋白质与其它杂蛋白分离开来。
比较方便的有效方法是根据蛋白质溶解度的差异进行的分离。
常用的有下列几种方法:1. 等电点沉淀法不同蛋白质的等电点不同,可用等电点沉淀法使它们相互分离。
2. 盐析法不同蛋白质盐析所需要的盐饱和度不同,所以可通过调节盐浓度将目的蛋白沉淀析出。
被盐析沉淀下来的蛋白质仍保持其天然性质,并能再度溶解而不变性。
3. 有机溶剂沉淀法中性有机溶剂如乙醇、丙酮,它们的介电常数比水低。
能使大多数球状蛋白质在水溶液中的溶解度降低,进而从溶液中沉淀出来,因此可用来沉淀蛋白质。
此外,有机溶剂会破坏蛋白质表面的水化层,促使蛋白质分子变得不稳定而析出。
由于有机溶剂会使蛋白质变性,使用该法时,要注意在低温下操作,选择合适的有机溶剂浓度。
蛋白质分离纯化设计

蛋白质分离纯化设计1. 简介蛋白质分离纯化是一项重要的实验技术,在生物医药、食品科学、农业等领域有着广泛的应用。
通过对蛋白质进行分离纯化,可以获得单一纯度的蛋白质用于后续研究及应用。
本文将详细介绍蛋白质分离纯化的设计方法和常用技术,包括样品准备、分离方法选择、纯化步骤设计等。
同时,我们还将讨论常见的挑战和解决方案,以及如何评估分离纯化效果。
2. 样品准备在进行蛋白质分离纯化前,首先需要准备好样品。
样品的选择和准备对于后续分离纯化过程非常重要。
2.1 选择合适的样品样品可以来自细胞、组织、体液、培养基等。
在选择样品时,需要考虑到蛋白质的种类、表达水平、目标纯化程度以及后续实验需要。
2.2 样品预处理样品在分离纯化前需要进行预处理,以去除可能干扰纯化过程的杂质。
常用的预处理方法包括细胞破碎、离心、除去非蛋白质成分等。
预处理方法的选择应根据样品类型和后续纯化方法进行优化。
3. 分离方法选择根据蛋白质分离的原理和样品特性,我们可以选择合适的分离方法。
常见的分离方法包括离子交换层析、凝胶过滤、透析、亲和层析等。
3.1 离子交换层析离子交换层析是一种基于蛋白质带电性质的分离方法。
可以根据蛋白质的以阴离子或阳离子带电来选择合适的离子交换树脂,实现不同蛋白质的分离纯化。
3.2 凝胶过滤凝胶过滤是一种基于蛋白质大小的分离方法。
通过选择适当的孔径大小的凝胶,可以分离不同分子大小的蛋白质。
3.3 透析透析是一种基于蛋白质分子量和溶液成分的分离方法。
通过选择适当的膜材料和透析缓冲溶液,可以实现蛋白质与小分子化合物的分离。
3.4 亲和层析亲和层析是一种基于蛋白质与配体之间的特异性结合来分离纯化的方法。
选择合适的亲和配体,可以选择性地结合目标蛋白质,从而实现其分离纯化。
4. 纯化步骤设计在选择合适的分离方法后,需要设计纯化步骤来实现目标蛋白质的分离和纯化。
纯化步骤的设计应根据分离方法的特点和目标蛋白质的性质进行优化。
4.1 样品加载将预处理的样品通过适当的装载方式加载到分离纯化柱中,如使用注射器将样品缓慢注入。
蛋白质分离纯化的技术

蛋白质分离纯化的技术前言蛋白质是生物体内非常重要的大分子有机物质,具有各种生物学功能,如结构支持、催化反应、传递信息、运输物质及免疫防御。
而蛋白质的研究和应用,早已成为生命科学的热门领域。
然而,大多数生物体中的蛋白质都混杂着众多的其他大分子物质,为了研究或应用某种特定蛋白质,就需要将它从其它物质中分离纯化出来。
今天我们就要来讲一讲蛋白质分离纯化的技术。
一、蛋白质分离的基本原理蛋白质分离的基本原理是利用不同的性质来分离具有不同特性的蛋白质。
蛋白质的各种性质包括分子大小、分子形状、电荷、亲疏水性、氨基酸序列等。
根据这些不同的性质,分别选择不同的分离纯化方法,可以实现不同程度的分离纯化效果。
二、蛋白质分离纯化技术的分类根据分离方式的不同,蛋白质分离纯化技术可以分为以下几类:1. 分子筛层析:分子筛层析是根据蛋白质的分子大小、形状来进行分离,其原理是在一定的缓冲液中,将特定孔径大小的陶瓷或聚合物微球填充进层析柱,根据蛋白质的分子大小,从层析柱中流出不同的蛋白质。
这种方法可以使蛋白质得到较好的分离纯化,但需要考虑蛋白质的保护。
2. 表面等电聚焦(IEF):表面等电聚焦是根据蛋白质的等电点来进行分离,其原理是在聚丙烯酰胺凝胶电泳板上加上一组垂直于电泳方向的电场,在酸性一端放置一种酸性缓冲液,碱性一端放置一种碱性缓冲液,中间分别加入样品,蛋白质会在等电点处停留,使得不同等电点的蛋白质得到了分离和收获。
这种方法可以进行多品种、高分辨率的蛋白质分离。
3. 亲和层析:亲和层析是根据蛋白质与其他化合物的特异性相互作用进行分离,其原理是特定的化合物置于层析柱中,当特定的蛋白质与化合物结合时,蛋白质就可以纯化出来。
如在层析柱中放入钙离子,就可以纯化出骨钙蛋白,并且可以通过控制钙离子浓度来实现蛋白质的分离。
4. 透析:透析是将样品分子分离于透析膜之内或之外的方法。
通常将混合物放置于透析袋内,在培养基、缓冲液等适当环境中,透析袋内的小分子会从透析膜渗透出去,而较大的蛋白质则被留在透析袋内。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质分离纯化How to detect, analyze and prepare?Different purposes, different protocols Detective/analytical level: nanogram(ng) or picogram(pg)Preparative level: milligram (mg)Protein detection/analysis:1, Hybridization: Western blot2, Immunological Techniques: Elisa & Co-IP3, electrophoresisSDS PAGE, 2-D gel, CE, IEF4, chromatography: HPLC, FPLC,5, Spectrometry: DLS, NMR, Mass-Spect, LC-MS 6, X-ray crystallography…Western blot: Protein-proteinThis method is dependent on the use of a high-quality antibody directed against a desired protein.Southern blot: DNA-DNA (Edward Southern. Detection of specific sequences among DNA fragments separated by gel electrophoresis.J Mol Biol. 1975 Nov 5;98(3):503-17)Northern blot: DNA-RNASDS-PAGE (sodium dodecyl(lauryl) sulfate-polyacrylamide gel electrophoresis)has a number of uses, which include:•Establishing protein size•Protein identification•Determining sample purity•Identifying disulfide bonds•Quantifying proteins•Blotting applicationsN-terminal protein sequencing by Edman chemistry 1.Samples can be supplied in solution or as membrane blots with more than 90% purities(μg level)2.If the sample is not pure enough, it might be separated with SDS-PAGE or 2-D gel electrophoresis and then electrotransfered to ProBlottTM PVDF membrane3.The length limit of the sequence obtained depends on the sample amount, the protein properties etc, ranging from 30 to 70 residues.pI: IEF (Isoelectric focusing)Focusing separation of species in an inhomogeneous medium (pH-gradient) according to their isoelectric points (pI).Molecular weight:SDS PAGE (polyacrylamide gel electrophoresis) HPLC (high pressure liquid chromatography)MS (Mass spectrometry)Protein concentration detection:BSA methodCo-efficientYeast ORF Ygr271c-apMDANTLNVSFEEILKGKKLDEDSIGLTLSP DKDHEDGSQVSPTQDRKELDQVVGEDEK DDFFENo W or Y, extinction coefficient is 0Absorption spectra of the aromatic amino acids in the near-ultraviolet regionFrom D. Wetlaufer, Adv. Protein Chem. (1962) 17:303-390.©1962 Academic PressUV detectionWhat is chromatography (色谱)?it is a broad range of physical methods used to separate and/or to analyze complex mixtures. The components to be separated are distributed between two phases: a stationary phase (固定相) bed and a mobile phase (流动相)which percolates (filters) through the stationary bed.How Does It Work?A mixture of various components enters a chromatography process, and the different components are flushed through the system at different rates.These differential rates of migration as the mixture moves over adsorptive materials provide separation. Repeated sorption/desorption acts that take place during the movement of the sample over the stationary bed determine the rates. The smaller the affinity a molecule has for the stationary phase, the shorter the time spent in a column.Liquid Chromatography1.reverse phase,2.high performance and3.size exclusionProtein surface propertiesReverse phase chromatography (RPC)Based on the hydrophobic interactions between solute (溶质) molecules and immobilized, matrix-bound ligands.RPC has found favour in a wide variety of preparative applications including micropurification of protein fragments for sequencing and process-scale purification of recombinant protein products.RPC also offers the benefit of exceptional flexibility in separation conditions so that either molecules of interest can be bound while contaminants pass through, or contaminants can be bound while the molecule of interest passes through.Reversed phase chromatography (RPC)Binding of the protein in a polar mobile phaseElution by changing the composition of the mobile phase to becomemore non-polarHydrophobic interaction chromatography (HIC)is a technique for the purification and separation of biomolecules based on differences in their surface hydrophobicity.Many biomolecules, generally considered to be hydrophilic, also have sufficient numbers of hydrophobic groups allowing interaction with hydrophobic ligands coupled to the chromatographic matrix.HIC vs RPC–Less substituted matrix –Less hydrophobic ligands–Weaker binding–Elution with water/dilute buffers–Native protein–Adsorption chromatography–Low pressure chromatography –More substituted matrix –More hydrophobic ligands–Stronger binding–Elution with non-polar solvents–Denatured protein–Partition chromatography–High performance liquid chromatography (HPLC)HIC RPCHigh performance liquid chromatography (HPLC)the process is conducted at a high velocity and pressure drop. The column is shorter and has a small diameter, but it is equivalent to possessing a large number of equilibrium stages.Size exclusion chromatography, also known as gel permeation or filtration chromatography (分子筛)does not involve any adsorption and is extremely fast (FPLC).The packing is a porous gel, and is capable of separating large molecules from smaller ones.The larger molecules elute first since they cannot penetrate the pores. This method is common in protein separation and purification.Ion Exchange Chromatography(离子交换层析)Ion exchange chromatography is commonly used in the purification of biological materials.There are two types of exchange:cation exchange (S)in which the stationary phase carries a negative charge, and anion exchange (Q)in which the stationary phase carries a positive charge.An increase in ionic strength is typically used to elute proteins from IEX media. However, it is possible to use a change in pH to displace bound material.Affinity Chromatography(亲和层析)involves the use of packing which has been chemically modified by attaching a compound with a specific affinity for the desired molecules, primarily biological compounds.The packing material used, called the affinity matrix, must be inert and easily modified. Agarose is the most common substance used, in spite of its cost. The ligands, or "affinity tails/tag", that are inserted into the matrix can be genetically engineered to possess a specific affinity.GKPIPNPLLGLDST V5MASMTGGQQMG T7EQKLISEEDL MycProtien Maltose Binding Protein (MBP)HHHHHH Poly-HisYPYDVPDYA HAProtein GSTEYMPME GLU-GLUProteinGFP (Green Fluorescent Protein)KRRWKKNFIAVSAANRFKKISSSGAL Calmodulin Binding ProteinEpitope TagSequenceThe two strategies:1, fish out the target protein from the mix 2, remove the contaminants from the target proteinPurification by removing the target molecule from the contaminants.Affinity chromatography techniques are very specific for the target molecule or for a group of molecules with closely related biological properties. This makes them capable of "fishing out" the target molecule (or the group), leaving all contaminants behind.When applicable these techniques are to be preferred, since they drastically simplify the purification protocol.Purification by removing the contaminants from the target molecule.When a suitable affinity chromatography technique is not at hand, one has to rely on a sequence of general chromatography techniques to remove the contaminants.A typical purification protocol when nothing is known about the target protein employs the IEX-HIC-GF sequence of purification steps.蛋白质的理化性质及其分离策略的选择:1.分子大小2.形状3.溶解度4.电荷5.疏水性6.密度7.亲和能力8.可逆性缔合9.稳定性10.表面活性1.分子大小1.1 透析和超滤1.2 离心、密度梯度离心1.3 凝胶过滤2. 形状球状蛋白具有较小的有效半径(斯托克半径)膜过滤凝胶过滤3. 溶解度等电点沉淀盐溶(NaCl)和盐析(NH4)2 SO4有机溶剂(PEG, Ethanol)分级4. 电荷电泳(pI: 0.02 pH unit)离子交换5. 疏水性蛋白质表面的疏水氨基酸残基的数目和分布6. 密度一般1.3-1.4 g/ml含大量磷酸盐或脂质的蛋白质不同7. 亲和能力重组融合蛋白(GST-, His-tag et al.)配基(底物、抑制剂、辅因子、抗体)8. 可逆性缔合在不同条件下,蛋白质的聚合状态可能不同9. 稳定性热稳定性酶解稳定性10. 表面活性泡沫分离反胶团相转移聚合物-盐-水液-固萃取体系。
