生物化学简答题
生物化学简答题及答案

1.说明动物体内氨的来源、转运和去路。
答:(一)体内氨的来源1.氨基酸脱氨氨基酸脱氨基作用产生的氨是体内氨的主要来源。
2.肠道吸收的氨一是肠道细菌通过腐败作用分解蛋白质和氨基酸产生氨,二是血中尿素扩散入肠道后经细菌尿素酶作用下水解产生氨。
3.肾小管上皮细胞分泌氨在肾小管上皮细胞内,谷氨酰胺酶催化谷氨酰胺水解生成谷氨酸和氨。
肠道和原尿中的pH对氨的来源有一定的影响,NH3易吸收入血,NH+4不易透过生物膜,在碱性环境中,NH+4易转变为NH3,所以肠道pH 偏碱时,氨的吸收增加。
(二)氨的转运1.丙氨酸一葡萄糖循环肌肉中的氨基酸经转氨基作用将氨基转给丙酮酸生成丙氨酸,丙氨酸经血液运到肝。
在肝中,丙氨酸通过联合脱氨基作用,释放出氨,用于合成尿素。
转氨基后生成的丙酮酸可经糖异生途径生成葡萄糖,葡萄糖由血液输送到肌组织,沿糖分解途径转变成丙酮酸,后者再接受氨基而生成丙氨酸。
这一途径称为丙氨酸一葡萄糖循环。
通过这个循环,即使肌肉中的氨以无毒的丙氨酸形式运输到肝。
2.谷氨酰胺的生成作用在脑、心脏及肌肉等组织中,谷氨酸与氨由谷氨酰胺合成酶催化生成谷氨酰胺。
谷氨酰胺生成后可及时经血液运向肾、小肠及肝等组织,以便利用。
在肾由谷氨酰胺酶水解为谷氨酸与氨,氨被释放到肾小管腔中和肾小管腔的H’以增进机体排泄多余的酸。
所以,谷氨酰胺是氨的解毒产物,也是氨的储存及运输的形式。
(三)氨的去路1.尿素合成这是氨的主要代谢去路。
肝是合成尿素最主要的器官,通过鸟氨酸循环过程完成的。
首先NH3和CO2在ATP、Mg2+及N\|乙酰谷氨酸存在时,合成氨基甲酰磷酸,氨基甲酰磷酸在线粒体中与鸟氨酸氨在鸟氨酸氨基甲酰基转移酶催化下,生成瓜氨酸,然后瓜氨酸与另一分子的氨结合生成精氨酸,最后在精氨酸酶的作用下,水解生成尿素和鸟氨酸。
鸟氨酸再重复上述反应。
尿素合成是一个耗能过程,每生成一分子尿素需要4个高能键,尿素中的两个氮原子,一个来自氨基酸脱氨基生成的氨,另一个则来自天冬氨酸。
生物化学简答题

1.比较三种可逆性抑制作用的特点。
(1)竞争性抑制:抑制剂的结构与底物结构相似,共同竞争酶的活性中心。
抑制作用的大小与抑制剂与底物的浓度以及酶对它们的亲和力有关。
Km值升高,Vm不变。
(2)非竞争性抑制:抑制剂的结构与底物结构不相似或不同,只与酶活性中心外的必需基因结合。
不影响酶与底物的结合。
抑制作用的强弱只与抑制剂的浓度有关。
Km值不变,Vm 下降。
(3)反竞争性抑制:抑制剂只与酶-底物复合物结合,生成的三元复合物不能解离为产物。
Km,Vm均下降。
DNA复制与转录过程的异同点。
DNA的复制与转录的相同点:复制和转录都是酶促的核苷酸聚合的过程,有以下相似之处,都以DNA为模板;都需依赖DNA的聚合酶;聚合过程都是核苷酸之间生成磷酸二酯键;都从5′至3′方向延伸成新链多聚核苷酸;都遵从碱基配对规律。
复制与转录的不同点:1 转录以DNA单链为模版而复制以双链为模板2 转录用的无引物而复制以一段特异的RNA为引物3 转录和复制体系中所用的酶体系不同4转录和复制的配对的碱基不完全一样,转录中A对U,而复制中A对T,而且转录体系中有次黄嘌呤碱基的引入(1)三羧酸循环在线粒体基质中进行,反应过程的酶,除了琥珀酸脱氢酶是定位于线粒体内膜外,其余均位于线粒体基质中主要事件顺序为:1)乙酰CoA与草酰乙酸结合,生成柠檬酸,放出CoA。
柠檬酸合成酶。
2)柠檬酸先失去一个H2O而成顺乌头酸,再结合一个H2O转化为异柠檬酸。
顺乌头酸酶 3)异柠檬酸发生脱氢、脱羧反应,生成a-酮戊二酸,放出一个CO2,生成一个NADH+H+。
异柠檬酸脱氢酶4)a-酮戊二酸氧化脱羧生成琥珀酰CoA,放出一个CO2,生成一个NADH+H+。
酮戊二酸脱氢酶5)琥珀酰辅酶A合成酶催化底物水平磷酸化反应6)琥珀酸脱氢生成延胡索酸,生成1分子FADH2,琥珀酸脱氢酶 7)延胡索酸和水化合而成苹果酸。
延胡索酸酶8)苹果酸氧化脱氢,生成草酸乙酸,生成1分子NADH+H+。
生物化学简答题

什么是蛋白质的二级结构,他主要有哪几种?α-螺旋,β -折叠,β- 转角和无规则卷曲四种。
蛋白质的二级结构是指多肽链主链原子的局部空间排布,不包括侧链的构象。
它主要有简述α- 螺旋结构特征:1、在α-螺旋结构中,多肽链主要围绕中心轴以右手螺旋方式螺旋上升,每隔 3.6 个氨基酸残基上升一圈,螺距为 0.54nm2、氨基酸残基的侧链伸向螺旋外侧。
3、每个氨基酸残基的亚氨基上的氢与第四个氨基酸残基羟基上的氧形成氢键,以维持α-螺旋稳定。
简述常用蛋白质分离、纯化方法:盐析、透析、超速离心、电泳、离子交换层析、分子筛层析。
简述谷胱甘肽的结构和功能:组成:谷胱甘肽由谷氨酸、半胱氨酸和甘氨酸构成的活性三肽,功能基团:半胱氨酸残基中的巯基。
功能:1、作为还原剂清除体内 H2O2,使含巯基的酶或蛋白质免遭氧化,维持细胞膜的完整性。
2.具有嗜核特性,与亲电子的毒物或药物结合,保护核酸和蛋白质免遭损害。
1、一条多肽链中,带有相同电荷的氨基酸彼此相邻,相互排斥,妨碍α- 螺旋的形成。
哪些原因影响蛋白质α- 螺旋结构的形成或稳定?2、含有大侧链的氨基酸残基,彼此相邻,空间位阻较大也会影响α -螺旋的形成。
3、脯氨酸为亚氨基酸,亚氨基酸形成肽键后,没有了游离的氢,不能形成氢键,因此不能形成α-螺旋。
酶的化学修饰的特点是什么:①在化学修饰过程中,酶发生无活性和有活性两种形式的互变②该修饰时共价键的变化,最常见的是磷酸化和去磷酸化修饰③常受激素的调控④是酶促反应⑤有放大效应酶的变构调节特点是什么:细胞内一些中间代谢产物能与某些酶分子活性中心以外的某一部位以非共价键可逆结合,使酶构象发生改变并影响其催化活性,进而调节代谢反应速率,这种现象为变构反应,其特点是①变构酶常由多个亚基构成②变构效应剂常结合在活性中心以外的调节部位,引起酶空间构象的改变,从而改变酶的活性③变构效应剂与调节部位以非共价键结合④酶具有无活性和有活性两种方式互变⑤不服从米曼氏方程,呈S 型曲线酶和一般催化剂比较有何异同:相同点:①反应前后无质和量的改变②不改变反应的平衡点③只催化热力学允许的反应④都是通过降低反应活化能而增加反应速率的不同点①酶的催化效率高②酶对底物有高度特异性③酶活性的可调节性,酶的催化作用多受多种因素调节④酶是蛋白质,对反应条件要求严格,如温度、pH 等简述 Km 和 Vmax 的意义:Km的意义:①Km等于反应速率为最大速率一半时的底物浓度②一些酶的K2 >> K3,Km 可表示酶和底物的亲和力③ Km 值是酶的特征性常数,它与酶结构,酶所催化的底物和反应环境如温度、pH 、离子强度等有关,而与酶浓度无关Vmax 的意义: Vmax 是酶被底物完全饱和时的反应速率简述何谓酶原与酶原激活的意义:一些酶在细胞合成时,没有催化活性,需要经一定的加工剪切才有活性。
(整理)生物化学简答题

2 什么是蛋白质的二级结构,主要包括哪几种,各有什么结构特征?3 变性概念、本质、特征及在日常生活中应用。
4 热变性DNA具有什么特征?5 试说明DNA双螺旋结构模型的要点及与DNA生物学功能的关系。
6 核酸杂交技术的基础是什么?有哪些应用价值?7 简述蛋白质的一、二、三、四级结构。
8 固定化酶的概念、优点、制备方法。
9 酶的特点及其高效作用机理。
10 酶的活性中心和必需基团及其关系。
11 辅酶与辅基有何不同?维生素(3种以上)与辅酶(辅基)的关系?在代谢中的应用。
12 简述蛋白质酶和修饰酶在新药研究中的应用以及核酶和抗体酶对新药设计的指导意义。
13 请从各个方面比较糖酵解和糖的有氧氧化的异同。
14 比较糖酵解和糖的有氧氧化的异同。
15 比较DNA、RNA在化学组成、结构、功能上各有何特点、16 比较原核细胞的mRNA和真核细胞的mRNA的结构特点。
17 比较哺乳动物脂肪酸β氧化和合成的主要区别。
18 脂肪酸β氧化和合成。
19 糖酵解和糖的有氧氧化。
20 糖在机体内主要代谢途径及重要生物学意义。
21 酮体的生成、利用和意义。
22 简述乙酰CoA的体内来源与去路及其细胞定位。
23 什么是尿素循环、过程?有什么生理意义?24 大肠杆菌DNA复制过程。
25 蛋白质生物合成过程。
26 何谓抗代谢物?简述磺胺药、氨甲喋呤等药物作用机制。
27 生物技术主要研究内容及在现代药学新药研究应用。
28 简述基因工程的基本原理和一般过程及在制药领域应用。
29 有哪些生物化学研究成果被用于新药设计和筛选研究?试分别举例说明之。
30 简述蛋白质纯化的常用方法及其基本原理。
31 利用蛋白质电离性质可采用哪些方法将其分离纯化?举例说明。
2 什么是蛋白质的二级结构,主要包括哪几种,各有什么结构特征?3 变性概念、本质、特征及在日常生活中应用。
4 热变性DNA具有什么特征?5 试说明DNA双螺旋结构模型的要点及与DNA生物学功能的关系。
生物化学简答题
2.简述三羧酸循环的生理意义是什么?它有哪些限速步骤?生理意义:三羧酸循环是机体获取能量的主要方式;为生物合成提供原料;影响果实品质糖;脂肪和蛋白质代谢的枢纽限速步骤:1)在柠檬酸合酶的作用下,由草酰乙酸和乙酰-CoA合成柠檬酸2)在异柠檬酸脱氢酶催化下,异柠檬酸脱氢形成草酰琥珀酸。
3)在α-酮戊二酸脱氢酶系作用下,α-酮戊二酸氧化、脱羧,生成琥珀酰-CoA、 NADH+H+和CO2。
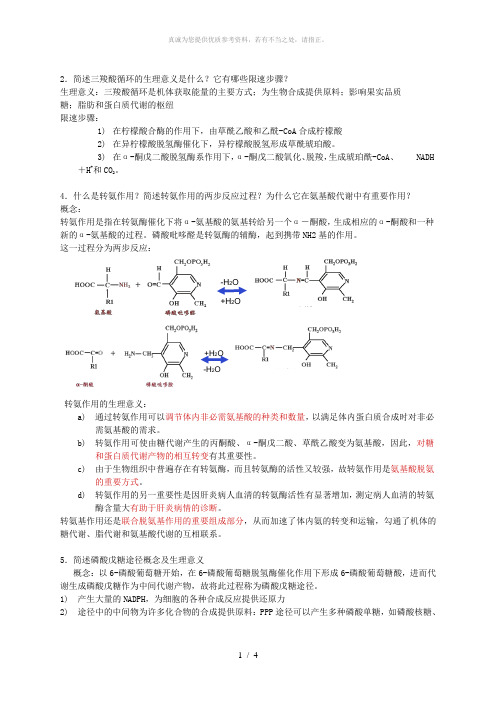
4.什么是转氨作用?简述转氨作用的两步反应过程?为什么它在氨基酸代谢中有重要作用?概念:转氨作用是指在转氨酶催化下将α-氨基酸的氨基转给另一个α-酮酸,生成相应的α-酮酸和一种新的α-氨基酸的过程。
磷酸吡哆醛是转氨酶的辅酶,起到携带NH2基的作用。
这一过程分为两步反应:-H2O+H2O+H2O-H 2O转氨作用的生理意义:a)通过转氨作用可以调节体内非必需氨基酸的种类和数量,以满足体内蛋白质合成时对非必需氨基酸的需求。
b)转氨作用可使由糖代谢产生的丙酮酸、α-酮戊二酸、草酰乙酸变为氨基酸,因此,对糖和蛋白质代谢产物的相互转变有其重要性。
c)由于生物组织中普遍存在有转氨酶,而且转氨酶的活性又较强,故转氨作用是氨基酸脱氨的重要方式。
d)转氨作用的另一重要性是因肝炎病人血清的转氨酶活性有显著增加,测定病人血清的转氨酶含量大有助于肝炎病情的诊断。
转氨基作用还是联合脱氨基作用的重要组成部分,从而加速了体内氨的转变和运输,勾通了机体的糖代谢、脂代谢和氨基酸代谢的互相联系。
5.简述磷酸戊糖途径概念及生理意义概念:以6-磷酸葡萄糖开始,在6-磷酸葡萄糖脱氢酶催化作用下形成6-磷酸葡萄糖酸,进而代谢生成磷酸戊糖作为中间代谢产物,故将此过程称为磷酸戊糖途径。
1)产生大量的NADPH,为细胞的各种合成反应提供还原力2)途径中的中间物为许多化合物的合成提供原料:PPP途径可以产生多种磷酸单糖,如磷酸核糖、4-磷酸赤藓糖与磷酸烯醇式丙酮酸等。
生物化学各章节简答题归纳总结

生物化学第一章蛋白质的结构与功能1、用凯氏定氮法测得0.1g大豆中氮含量为4.4mg,试计算100g大豆中含多少克蛋白质?答:0.1g大豆中氮含量为 4.4mg,即0.044g/1g,则100g大豆含蛋白质含量为0.044x100x6.25=27.5g。
2、氨基酸侧链上可解离的功能基团有哪些?试举例说明之?答:不同的氨基酸侧链上具有不同的功能基团,如丝氨酸和苏氨酸残基上有羟基,半胱氨酸残基上有巯基,谷氨酸和天冬氨酸残基上有羧基,赖氨酸残基上有氨基,精氨酸残基上有胍基,酪氨酸残基上有酚羟基等。
3、使蛋白质沉淀的方法有哪些?简述之。
答:使蛋白质沉淀的方法主要有四种:①中性盐沉淀蛋白质,即盐析法。
②有机溶剂沉淀蛋白质。
③重金属盐沉淀蛋白质。
④有机酸沉淀蛋白质。
4、何谓蛋白质的变性作用?有何实际意义。
答:蛋白质的变性作用是指蛋白质在某些理化因素的作用下,其空间结构发生改变(不改变其一级结构),因而失去天然蛋白质的特性,这种现象称为蛋白质的变性作用。
意义:利用变性原理,如用乙醇、加热和紫外线消毒灭菌,用热凝固法检查尿蛋白等;防止蛋白质变性,如制备或保存酶、疫苗、免疫血清等蛋白质制剂时,应选择适当条件,防止其变性失活。
5、什么是蛋白质的两性电离和等电点?答:蛋白质分子中既有能解离成阴离子的基团,所以蛋白质是两性电解质。
在某一pH溶液中,蛋白质分子可成为带正电荷和负电荷相等的兼性离子,即蛋白质分子的净电荷为零,此时溶液的pH称为该蛋白质的等电点。
6、为什么说蛋白质的一级结构决定其空间结构?答:蛋白质一级结构指蛋白质多肽链中氨基酸残基的排列顺序。
因为蛋白质分子肽链的排列顺序包含了自动形成复杂的三维结构(即正确的空间构象)所需要的全部信息,所以一级结构决定其高级结构。
7、蛋白质的α-螺旋结构有何特点?答:α-螺旋结构特点有:①多肽链主链绕中心轴旋转,形成螺旋结构,每个螺旋含有3.6个氨基酸残基,螺距有0.54nm,氨基酸之间的轴心距为0.15nm。
生物化学简答题

生物化学简答题1. 产生ATP的途径有哪些?试举例说明。
答:产生ATP的途径要紧有氧化磷酸化和底物水平磷酸化两条途径。
氧化磷酸化是需氧生物ATP生成的要紧途径,是指与氢和电子沿呼吸链传递相偶联的ADP磷酸化进程。
例如三羧酸循环第4步,α-酮戊二酸在α-酮戊二酸脱氢酶系的催化下氧化脱羧生成琥珀酰CoA的反映,脱下来的氢给了NAD+而生成NADH+H+,1分子NADH+H+进入呼吸链,通过呼吸链递氢和递电子,可有个ADP磷酸化生成ATP的偶联部位,这确实是通过氧化磷酸化产生了ATP。
底物水平磷酸化是指直接与代谢底物高能键水解相偶联使ADP磷酸化的进程。
例如葡萄糖无氧氧化第7步,1,3-二磷酸-甘油酸在磷酸甘油酸激酶的催化下生成3-磷酸甘油酸,在该反映中由于底物1,3-二磷酸-甘油酸分子中的高能磷酸键水解断裂能释放出大量能量,可偶联推动ADP磷酸化生成ATP,这确实是通过底物水平磷酸化产生了ATP。
2.简述酶作为生物催化剂与一样化学催化剂的共性及其特性。
(1)共性:用量少而催化效率高;仅能改转变学放映速度,不能改转变学反映的平稳点,酶本身在化学反映前后也不改变;可降低化学反映的活化能。
(2)特性:酶作为生物催化剂的特点是催化效率更高,具有高度专一性,容易失活,活力受条件的调剂操纵,活力与辅助因子有关。
3.什么是乙醛酸循环,有何生物学意义?乙醛酸循环是一个有机酸代谢环,它存在于植物和微生物中,在动物组织中尚未发觉。
乙醛酸循环反映分为五步(略)。
总反映说明,循环每转1圈需要消耗两分子乙酰辅酶A,同时产生一分子琥珀酸。
琥珀酸产生后,可进入三羧酸循环代谢,或变成葡萄糖乙醛酸循环的意义分为以下几点:(1)乙酰辅酶A经乙醛酸循环可生成琥珀酸等有机酸,这些有机酸可作为三羧酸循环中的基质。
(2)乙醛酸循环是微生物利用乙酸作为碳源建造自身机体的途径之一。
(3)乙醛酸循环是油料植物将脂肪酸转变成糖的途径。
3. 简述氨基酸代谢的途径。
生物化学名词解释和简答题综合终极版

生物化学名词解释和简答题名词解释1.两性离子:又称兼性离子,偶极离子,即在同一分子中含有等量的正负两种电荷。
2.等电点:蛋白质是两性电解质,溶液中蛋白质的带电情况与它所处环境的pH有关。
调节溶液的Ph值,可以使一个蛋白质带正电或带负电或不带电;在某一pH时,蛋白质分子中所带的正电荷数目与负电荷数目相等,即静电荷为零,且在电场中不移动,此时溶液的pH值即为该中蛋白质的等电点。
3.构型:指在立体异构体中,取代基团或原子因受某种因素的限制,在空间取不同的位臵所形成的不同立体异构。
4.构象:指分子内各原子或基团之间的相互立体关系。
构象的改变是由于单键的旋转儿产生的,不需有共价键变化(断裂或形成),但涉及到氢键等次级键的改变。
5.结构域:结构域又成为辖区。
在较大的蛋白质中,往往存在两个或多个在空间上可明显区分的、相对独立的三维实体,这样的三维实体即结构域;结构域自身是紧密装配的,但结构域与结构域之间关系松懈。
结构域与结构域之间常常有一段长短不等的肽链相连,形成所谓铰链区。
6.蛋白质一ֻ二.三.四级结构以及超二级结构:蛋白质中氨基酸的排列顺序称为蛋白质的一级结构。
多肽链中的主骨架上所含的羰基和亚氨基,在主链骨架盘绕折叠时可以形成氢键,依靠这种氢键维持固定,多肽链主链骨架上的若干肽段可以形成有规律性的空间排布而其它部分在空间的排布是无规则的,如无规则的卷曲结构。
这种由多肽链主链骨架盘绕折叠,依靠氢键维持固定所形成的有规律性结构称为蛋白质的二级结构,包括无规则卷曲结构。
二级结构与侧链R的构象无关。
维持二级结构稳定的化学键主要是氢键。
蛋白质分子中的多肽链在二级结构或超二级结构甚至结构域的基础上进一步盘绕折叠,依靠非共价键(如氢键、离子键、疏水的相互作用等)维系固定所形成的特定空间结构称为蛋白质的三级结构。
三级结构指多肽链所有原子在空间中的排布。
此外,在某些蛋白质分子中,二硫键对其三级结构的稳定也起重要的作用。
有些蛋白质分子中含有两条或多条肽链,每一条肽链都具有各自的三级结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
什么是蛋白质的二级结构,他主要有哪几种?蛋白质的二级结构是指多肽链主链原子的局部空间排布,不包括侧链的构象。
它主要有α-螺旋,β-折叠,β-转角和无规则卷曲四种。
简述α-螺旋结构特征:1、在α-螺旋结构中,多肽链主要围绕中心轴以右手螺旋方式螺旋上升,每隔3.6个氨基酸残基上升一圈,螺距为0.54nm2、氨基酸残基的侧链伸向螺旋外侧。
3、每个氨基酸残基的亚氨基上的氢与第四个氨基酸残基羟基上的氧形成氢键,以维持α-螺旋稳定。
简述常用蛋白质分离、纯化方法:盐析、透析、超速离心、电泳、离子交换层析、分子筛层析。
简述谷胱甘肽的结构和功能:组成:谷胱甘肽由谷氨酸、半胱氨酸和甘氨酸构成的活性三肽,功能基团:半胱氨酸残基中的巯基。
功能:1、作为还原剂清除体内H2O2,使含巯基的酶或蛋白质免遭氧化,维持细胞膜的完整性。
2.具有嗜核特性,与亲电子的毒物或药物结合,保护核酸和蛋白质免遭损害。
哪些原因影响蛋白质α-螺旋结构的形成或稳定?1、一条多肽链中,带有相同电荷的氨基酸彼此相邻,相互排斥,妨碍α-螺旋的形成。
2、含有大侧链的氨基酸残基,彼此相邻,空间位阻较大也会影响α-螺旋的形成。
3、脯氨酸为亚氨基酸,亚氨基酸形成肽键后,没有了游离的氢,不能形成氢键,因此不能形成α-螺旋。
酶的化学修饰的特点是什么:①在化学修饰过程中,酶发生无活性和有活性两种形式的互变②该修饰时共价键的变化,最常见的是磷酸化和去磷酸化修饰③常受激素的调控④是酶促反应⑤有放大效应酶的变构调节特点是什么:细胞内一些中间代谢产物能与某些酶分子活性中心以外的某一部位以非共价键可逆结合,使酶构象发生改变并影响其催化活性,进而调节代谢反应速率,这种现象为变构反应,其特点是①变构酶常由多个亚基构成②变构效应剂常结合在活性中心以外的调节部位,引起酶空间构象的改变,从而改变酶的活性③变构效应剂与调节部位以非共价键结合④酶具有无活性和有活性两种方式互变⑤不服从米曼氏方程,呈S型曲线酶和一般催化剂比较有何异同:相同点:①反应前后无质和量的改变②不改变反应的平衡点③只催化热力学允许的反应④都是通过降低反应活化能而增加反应速率的不同点①酶的催化效率高②酶对底物有高度特异性③酶活性的可调节性,酶的催化作用多受多种因素调节④酶是蛋白质,对反应条件要求严格,如温度、pH等简述Km和Vmax的意义:Km的意义:①Km等于反应速率为最大速率一半时的底物浓度②一些酶的K2>>K3,Km可表示酶和底物的亲和力③Km值是酶的特征性常数,它与酶结构,酶所催化的底物和反应环境如温度、pH、离子强度等有关,而与酶浓度无关Vmax 的意义:Vmax是酶被底物完全饱和时的反应速率简述何谓酶原与酶原激活的意义:一些酶在细胞合成时,没有催化活性,需要经一定的加工剪切才有活性。
这类无活性的酶的前体称为酶原。
在合适的条件下和特定的部位,无活性的酶原向有活性的酶转化的过程称为酶原的激活。
酶原激活的意义:酶原形式的存在及酶原的激活有重要的生理意义。
消化道蛋白酶以酶原形式分泌,避免了胰腺细胞和细胞外间质的蛋白被蛋白酶水解而破坏,并保证酶在特定环境及部位发挥其催化作用。
正常情况下血管内凝血酶原不被激活,则无血液凝固发生,保证血流通畅运行。
一旦血管破损,凝血酶原激活成凝血酶,血液凝固发生催化纤维蛋白酶原变成纤维蛋白阻止大量失血,起保护机体作用举例说明什么是同工酶,有何意义:同工酶使指催化相同的化学反应,但酶分子结构、理化性质及免疫学性质等不同的一组酶意义:①同工酶可存在于不同个体的不同组织中,也可存在于同一个体同一组织中和同一细胞中。
它使不同的组织、器官和不同的亚细胞结构具有不同的代谢特征。
例如:LDH1和LDH5分别在心肌和肝脏高表达②还可以作为遗传标志,用于遗传分析研究。
在个体发育的不同阶段,同一组织也可因基因表达不同而有不同的同工酶谱,即在同一个体的不同发育阶段其同工酶亦有不同③同工酶的测定对于疾病的诊断及预后判定有重要意义。
如心肌梗死后3~6小时血中CK2活性升高,24小时酶活性到达顶峰,3天内恢复正常水平金属离子作为辅助因子的作用有哪些:①作为酶活性中心的催化基因参加反应,传递电子②作为连接酶与底物的桥梁,便于酶和底物密切接触③为稳定酶的空间构象④中和阴离子,降低反应的静电斥力酶的必需基团有哪几种,各有什么作用:酶的必需基团包括活性中心内的必需基团和活性中心外的必需基团。
活性中心内的必需基团有结合基团和催化基团。
结合基团结合底物和辅酶,使之与酶形成复合物。
能识别底物分子特异结合,将其固定于酶的活性中心。
催化基团影响底物分子中某些化学键的稳定性,催化底物发生化学反应,并最终将其转化为产物。
活性中心外的必需基团为维持酶活性的空间构象所必需何谓酶促反应动力学,影响酶促反应速率的因素有哪些:酶促反应动力学是研究酶促反应速率及影响酶促反应速率各因素的科学,影响酶促反应速率的因素有酶浓度、底物浓度、pH、温度、抑制剂及激活剂等①在在其他因素不变的情况下,底物浓度的变化对反应速率影响的作图时呈矩形双曲线的②底物足够时,酶浓度对反应速率的影响呈直线关系③温度对反应速率的影响具有双重性④pH通过改变酶和底物分子解离状态影响反应速率⑤抑制剂可逆或不可逆的降低酶促反应速率⑥激活剂可加快酶促反应速率举例说明竞争性抑制作用在临床上的应用:以磺胺类药物为例:①对磺胺类药物敏感的细菌在生长繁殖时,不能直接利用环境中的叶酸,而是在菌体内二氢叶酸合成酶的催化下,以对氨基苯甲酸为底物合成二氢叶酸。
二氢叶酸是核苷酸合成过程中的辅酶之一四氢叶酸的前体②磺胺类药物的化学结构与对氨基甲苯酸相似,是二氢叶酸合成酶的竞争性抑制剂,抑制二氢叶酸的合成。
细菌则因核苷酸乃至核酸的合成受阻而影响其生长繁殖。
人类能直接利用食物中的叶酸,体内的核酸合成不受磺胺类药物的干扰。
③根据竞争性抑制剂的特点,服用磺胺类药物时必须保持血液中药物的高浓度,以发挥其有效竞争性抑菌作用许多属于抗代谢物的抗癌药物,如氨甲喋呤、5-氟尿嘧啶、6-巯基嘌呤等,几乎都是酶的竞争性抑制剂,它们分别抑制四氢叶酸、脱氧胸苷酸及嘌呤核苷酸的合成,以抑制肿瘤的生长比较三种可逆性抑制作用的特点:①竞争性抑制:抑制剂的结构与底物结构相似,共同竞争酶的活性中心。
抑制作用大小与抑制剂和底物的浓度以及酶对它们的亲和力有关。
Km升高,Vmax不变②非竞争性抑制:抑制剂与底物结构不相似或完全不同,只与酶活性中心外的必需基团结合。
不影响酶在结合抑制剂后与底物的结合。
该抑制作用的强弱只与抑制剂的浓度有关。
Km不变,Vmax下降③反竞争抑制剂:抑制剂只与酶-底物复合物结合,生成的三元复合物不能解离出产物。
Km和Vmax均下降生物氧化的特点:1、在细胞内温和的环境中(提问,PH接近中性):在一系列酶的催化下逐步进行:能量逐步释放有利于ATP的形成;广泛的加氢脱水反应使物质能间接获得氧,并增加脱氢的机会;产生的水是由脱下的氢与氧结合产生的,CO2由有机酸脱羧产生。
氧化磷酸化的抑制剂有哪些,请举例说明:1、呼吸链抑制剂:鱼藤酮、粉蝶霉素A、异戊巴比妥、抗霉素A、二巯基丙醇、CO、CN-、N3及H2S。
2、解偶联剂:二硝基苯酚。
3、氧化磷酸化抑制剂:寡霉素。
NADH呼吸链的电子传递顺序;如果加入异戊巴比妥结果将如何?NAD H→FMN(Fe-S)→CoQ→Cyt b→Cyt c1→Cyt c→Cyt aa3→1/2O2,异戊巴比妥与FMN结合,从而阻断电子传递链,使电子传递终止,细胞呼吸停止。
体内生成ATP的两种方式的什么,以哪种为主?底物水平磷酸化和氧化磷酸化。
前者指直接将代谢物分子中的能量转移给ADP(或者GDP)而生成ATP(或GTP)的过程。
后者指代谢物脱下的2H在呼吸链电子传递过程中偶联ADP磷酸化而生成ATP的过程,这是产生ATP的主要方式。
简述胞液中的还原当量(H+)的两种穿梭途径:在胞液中生成的H+不能直接进入线粒体经呼吸链氧化,需借助穿梭作用才能进入线粒体内。
其中通过α-磷酸甘油穿梭,2H氧化时进入琥珀酸呼吸链,生成1.5分子ATP;进过苹果酸-天冬氨酸的穿梭作用,则进入NADH呼吸链,生成2.5分子ATP。
磷酸戊糖途径的生理意义:(1)为核酸的生物合成提供核糖(2)提供NADPH作为供氢体参与多种代谢反应:a.NADPH是体内许多合成代谢的供氢体,如脂肪酸和胆固醇的合成.b. NADPH参与体内羟化反应,与生物合成和生物转化有关.c. 用于维持GSH的还原状态,保护-SH基蛋白和-SH酶免受氧化及的损坏:保护红细胞膜的完整性.TCA循环的要点: a乙酰CoA经TCA循环被氧化成2分子CO2;b 有4次脱氢反应,其中3次由NAD+接受,1次由FAD接受:c 有3个不可逆反应,分别由柠檬酸合酶、异柠檬酸脱氢酶、a-酮戊二酸脱氢酶催化;d 消耗2分子水(柠檬酸合酶及延胡索酸酶反应);e 发生1次底物水平磷酸化反应(由琥珀酰CoA合成酶催化)糖异生的关键酶反应:丙酮酸羧化酶:丙酮酸+CO2+ATP→草酰乙酸+ADP+Pi 磷酸烯醇式丙酮酸羧激酶:草酰乙酸+GTP→磷酸烯醇式丙酮酸+GDP 果糖双磷酸酶-1: 1,6-双磷酸果糖+H2O→6-磷酸果糖+Pi 葡萄糖-6-磷酸酶:6-磷酸葡萄糖+H2O→葡萄糖+Pi。
6-磷酸葡萄糖的代谢途径及其在糖代谢中的作用:1来源:a葡萄糖经糖酵解途径中的己糖激酶或葡萄糖激酶催化磷酸化反应生成;b.由糖原分解产生的1-磷酸葡萄糖异构生成;c非糖物质经糖异生途径由6-磷酸果糖异构生成. 2.去路:a经糖酵解生成乳酸;b.经有氧氧化彻底分解为CO2和水;c.由变位酶催化生成1-磷酸葡萄糖,参与糖原合成;d.在6-磷酸葡萄糖脱氢酶的催化下进入磷酸戊糖途径;e异生为葡萄糖. 3.由此可见,6-磷酸葡萄糖是糖代谢多种途径的交叉点,是各代谢途径的共同中间产物.6-磷酸葡萄糖的代谢去向取决于各代谢途径中相关酶的活性大小.Cori循环形成的原因及其生理意义:形成是由于肝脏和肌肉组织的代谢特点所致.肝内糖异生活跃,有葡萄糖-6-磷酸酶水解6-磷酸葡萄糖,释放出游离葡萄糖.而肌肉组织不能进行糖异生,没有葡萄糖-6-磷酸酶.因此,肌肉组织内生成的乳酸既不能异生成糖,又不能释放出游离葡萄糖.G-6-P在肝脏的代谢去路:1经糖酵解生成乳酸;2经有氧氧化生成CO2和水;3通过异构变成G-1-P,进而合成糖原;4进入磷酸戊糖途径;5糖异生途径中经葡萄糖-6-磷酸酶水解成葡萄糖.膜受体介导信息传递;激素膜受体G蛋白酶信使蛋白激酶酶或功能蛋白磷酸化生物学效应高血糖使血糖升高机制胰高血糖素与肝细胞受体结合激活Ga,在通过腺苷酸环化酶使ATP 环化为cATP继而活化PKA,可促进磷酸化酶b激酶的磷酸化而火花,后者又使磷酸化酶b磷酸化而活化为磷酸化酶a,磷酸化酶a可促进肝糖原降解为1磷酸葡萄糖,在转变为游离葡萄糖而提供血糖,促进糖原分解,,另一方面,PKA还可使糖原合酶磷酸化而失活,从而减少糖原合成,促使血糖升高类固醇激素作用机制类固醇激素进入核内与相应受体结合,受体构象发生变化,导致热休克蛋白解聚,暴露出受体核定位区及DNA 结合区,使激素受体复合物向核内转移,并结合靶基因临近的激素反应原件上,进而改变基因表达谱,诱导合成特异蛋白质而表现其生理作用简述细胞内小分子第二信使共同特点1在完整细胞内,该分子浓度或分布在细胞外信号作用下发生迅速改变2该分子类似物可模拟细胞外信号的作用3阻断该分子的变化可阻断细胞对外援分子的反应4作为别构效应剂在细胞内有特定的靶蛋白分子简述Ca依赖性蛋白激酶途径的信号转导过程激素与受体结合为激素受体复合物,激素受体复合物激活G蛋白,G进一步激活PI-PLC,水解细胞膜上的PIP2,生成IP3,DG。
