2012高考化学一轮复习课件:专题8第3单元盐类的水解知识研习苏教版
高考化学一轮复习 第1部分 专题8 第3单元 盐类的水解教案 苏教版-苏教版高三全册化学教案
盐类的水解考纲定位核心素养1.了解盐类水解的原理。
2.了解影响盐类水解的主要因素。
3.了解盐类水解的应用。
4.能正确书写盐类水解的化学或离子方程式。
1.变化观念——从盐类的水解反应认识化学变化的原理及应用。
2.平衡思想——能从动态的角度分析水解平衡的实质原理、特征和影响因素。
3.模型认知——建立溶液中粒子浓度比较模型如电荷守恒、物料守恒和质子守恒模型。
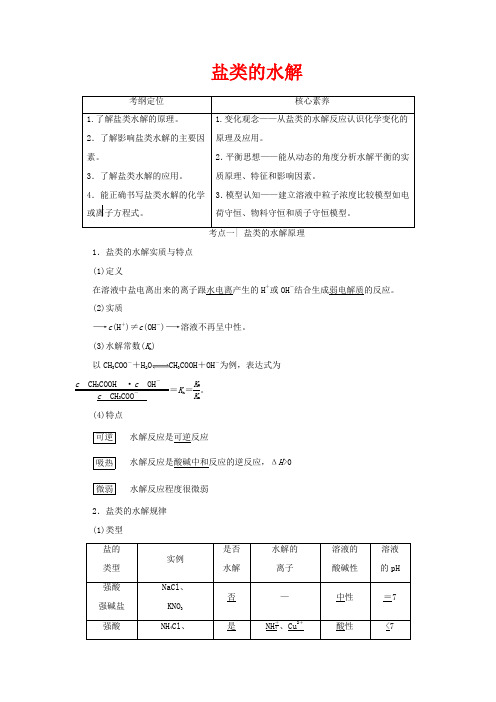
考点一| 盐类的水解原理1.盐类的水解实质与特点(1)定义在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成弱电解质的反应。
(2)实质―→c(H+)≠c(OH-)―→溶液不再呈中性。
(3)水解常数(K h)以CH3COO-+H2O CH3COOH+OH-为例,表达式为c CH3COOH·c OH-c CH3COO-=K h=K WK a。
(4)特点可逆水解反应是可逆反应吸热水解反应是酸碱中和反应的逆反应,ΔH>0微弱水解反应程度很微弱2.盐类的水解规律(1)类型盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH强酸强碱盐NaCl、KNO3否—中性=7强酸NH4Cl、是NH+4、Cu2+酸性<7弱碱盐Cu(NO3)2弱酸强碱盐CH3COONa、Na2CO3是CH3COO-、CO2-3碱性>7(2)规律:有弱才水解,越弱越水解;谁强显谁性,同强显中性。
提醒:弱酸弱碱盐的性质决定于酸、碱的相对强弱,水解性质仍显较强的性质,如NH4ClO 显碱性,CH3COONH4显中性。
[深度归纳] 酸式盐的性质判断方法归类(1)强酸的酸式盐只电离,不水解,溶液显酸性。
(2)弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
①若电离程度小于水解程度,溶液呈碱性。
常见的有NaHCO3、NaHS、Na2HPO4等。
②若电离程度大于水解程度,溶液显酸性。
常见的有NaHSO3、NaH2PO4等。
3.水解离子方程式的书写(1)书写形式在书写盐类水解方程式时一般要用“”号连接,产物不标“↑”或“↓”,用离子方程式表示为盐中的弱离子+水弱酸(或弱碱)+OH-(或H+)。
2012高考化学总复习精品课件:8-3盐类的水解(苏教版)

2. 离子浓度大小比较的方法 (1)三个思维基点:电离、水解和守恒。 (2)解题一般思路:看组成,定平衡,找微粒,比大小;有等式, 找守恒。 (3)注意掌握两个“微弱”:弱电解质的电离是微弱的,盐的水 解是微弱的。
绝大部分可溶盐完全电离,电离出的弱酸根离子部分水解(电离 强烈、水解微弱);其次要知道多元弱酸分步电离,故其对应盐 的水解也是分步进行的,以第一步水解为主;最后还要考虑水的 电离。
盐类水解的离子方程式可用通式表示为: R-+H2O HR+OH-,Rm-+H2O HR(m-1)-+OH-(分 步水解) R++H2O ROH+H+,Rn++nH2O R(OH)n+nH+ (“一步到位”)
2021/8/15
2.分项分析
(1)一元弱酸强碱盐和一元弱碱强酸盐 CH3COO-+H2O CH3COOH+OH- NH4++H2O NH3·H2O+H+ (2)多元弱酸强碱盐(正盐)
2021/8/15
①多元弱酸溶液,根据分步电离分析。如H3PO4溶液: c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-) ②多元弱酸的正盐溶液,根据弱酸根分步水解分析。如Na2CO3 溶液: c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) ③不同溶液中同一离子浓度大小的比较,要看溶液中其他离子对 其产生的影响。如在相同物质的量浓度的下列溶液中: ⅠNH4ClⅡNH4HSO4ⅢCH3COONH4ⅣNH3·H2O,c(NH4+)由大 到小的顺序为Ⅱ>Ⅰ>Ⅲ>Ⅳ。
CH3COO-+NH4++H2O CH3COOH+NH3·H2O 此类水解称为不完全双水解反应。
2021/8/15
(5)完全双水解 某些盐溶液在混合时,一种盐的阳离子和另一种盐的阴离子 在一起都发生水解,相互促进对方的水解,使两种离子的水解趋 于完全。这样的水解反应称为完全(彻底)双水解。此类反应的离 子方程式用“===”而不用“ ”表示,并标示“↑”“↓”。
高三化学复习课件(苏教版)8-3盐类的水解

• ③外加酸碱:外加酸碱能影响盐的水解。 例如,不同条件对FeCl3水解平衡的影响。 • Fe3++3H2O Fe(OH)3+3H+ H+ 物 移动 质 方向 的 量 增 向右 加 增
条件
pH
现象
升温
降 低 降
颜色变深
• 四、盐溶液蒸干后所得物质的判断 • 1.考虑盐是否分解。如加热蒸干 Ca(HCO3)2溶液,因其分解,所得固体是 CaCO3。 • 2.考虑氧化还原反应。如加热蒸干 Na2SO3溶液,因Na2SO3易被氧化,所得 固体是Na2SO4。 • 3.盐水解生成挥发性强酸时,蒸干后一 般得到氢氧化物。如蒸干AlCl3溶液,得 Al(OH)3。盐水解生成不挥发性酸,蒸干 后一般仍为原物质。例如蒸干Al2(SO4)3溶
3.在 0.1 mol/L Na2CO3 溶液中,存在的平衡有 CO32
-
+H2O
HCO3-+OH-,HCO3-+H2O
2-水解溶液呈碱性
H2CO3+
OH-,H2O 其原因是 CO3
H++OH-。向溶液中滴入酚酞呈 红 色, ,再将此溶液加热,溶
液颜色 加深,其原因是 盐的水解为吸热过程,升高温度 1 mol/L Na2CO3 溶液的 pH 有利于平衡向水解方向移动。
4.用离子方程式表示下列水解: (1)NH4++D2O 溶液 NH4++D2O (2)Al3++D2O 溶液 Al3++3D2O (3)Na2SO3 溶液 SO32 + H2O
-
NH3· HDO+D+。 Al(OD)3+3D+。 HSO3 +OH ,HSO3
- - -
+H2O
H2SO3+OH-。 Cu(OH)2+2H+。
• 二、盐溶液酸碱性判断 • 判断盐类是否发生水解以及水解后溶液的 酸碱性要看盐的离子对应的酸或碱的相对 强弱。 • 1.强酸和弱碱生成的盐水解,溶液显酸 性,pH<7,如NH4Cl、CuSO4、FeCl3、 Zn(NO3)2、MgCl2等,原因是弱碱阳离子 水解生成对应的弱碱,使溶液呈碱性。 • 2.强碱和弱酸生成的盐水解,溶液呈碱 性,pH>7,如CH3COONa、K2CO3、
高三化学一轮总复习 (基础再现+深思考+规律方法+解题指导)盐类的水解课件 苏教版

与 AlCl3 混合溶液的反应离子方程式: Al3++3HCO- 3 ===Al(OH)3↓+3CO2↑。
第十三页,共49页。
基础再现·深度 (shēndù)思考
深度思考
6.下列反应不属于水解反应或水解方程式不正确的是
()
①HCl+H2O
H3O++Cl-
②ZnCl2+2H2O== Zn(OH)2+2HCl
CH3COO-、
是 CO23-
碱性(jiǎnpHxì>n7ɡ)
第四页,共49页。
基础再现(zàixiàn)·深 度思考
深度思考 1.怎样证明 Na2CO3 溶液呈碱性是由 CO32-水解引起的?
答案 向纯碱溶液中滴入酚酞试液,溶液显红色;若再向该 溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色 褪去。这可以说明纯碱溶液呈碱性是由 CO23-引起的。
答案 ①Al3++3H2O
Al(OH)3+3H+
②S2-+H2O
HS-+OH-、
HS-+H2O
H2S+OH-
③HCO- 3 +H2O
H2CO3+OH-
④AlO- 2 +2H2O
Al(OH)3+OH-
⑤不水解
第十九页,共49页。
高考化学总复习专题八第三单元盐类的水解教案苏教版
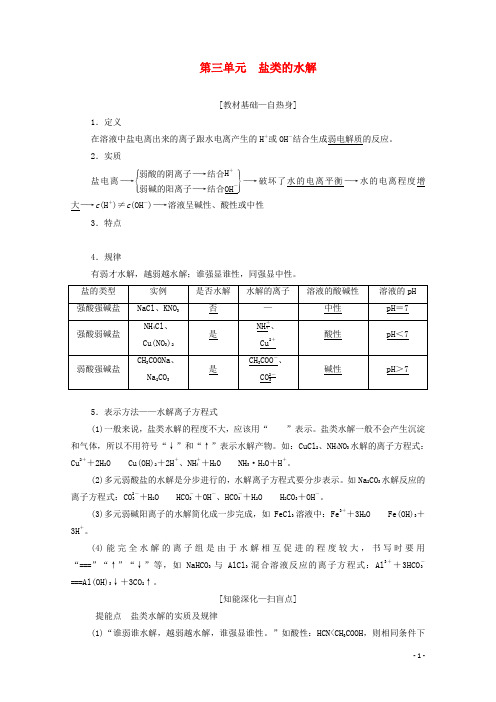
第三单元 盐类的水解[教材基础—自热身]1.定义在溶液中盐电离出来的离子跟水电离产生的H +或OH -结合生成弱电解质的反应。
2.实质盐电离―→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子―→结合H +弱碱的阳离子―→结合OH -―→破坏了水的电离平衡―→水的电离程度增大―→c (H +)≠c (OH -)―→溶液呈碱性、酸性或中性3.特点 4.规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
5.表示方法——水解离子方程式(1)一般来说,盐类水解的程度不大,应该用“”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
如:CuCl 2、NH 4NO 3水解的离子方程式:Cu 2++2H 2OCu(OH)2+2H +、NH +4+H 2ONH 3·H 2O +H +。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
如Na 2CO 3水解反应的离子方程式:CO 2-3+H 2OHCO -3+OH -、HCO -3+H 2OH 2CO 3+OH -。
(3)多元弱碱阳离子的水解简化成一步完成,如FeCl 3溶液中:Fe 3++3H 2O Fe(OH)3+3H +。
(4)能完全水解的离子组是由于水解相互促进的程度较大,书写时要用“===”“↑”“↓”等,如NaHCO 3与AlCl 3混合溶液反应的离子方程式:Al 3++3HCO -3===Al(OH)3↓+3CO 2↑。
[知能深化—扫盲点]提能点 盐类水解的实质及规律(1)“谁弱谁水解,越弱越水解,谁强显谁性。
”如酸性:HCN<CH 3COOH ,则相同条件下碱性:NaCN>CH3COONa。
(2)强酸的酸式盐只电离,不水解,溶液显酸性。
如NaHSO4在水溶液中:NaHSO4===Na++H++SO2-4。
(3)弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子电离程度和水解程度的相对大小。
①若电离程度小于水解程度,溶液显碱性。
高考化学一轮复习 专题8第3单元 盐类的水解课件 苏教版

即时应用 2.下列说法正确的是( ) A.将AlCl3溶液和Al2(SO4)3溶液分 别加热、蒸干、灼烧, 所得固体成分 相同 B.配制FeSO4溶液时, 将FeSO4固 体溶于稀盐酸中, 然后稀释至所需浓 度
C.用加热的方法可以除去KCl溶液 中的Fe3+ D.洗涤油污常用热的碳酸钠溶液 解析: 选D. A项, 氯化铝溶液蒸干、 灼烧后得到氧化铝, 而硫酸铝溶液蒸 干、灼烧后得到的仍是硫酸铝, 不正 确; B项, 所加酸应是稀硫酸, 不能引 入新杂质; C项, 加热法不能除去Fe3+
2.外因: 受温度、浓度及外加酸、
碱、盐等因素的影响. 例如, 不同条
件对FeCl3水解平衡的影响:
Fe3++3H2O
Fe(OH)3+3H+
ΔH>0
条件
升温 通HCl 气体
移动 方向 n(H+) pH 现象
__右___ 增多
产生红褐 减小
色沉淀
左
__增__多__
溶液棕黄 减小
色加深
条件 移动 方向
盐的
溶液的
是否水解
类别
酸碱性
实例及离 子方程式
强酸 强碱 __不__水__解__ __中__性____
实例及离 子方程式
强碱
弱酸 水解 碱性
盐
_____________
强酸
弱碱 _水__解___ __酸__性___
盐
思想感悟
1.同浓度的NaHCO3溶液和 CH3COONa溶液相比, 谁的pH较 大?为什么?
B.在 0.1 mol·L-1Na2CO3 溶液中: c(OH-)-c(H+)=c(HCO-3 )+ 2c(H2CO3) C.向 0.2 mol·L-1NaHCO3 溶液中加 入等体积 0.1 mol·L-1NaOH 溶液: c(CO23-)>c(HCO-3 )>c(OH-)>c(H+)
高考化学一轮复习 专题8 第三单元 盐类的水解课件 苏教版

配 制 FeSO4 溶 液时 ,为 什么 要将 FeSO4 溶解到稀硫酸中,并加入少量铁屑?
用稀硫酸溶解是为了抑制 Fe2+水解; 加入铁屑是为了防止 Fe2+被空气中的氧气氧化。
想一想 判断下列说法是否正确。 ①明矾和 FeCl3 可作净水剂。( ) ②为保存 FeCl3 溶液,要在溶液中加少量盐酸。( ) ③实验室配制 AlCl3 溶液时,应先把它溶在稀硫酸中,而 后加水稀释。( ) ④NH4Cl 与 ZnCl2 溶液可作焊接中的除锈剂。 ⑤实验室盛放 Na2CO3、Na2SiO3 等溶液的试剂瓶应用橡 皮塞,而不能用玻璃塞。( )
走向高考·化 学
路漫漫其修远兮 吾将上下而求索
必修部分
专题八
溶液中的离子反应
专题八
第三单元 盐类的水解
考纲要求 自主梳理回顾
基础自测
方要法点警深示化探探究究 课堂巩固训练 课后强化作业
考纲要求
1.了解盐类水解的原理。 2.了解影响盐类水解的主要因素。 3.了解盐类水解的应用。
自主梳理回顾
移动 方向 向右 向左 向右 向右
H+物质 pH
的量 增加
增加
增加
减少
现象
颜色变深 颜色变浅 颜色变浅
有人认为,向 CH3COONa 溶液中,加入少 量冰醋酸,会与 CH3COONa 溶液水解产生的 OH-反应,使 平衡向水解方向移动,这种说法对吗?为什么?
这种说法不对。因为 CH3COO-的水解反应 为 CH3COO-+H2O CH3COOH+OH-。加入少量冰醋酸, 冰醋酸在溶液中只有少数发生电离,主要以 CH3COOH 形式 存在,故 CH3COOH 浓度增加,抑制 CH3COO-水解。
想一想 判断下列说法是否正确。 ①AlCl3 和 NaHCO3 溶液混合产生沉淀和气体,是因为两 种盐的水解相互促进。( ) ②25℃时,pH=5 的 NH4Cl 和 pH=9 的 Na2CO3 溶液中 水的电离程度相等。( ) ③25℃时,pH=5 的 NH4Cl 溶液中水电离的 H+的浓度为 10-9 mol·L-1。( ) ④泡沫灭火器中 NaHCO3 放于铁桶中,而 Al2(SO4)3 放于 塑料桶中,是因为 Al2(SO4)3 水解显酸性,能与铁反应。( ) ⑤Fe3+与 S2-因为相互促进水解而不能大量共存。( )
高考化学一轮复习苏教版盐类的水解 课件(55张)
•
15、一年之计,莫如树谷;十年之计,莫如树木;终身之计,莫如树人。2021年9月上午8时40分21.9.608:40September 6, 2021
•
16、教学的目的是培养学生自己学习,自己研究,用自己的头脑来想,用自己的眼睛看,用自己的手来做这种精神。2021年9月6日星期一8时40分42秒08:40:426 September 2021
溶液中加入少量的 I2,则溶液中
小”或“不变”)。
答案:1×10-12 增大
[HSO3 ]
将
(填“增大”“减
核心考点分层突破
考点一
考点二
必备知识·自主预诊
[H+ ][HSO3 ]
解析:Ka= [H SO ]
2 3
-15-
关键能力·考向突破
-
Kh=
=
[OH- ][H2 SO3 ]
[HSO3 ]
W [H2 SO3 ]
2-
液中:NaHSO4
Na++H++SO4 。
3.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程
度和水解程度的相对大小。
(1)若电离程度小于水解程度,溶液呈碱性。如 NaHCO3 溶液
-
2-
-
中:HCO3
H++CO3 (次要),HCO3 +H2O
H2CO3+OH-(主要)。
(2)若电离程度大于水解程度,溶液显酸性。如 NaHSO3 溶液
2-
CO3 、NH4+和 HCO3 在溶液中仍可大量共存。
-
核心考点分层突破
考点一
考点二
-11-
必备知识·自主预诊
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
▪ A.HCO3-+H2O ▪ B.S2-+2H2O ▪ C.Fe3++3H2O ▪ D.CO32-+H2O
CO32-+H3O+ H2S+2OH- Fe(OH)3↓+3H+
HCO3-+OH-
立体设计·走进新课堂
▪ 【解析】 A为电离方程式;B应为S2-+ H2O HS-+OH-;C项,水解不能生 成沉淀。
立体设计·走进新课堂
▪ (3)增大c(H+)可促进 弱酸根离子
水
解弱碱,阳抑离制子
水解;
▪ 增大c(OH-)可促进弱碱阳离子
水
弱解酸,根离抑子制
水解。
▪ (4)加入与水解有关的其他物质,符合化学 平衡移动原理。
立体设计·走进新课堂
▪ [想一想2]向CH3COONa溶液滴加酚酞试液, 会产生什么现象?将该溶液加热,可能产 生什么现象?原因是什么?
▪ (1)弱碱越弱,其阳离子的水解大程度就越
强,溶液酸性越
。
▪ (2)弱酸越弱,其阴离子的水解大程度就越
,强 溶液碱性越
。
立体设计·走进新课堂
▪ 2.外因
▪ (1)升高温度,水解平衡向正
动,增水大 解程度
。
方向移
▪
方向移
▪ 加水稀释,水解平衡正向 方 向 移 动 , 水 解 增程大 度 。
▪ 4.发生相互促进的水解且有沉淀生成时, 由于反应彻底,故生成物中出现的沉淀或 气体物质,均要标上“↓”或“↑”符号, 中 间 用 “ ===” 连 接 , 如 AlCl3 溶 液 与 NaHCO3 溶 液 混 合 : Al3 + + 3HCO3 - ===Al(OH)3↓+3CO2↑。
▪ 步骤:(1)先写出水解的离子及水解后的最 终 产 物 , 用 “ ===” 连 接 并 注 明 “ ↓ ” 或 “↑”。
立体设计·走进新课堂
了解盐类水解的原理、影响盐 课程标 类水解程度的主要因素、盐
准 类水解的应用(弱酸弱碱盐的 水解不作要求)。
1.盐溶液蒸干灼烧后产物的判 断。
考点提 2.盐溶液pH大小的比较。 示 3.微粒浓度的大小比较。 4.盐类水解的原理在生产、生
立体设计·走进新课活堂中的应用。
▪ 一、盐类水解的概念及实质
等,如在0.1 mol·L-1的NH4Cl和0.1 mol·L -1的氨水混合溶液中,各离子浓度的大小 顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+)。 在该溶液中,NH3·H2O的电离与NH4+的水 解互相抑制,NH3·H2O的电离大于NH4+的 水解作用,溶液呈现碱性,c(OH-)>c(H+), 同时c(NH4+)>c(Cl-)。
立体设计·走进新课堂
▪ 【解析】 CH3COO-水解使溶液呈碱性, NH4 + 、 Fe3 + 水 解 使 溶 液 呈 酸 性 , 促 进 CH3COO-水解,故溶液中CH3COO-的浓 度减小;SO32-水解使溶液呈碱性,抑制 CH3COO-水解,故溶液中CH3COO-的浓 度增大。
▪ 【答案】 A
水解,所以使用“ ”,不标“↓”、
“↑”,如CH3COONH4水解:
▪ CH3COO-+NH4++H2O NH3·H2O
CH3COOH+
▪ (2)Fe3+和S2-相遇不发生水解反应而是发
生氧化还原反应:2Fe3++S2-===2Fe2++
S↓,Cu2+和S2-相遇不发生水解反应,而
立体设是计发·走生进沉新淀课反堂应:Cu2++S2-===CuS↓。
立体设平计衡·走右进移新,课使堂水解得到促进,这只是抓住
▪ 【 即 时 巩 固 1】 向 三 份 0.1 mol·L - 1CH3COONa溶液中分别加入少量NH4NO3、 Na2SO3、FeCl3固体(忽略溶液体积变化), 则CH3COO-浓度的变化依次为( )
▪ A.减小、增大、减小 ▪ B.增大、减小、减小 ▪ C.减小、增大、增大 ▪ D.增大、减小、增大
立体设计·走进新课堂
▪ 3.不同溶液中同一离子浓度的比较 ▪ 要看溶液中其他离子对该离子的影响,如
在 相 同 物 质 的 量 浓 度 的 ① NH4Cl , ② CH3COONH4,③NH4HSO4溶液中,c(NH4 +)由大到小的顺序是③>①>②。
立体设计·走进新课堂
▪ 4.混合溶液中各离子浓度的比较 ▪ 要进行综合分析,如电离因素、水解因素
▪ 提 示 : NaHCO3 溶 液 的 pH 大 。 因 为 CH3COOH的酸性强于H2CO3而H2CO3的酸 性强于HCO3-,则HCO3-结合H+的能力 强于CH3COO-,即HCO3-水解程度较大, 产生c(OH-)较大,pH较大。
立体设计·走进新课堂
▪ 二、盐类水解的影响因素
▪ 1.内因——盐本身的性质
▪ 【答案】 C
立体设计·走进新课堂
▪ 【规律技巧】 一些弱酸酸式盐、酸根离
子的电离方程式,往往写成酸根离子和水
反应,生成水合氢离子的形式,如:HSO3
-+H2O
H3O++SO32-,与HSO3-水
解的离子方程式HSO3-+H2O H2SO3
+OH-极为相似,一定要辨别清楚。
立体设计·走进新课堂
▪ 【即时巩固2】 下列水解反应的离子方 程式正确的是( )
立体设计·走进新课堂
【解析】 水解平衡常数与 KW 一样,仅与温度有关, 故稀释溶液时水解平衡常数是不变的,A 项错;CO2 通入 溶液中,相当于生成 H2CO3,可以与 OH-反应,而促使 平衡正向移动,B 项正确;升温,促进水解,平衡正向移 动,故ccHCCOO323--增大,C 项错;D 项,加入 NaOH,碱性 肯定增强,溶液 pH 增大 ,故 D 项错。
▪ 【答案】 D
立体设计·走进新课堂
▪ 1.多元弱酸溶液 ▪ 根据多步电离分析,如在H3PO4的溶液中
c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)。 ▪ 2.多元弱酸的正盐溶液 ▪ 根据弱酸根的分步水解分析,如Na2CO3溶
液中c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)。
立体设计·走进新课堂
▪ ①若电离程度大于
水解程度,溶液
呈酸性,如NaHSO3、NaH2PO4等。
▪ ②若电离程度小于
水解程度,溶液
呈碱性,如NaHCO3、Na2HPO4等。
立体设计·走进新课堂
▪ (5)水解相互促进的特例:Al3+与HCO3-、 CO32-、ClO-、S2-、HS-、AlO2-等发生 水解相互促进反应。Fe3+与CO32-、HCO3 -、AlO2-等发生水解相互促进反应。NH4 +与SiO32-等发生水解相互促进反应。
立体设计·走进新课堂
▪ (3)弱酸弱碱盐水解程度较大(水解相互促
进反应)
酸
▪ ①酸强于碱显碱
性,如
(CH3COO)2Cu等。
▪ ②碱强于酸显
性 , 如 (NH4水)2解S 等 。
▪电③离 酸 碱 相 当 显 中 性 , 如 ③ CH3COONH4 等 。
▪ (4)弱酸酸式盐水解,取决于酸根离子的
和 的相对大小。
立体设计·走进新课堂
▪ (2)根据电荷守恒将其配平,看反应物中是 否加水。
▪ 此类离子组有:Al3+与CO32-、HCO3-、 S2 - 、 HS - 、 AlO2 - , Fe3 + 与 CO32 - 、 HCO3-、AlO2-等。
立体设计·走进新课堂
▪ 灵犀一点:
▪ (1)NH4+与CH3COO-、CO32-、HCO3-等 组成的盐虽然水解相互促进,但不能彻底
▪ 1.概念
▪ 在水溶液中,盐的离子结合水电离出的H+
或弱电O解H质-生成
的反应。
▪ 2.实质
▪ 离子结合H+或OH-→c(H+)或c减(O小H-) →
水的右电移 离平衡
→c(H+酸)性≠c(O碱H性-)→
溶液呈
或。
立体设计·走进新课堂
▪ 3.特点
▪ (1)一般来说,水解反应不是彻底
的。水
可解逆反应是 反应,存在水解平衡。
▪ 提示:向CH3COONa溶液滴加酚酞试液, 溶液会显红色,因为CH3COONa电离出来 的CH3COO-与水电离出来的H+结合生成 CH3COOH,溶液中c(H+)<c(OH-),使溶 液显碱性;将该溶液加热,因为水解反应 为吸热反应,温度升高水解程度增大, c(OH-)变大,可能使溶液的红色加深。
立体设计·走进新课堂
▪ [想一想3](1)为什么热的纯碱液去油渍效果 会更好?
▪ (2)配制FeCl3溶液时,常加入少量的盐酸, 为什么?
▪ 提示:(1)纯碱溶液中存在CO32-的水解平 衡:CO32-+H2O HCO3-+OH-,温 度升高,水解平衡右移c(OH-)增大,去污 能力增强。
▪ (2)FeCl3溶液中存在Fe3+的水解平衡:Fe3
▪ CO32-+H2O HCO3-+OH-(主要) ▪ HCO3-+H2O H2CO3+OH-(次要) ▪ 3.多元弱碱的阳离子水解的过程比较复
杂,中学阶段写相应的离子方程式时一步 写到底即可。如Al2(SO4)3水解的离子方程 式为:Al3++3H2O Al(OH)3+3H+。
立体设计·走进新课堂
立体设计·走进新课堂
▪ 2.影响盐类水解的外界因素主要有温度、 浓度及外加酸碱等因素
▪ (1)温度:盐的水解是吸热反应,因此升高 温度水解程度增大。
▪ (2)浓度:盐浓度越小,水解程度越大;盐 浓度越大,水解程度越小。
▪ (3)外加酸碱能促进或抑制盐的水解。例如 水解呈酸性的盐溶液加入碱,就会中和溶 液中的H+,使平衡向水解方向移动而促 进水解,若加酸则抑制水解。
立体设计·走进新课堂
▪ 3.盐类水解的类型
