第二节分子的立体结构
第二节 分子的立体结构

BeCl2的成键情况
2p 2p
2p
sp杂化
Be:
2s
激发 2s
sp
Cl
Be
Cl
Cl
我们知道乙炔的结构式为
Be
Cl
乙炔的结构式:
H
C
C
H
每个碳原子的另一个 sp轨道则各与一个氢原子的 1s轨道重叠形成一个 sp-s б 键 p轨道则与另一个碳原子的两个未 杂化的 p以肩并肩的形式重叠形成两个 πsp-sp 键。б 键,每个碳原子相互垂直未杂化的 两个碳原子的 也与两个 sp杂化轨道垂直的 sp杂化轨道重叠形成一个 p轨道。 乙炔分子中每个碳原子都与 CO2 分子中碳原子一样采取 sp杂化形成两个在一条直线上的 sp杂化轨道,并留下两个相互
价层 电子对数 VSEPR 模型 VSEPR 直线形 模型名称 中心原子杂 化轨道类型 典型例子
2
sp
CO2
原子轨道以哪种方式杂化能得到两个在一条直线上的杂化轨道呢? 形成的分子,两个原子形成的分子一定是直线形的。所以价层电子对为 2时,不可能有孤电子对,只能是两个 б 键 原子轨道以哪种方式杂化能得到四个指向四面体四个形顶点的杂化轨道呢? 很好。价层电子对为 价层电子对数为 2时,可不可能含有孤电子对呢?为什么? 2时,一定不会有孤电子对,若有一对孤电子对,另外就只有一个 б 键,也就只能有两个原子 原子轨道以哪种方式杂化能得到三个伸向平面三角形顶点的杂化轨道呢?
第二节 分子的立体构型
二、确实分子立体构型的理论 2、杂化轨道理论 VSEPR模型与中心原子的杂化轨道类型
价层 电子对 VSEPR 模型 VSEPR 直线形 模型名称 中心原子杂 化轨道类型 典型例子
2
3
人教版化学选修三2.2《分子的立体构型(第2课时)分子的空间结构和价层电子对互斥理论》教学设计

第二章第二节分子的立体构造第 2 课时分子的空间构造与价层电子对互斥理论【学习目标】 1、能应用价层电子对互斥理论判断分子的空间构型。
【学习要点】σ键电子对、孤电子对和价层电子对的计算,VSEPR 模型【学习难点】分子立体构型的推测课前预习案一、价层电子对互斥理论(阅读课本 P37-38 达成填空)1、价层电子对互斥理论以为,分子的“立体构型”是的结果。
2、价层电子对是指;价层电子对 =+;( 1)σ键电子对数:可由确立。
比如,H2O的中心原子是______,构造式是 __________,有个σ键,故σ键电子对数是______;(2)中心原子上的孤对电子对数:依据公式 _______________________确立,此中 a 为,关于主族元向来说,价电子数等于;x 为;b 为;氢为 _____,其余原子等于。
阳离子: a 为中心原子的价电子数减去 _______________;阴离子:a为中心原子的价电子数加上(绝对值)。
2-的孤对电子数 =1/2(6+2-2*3 )=13比如: SO【预习检测】1、运用你对分子的已有的认识,达成以下表格,写出C、 H、N、O 的电子式,依据共价键的饱和性议论C、H、N、 O、F 的成键状况。
原子H C N O F 电子式可形成的共用电子对数讲堂研究案研究一:价层电子对空间构型(即VSEPR 模型)价层电子对互斥理论的基本内容:对AB n型的分子或离子,中心原子A 价层电子对(包含成键σ键电子对和未成键的孤对电子对)之间因为存在排挤力,将使分子的几何构型老是采纳电子对互相排挤最小的那种构型,以使相互之间斥力最小,分子系统能量最低、最稳固。
问题 1:请你依据价层电子对互斥理论的基本内容,总结出价层电子对的空间构型(即 VSEPR 模型)(利用牙签与橡皮泥模拟)空间构型价电子对数量234VSEPR 模型形形形问题 2:依据价层电子对互斥理论,计算出以下分子的中心原子含有的σ键电子对数、孤对电子数及价层电子数。
分子的立体构型(VSEPR)

第二节 分子的立体结构
共价键
复习回顾
σ键 成键方式 “头碰头”,呈轴对称
π键 成键方式 “肩并肩”,呈镜像对称
键参数
键能
衡量化学键稳定性
键长 键角 描述分子的立体结构的重要因素
一、形形色色的分子
思考:在O2、HCl这样 的双原子分子中存在
分子的立体结构问题
吗?何谓“分子的立
三原子分子
分子 的立 四原子分子 体结
构
直线 形,如CO2 V 形,如H20
平面三角 形,如HCHO、BF3
三角锥 形,如NH3
五原子分子——— 最常见的是正四面体形,如CH4
同为三原子分子,CO2 和 H2O 分子的空间结 构却不同,什么原因?
直线形 V形
同为四原子分子,CH2O与 NH3 分子的的空 间结构也不同,什么原因?
体结构”?
O2
HCl
H2O
CO2
所谓“分子的立体结 构”指多原子构成的 共价分子中的原子的 空间关系问题。
C2H2
CH2O
COCl2
NH3
P4
CH4
CH3CH2OH CH3COOH
C6H6
C8H8
CH3OH
C60
C20
C40
C70
分子的立体结构是怎样测定的?
测分子体结构:红外光谱仪→吸收峰→分析。
型
分子的立体结 构模型
分子 的空
间构 型
CO2
20
2
直线形
直线形
SO2
21
3
SO3
30
3
PCl3
31
4
H2S
22
4
化学选修3第二章第二节分子的立体构型
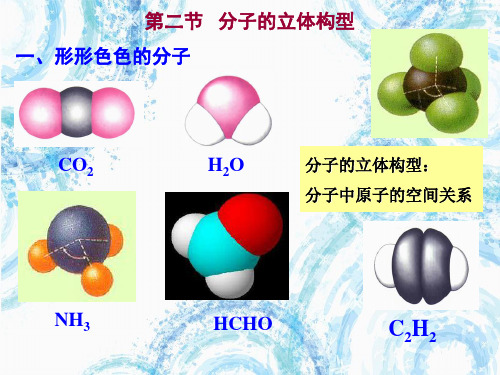
3个sp2杂化轨 4个sp3杂化轨 道 道
1200 1090 28’
1800
空 间 构 型
实 例
直 线形
平面三角形
四面体形 CH4 , H2O
BeCl2 CO2 C2H2 BF3 , C2H4
杂化轨道只用于形成σ键或者用来容纳孤对电子,剩 余的p轨道可以形成π键
1、氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是 因为( C ) A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化, 而CH4是sp3杂化 B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形 成4个杂化轨道 C.NH3分子中有未成键的孤电子对,它对成键电子的排斥 作用较强 D.氨气分子中氮原子电负性强于甲烷分子中的碳原子 2、用价层电子对互斥理论预测H2S和BF3的立体结构,两个 结论都正确的是( D )
sp2杂化轨道的形成过程
120° z z z z
y x x
y x
y x
y
sp2杂化轨道由1个s轨道和2个p轨道杂化而得到三个sp2杂化轨道。 三个杂化轨道在空间分布是在同一平面上,互成120º 例如:C2H4
C2H4(sp2杂化)
sp杂化轨道的形成过程
z
z
180°
z
z
y x x
y x
y x
y
sp杂化轨道由1个s轨道和1个p轨道杂化而得到两个sp杂化轨道。 两个杂化轨道在空间分布呈直线型,互成180º 例如:C2H2
4、下列分子或离子中,不含有孤对电子的是( D ) A、H2O B、H3O+ C、NH3 D、NH4+
5、以下分子或离子的结构为正四面体,且键角为 109°28′ 的是( B ) ①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42A、①②③ B、①②④ C、①②⑤ D、①④⑤
2021-2022学年人教版高中化学选修三教学案:第二章 第二节 分子的立体构型 Word版含答案
其次节⎪⎪分子的立体构型 第一课时价层电子对互斥理论————————————————————————————————————— [课标要求]1.生疏共价分子结构的多样性和简单性。
2.能依据价层电子对互斥理论推断简洁分子或离子的构型。
1.常见分子的立体构型:CO 2呈直线形,H 2O 呈V 形,HCHO 呈平面三角形,NH 3呈三角锥形,CH 4呈正四周体形。
2.价层电子对是指中心原子上的电子对,包括σ键电子对和中心原子上的孤电子对。
中心原子形成几个σ键就有几对σ键电子对,而中心原子上的孤电子对数可由下式计算:12(a -xb ),其中a表示中心原子的价电子数,x 表示与中心原子结合的原子数,b 表示与中心原子结合的原子最多能接受的电子数。
3.价层电子对为2时,VSEPR 模型为直线形;价层电子对为3时,呈平面三角形;价层电子对为4时,呈四周体形,由此可推想分子的立体构型。
形形色色的分子1.三原子分子的立体构型有直线形和V 形两种化学式 电子式结构式 键角 立体构型立体构型名称CO 2O===C===O180°直线形H 2O105°V 形2.四原子分子大多数实行平面三角形和三角锥形两种立体构型化学式电子式结构式键角立体构型立体构型名称CH 2O约120°平面三角形NH 3107°三角锥形3.五原子分子的可能立体构型更多,最常见的是正四周体化学式电子式结构式键角立体构型立体构型名称CH 4109°28′正四周体形CCl 4109°28′正四周体形1.下列分子的立体结构模型正确的是( )ABCD解析:选D CO 2分子是直线形,A 项错误;H 2O 分子为V 形,B 项错误;NH 3分子为三角锥形,C 项错误;CH 4分子是正四周体结构,D 项正确。
2.硫化氢(H 2S)分子中,两个H —S 键的夹角都接近90°,说明H 2S 分子的立体构型为________________;二氧化碳(CO 2)分子中,两个C===O 键的夹角是180°,说明CO 2分子的立体构型为______________;甲烷(CH 4)分子中,任意两个C —H 键的夹角都是109°28′,说明CH 4分子的立体构型为__________________。
学案第二章第二节分子立体结构

第二节分子的立体结构(学案)【学习目标】1、熟悉共价分子的多样性和复杂性;2、初步熟悉价层电子对互斥模型;3、能用VSEPR模型预测简单分子或离子的立体结构;理解价层电子对互斥模型和分子空间构型间的关系。
4、熟悉杂化轨道理论的要点5、进一步了解有机化合物中碳的成键特征6、能按照杂化轨道理论判断简单分子或离子的构型7、进一步增强分析、归纳、综合的能力和空间想象能力【重点知识】:分子的立体结构;利用价层电子对互斥模型、杂化轨道理论模型预测分子的立体结构。
【回顾思考】1 举例说明什么叫化学式?2 举例说明什么叫结构式?3 举例说明什么是结构简式?4 举例说明什么是电子式?5 举例说明什么价电子?(第一课时)一、形形色色的分子【阅读讲义】认真阅读讲义35到37页“二、价层电子对互斥理论”处。
在阅读进程中勾出你以为重要的句子、词语、规律等,如发现新问题请写在讲义中相应地方。
认真读图2-8、2-9、2-10、2-11、2-12和36页的知识卡片等去熟悉分子的多样性,自己动手制作几种分子的模型体验分子的空间构型。
然后思考下列问题。
【阅读思考1】完成下表1、原子数相同的分子,它们的空间结构相同吗?2、请你利用身旁的易患材料参照讲义35、36页内容制作CO2、H2O、NH3、CH2O、CH4分子的球辊模型(或比例模型);并用书面用语描述它们的分子构型。
3、你如何理解分子的空间结构?4、写出CO2、H2O、NH3、CH2O、CH4的电子式;5、观察上述分子的电子式,分析H、C、N、O原子别离可以形成几个共价键,你知道原因吗?6、如何计算分子中中心原子的价层电子对?(成σ键电子对、未成键电子对)二、价层电子对互斥理论【阅读讲义】认真阅读讲义37到39页“三、杂化轨道理论简介”处。
在阅读进程中勾出你以为重要的句子、词语、规律等,如发现新问题请写在讲义中相应地方。
认真读图2-15、表2-4、2-5,对比价层电子对互斥模型和分子构型。
人教版化学选3第二章 第二节 分子的立体结构

对ABn型分子,B围绕A成键,则A为中心原子,n 值为中心原子结合的原子数。
-
平面 正 三角形 四面体
3)填写孤对电子与分子的空间构型关系,中心原子 结合的原子数(n值)与分子的空间构型关系。
中心无孤对电子
代表物
中心原子含孤对电 子对数
0 0 0 2 1
:O::C::O:
H .. .. H C O .. H H : C :H H .. . . ..
V
分子
表 的立 格 一 四原子分子
平面三角 形,如HCHO、BF3
体结
三角锥
形,如NH3
构
五原子分子——— 最常见的是正四面体 形,如CH
4
★☆★通过填表,你能发现什么问题?
探究:同为三原子分子,CO2 和 H2O 分子的空间
结构却不同,同为四原子分子,CH2O与 NH3 分子 的空间结构也不同,什么原因?
: : : : : :
H 2O
NH3
中心存在孤对电子 3 107°
2
105°
V形
三角锥形
二、价层电子对互斥模型
(VSEPR模型)
1、内容:中心原子价电子层电子对(包括__ 成键( σ键) _ 电子对和 未成键 的孤对电子对) 的互相 排斥 作用,使分子的几何构型总是采 取电子对相互 排斥最小 的那种构型,即分子 尽可能采取对称的空间构型。
无孤对电子 CH2O CH4 H2O NH3
AB3 平面三角形 AB4 AB2 AB3 正四面体 V形 三角锥形
有孤对电子
应用反馈:
化学式 HCN 中心原子 孤对电子数 中心原子结 合的原子数 空间构型 直线形
三角锥形
SO32NH2- BF3 H3O+ SiCl4 CHCl3 NH4+
高中化学选修三第二章第二节《分子的立体结构》

VP模型
分子构型
SO3 6 3 2
0 3 3 平面三角形 平面三角形
CH4 4 4 1
0
4 4 正四面体 正四面体
SO32- 8 3 2
1
H2O 6 2 1 2
3 4 正四面体 三角锥形 2 4 正四面体 V形
NH3 5 3 1 1
3 4 正四面体 三角锥形
价电子对的空间构型即VSEPR模型
ABn分子或离子的立体构型
分子或 a
离子
x
b 孤对电 σ键 VP 子对
VP模型
分子构型
SO3 6 3 2
0 3 3 平面三角形
CH4 4 4 1
0
4 4 正四面体
SO32- 8 3 2
1
H2O 6 2 1 2
3 4 四面体 2 4 四面体
NH3 5 3 1 1
3 4 四面体
价电子对的空间构型即VSEPR模型
价层电子
对数 目
VP模型
分子构型
SO3 6 3 2
0 3 3 平面三角形 平面三角形
CH4 4 4 1
0
4 4 正四面体 正四面体
SO32- 8 3 2
1
H2O 6 2 1 2
3 4 正四面体 三角锥形 2 4 正四面体
NH3 5 3 1 1
3 4 正四面体
正 四 面 体
V形
分子或 a
离子
x
b 孤对电 σ键 VP 子对
价层电子 对数 目 (VP)
价层电 子对空 间构
型
2
3
4
5
6
直线形
平面 正四面体
正八面体
三角形
三角双锥
正 八 面 体
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节分子的立体结构(2) 价电子对数运算方法(3)确定价层电子对的空间构型(4) 分子空间构型确定教学过程教学步骤、内容教学方法、手段、师生活动[复习]共价键的三个参数。
[过渡]我们明白许多分子都具有一定的空间结构,如:……,是什么缘故导致了分子的空间结构不同,与共价键的三个参数有什么关系?我们开始研究分子的立体结构。
[板书]第二节分子的立体结构一、形形色色的分子[讲]大多数分子是由两个以上原子构成的,因此就有了分子中的原子的空间关系咨询题,这确实是所谓〝分子的立体结构〞。
例如,三原子分子的立体结构有直线形和V形两种。
如C02分子呈直线形,而H20分子呈V形,两个H—O键的键角为105°。
[投影][板书]1、三原子分子立体结构:有直线形C02、CS2等,V形如H2O、S02等。
[讲]大多数四原子分子采取平面三角形和三角锥形两种立体结构。
例如,甲醛(CH20)分子呈平面三角形,键角约120°;氨分子呈三角锥形,键角107°。
[投影][板书]2、四原子分子立体结构:平面三角形:如甲醛(CH20)分子等,三角锥形:如氨分子等。
[讲]五原子分子的可能立体结构更多,最常见的是正四面体形,如甲烷分子的立体结构是正四面体形,键角为109°28。
[投影]等。
[板书]3、五原子分子立体结构:正四面体形如甲烷、P4 [讲]分子世界是如此形形色色,异彩纷呈,美不胜收,常使人流连忘返. 分子的立体结构与其稳固性有关。
例如,S8分子像顶皇冠,假如把其中一个向上的硫原子倒转向下,尽管也能够存在,却不如皇冠式稳固;又如,椅式C6H12比船式稳固。
[投影][设咨询]分子的空间结构我们看不见,那么科学家是如何样测定的呢?[投影][阅读]科学视野—分子的立体结构是如何样测定的?肉眼不能看到分子,那么,科学家是如何样明白分子的形状的呢?早年的科学家要紧靠对物质的宏观性质进行系统总结得出规律后进行估量,现在,科学家差不多制造了许许多多测定分子结构的现代仪器,[板书](2)、中心原子上有孤对电子:孤对电子也要占据中心原子周围的空间,并参与互相排斥,使分子的空间结构发生变化。
[摸索与交流]用VSEPR模型推测以下分子或离子的立体结构。
[汇报]直线型价电子都用于成键,同CO2;空间正四面体;三角锥型;V型;空间正三角型。
[讲]利用价层电子对互斥理论时,第一要依照原子的最外层电子数,判定中心原子上有没有孤对电子,然后再依照中心原子结合的原子的数目,就能够判定分子的空间构型[板书]4、价层电子对互斥理论的应用[讲]推断分子或离子的空间构型的具体步骤[板书](1)确定中心原子A价层电子对数目[讲]中心原子A的价电子数与配体X提供共用的电子数之和的一半,即中心原子A价层电子对数目。
运算时应注意:[投影小结](1)氧族元素原子作为配位原子时,可认为不提供电子,但作为中心原子时可认为它所提供所有的6个价电子(2) 假如讨论的是离子,那么应加上或减去与离子电荷相应的电子数。
如PO43-中P原子价层电子数就加上3,而NH4+中N原子的价层电子数应减去1(3) 假如价层电子数显现奇数电子,可把那个单电子当作电子对来看待[板书](2) 价电子对数运算方法[讲]关于ABm型分子(A为中心原子,B为配位原子),分子的价电子2教案长春市第二实验中学李佳惠〔lijiahui82@〕键理论,甲烷的4个C--H单键都应该是π键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的ls原子轨道重叠,不可能得到四面体构型的甲烷分子。
什么缘故?[讲]碳原子具有四个完全相同的轨道与四个氢原子的电子云重叠成键。
[引入]碳原子的价电子构型2s22p2,是由一个2s轨道和三个2p轨道组成的,什么缘故有这四个相同的轨道呢?为了讲明那个构型Pauling提出了杂化轨道理论。
[板书]三、杂化轨道理论简介1、杂化的概念:在形成多原子分子的过程中,中心原子的假设干能量相近的原子轨道重新组合,形成一组新的轨道,那个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。
[讲]杂化轨道理论是一种价键理论,是鲍林为了讲明分子的立体结构提出的。
为了解决甲烷分子四面体构型,鲍林提出了杂化轨道理论,它的要点是:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个相同的轨道,夹角109°28′,称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。
当碳原子跟4个氢原子结合时,碳原子以4个sp3杂化轨道分不与4个氢原子的ls轨道重叠,形成4个C--Hσ键,因此呈正四面体的分子构型。
[投影][讲]杂化轨道理论认为:在形成分子时,通常存在激发、杂化、轨道重叠等过程。
但应注意,原子轨道的杂化,只有在形成分子的过程中才会发生,而孤立的原子是不可能发生杂化的。
同时只有能量相近的原子轨道才能发生杂化,而1s轨道与2p轨道由于能量相差较大,它是不能发生杂化的。
[讲]我们需要格外注意的是,杂化轨道只用于形成σ键或者用来容纳孤对电子剩余的p轨道能够形成π键[投影] sp3杂化轨道[板书]2、杂化轨道的类型:(1) sp3杂化:1个s轨道和3个p轨道会发生混杂,得到4个相同的轨道,夹角109°28′,称为sp3杂化轨道。
[讲]价层电子对互斥模型时我们明白,H20和NH3的VSEPR模型跟甲烷分子一样,也是四面体形的,因此它们的中心原子也是采取sp3杂化的。
所不同的是,水分子的氧原子的sp3杂化轨道有2个是由孤对电子占据的,而氨分子的氮原子的sp3杂化轨道有1个由孤对电子占据。
[板书]空间结构:空间正四面体或V型、三角锥型。
[讲]凡属于VESPR模型的AY4的分子中心原子A都采取sp3 杂化类型。
例如CH4、NH3、H2O等。
其中像CH4这类与中心原子键合的是同一种原子,因此分子呈高度对称的正四面体构型,其中的4个sp3杂化轨道自然没有差不,这种杂化类型叫做等性杂化。
而像NH3、H2O这类物质的中心原子的4个sp3杂化轨道用于构建不同的σ键或孤对电子,那个的4个杂化轨道明显有差不,叫做不等性杂化,[讲]除sp3杂化轨道外,还有sp杂化轨道和sp2杂化轨道。
sp2杂化轨道由1个s轨道和2个p轨道杂化而得。
[板书] (2) sp2杂化:同一个原子的一个 ns轨道与两个np 轨道进行杂化组合为sp2 杂化轨道。
[投影]2s2pB的基态2p2s激发态正三角形sp2 杂化态BF3分子形成BFFF激发120°[板书] sp2杂化轨道间的夹角是120°,分子的几何构型为平面正三角形。
[投影][讲]应当注意的是,杂化过程中还有未参与杂化的p轨道,可用于形成π键,而杂化轨道只用于形成σ键或者用来容纳未参与成键的孤对电子。
而没有填充电子的空轨道一样都不参与杂化。
[讲]乙烯分子中的碳原子的原子轨道采纳sp2杂化。
其中两个碳原子间各用一个sp2杂化轨道形成σ键,用两个sp2杂化轨道与氢原子形成σ键,两个碳原子各用一个未参加杂化的2p原子轨道形成Π键。
[投影][讲]苯环分子中的碳原子的原子轨道采纳了sp2杂化。
每个碳原子上的sp2杂化轨道分不与两个相邻的碳原子和一个氢原子形成三个σ键并形成六碳环,每个碳原子上的未杂化2p轨道采纳〝肩并肩〞的方式重叠形成大Π键。
大Π键的形成使苯环上的所用原子处于同一平面,且结构稳固。
C 6H 6的大π键(离域键)[讲]sp 杂化轨道由1个s 轨道和1个p 轨道杂化而得[板书] (3) sp 杂化:同一原子中 ns-np 杂化成新轨道:一个s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。
[投影]BeCl 2分子形成激发2s2pBe 基态2s2p激发态杂化直线形sp 杂化态键合直线形化合态Cl Be Cl180[板书]sp 杂化:夹角为180°的直线形杂化轨道,[投影][讲]杂化轨道成键时,要满足化学键间最小排斥原理,键与键间的排斥力大小决定于键的方向,即决定于杂化轨道间的夹角。
由于键角越大化学键之间的排斥能越小,对sp杂化来讲,当键角为180时,其排拆力最小,因此sp杂化轨道成键时分子呈直线形;对sp2杂化来讲,当键角为120时,其排斥力最小,因此sp2杂化轨道成键时,分子呈平面三角形。
由于杂化轨道类型不同,杂化轨道夹角也不相同,其成键时键角也不相同,故杂化轨道的类型与分子的空间构型有关。
[讲]为了清晰的表示出成键电子和孤对电子,更有利的讲明物质空间构型的关系,我们引入了路易斯式。
路易斯结构式是用短线表示键合电子,小黑点表示未键合的价电子的结构式。
[投影][科学探究]1、写出HCN分子和CH20分子的路易斯结构式。
2.用VSEPR模型对HCN分子和CH2O分子的立体结构进行推测(用立体结构模型表示)3.写出HCN分子和CH20分子的中心原子的杂化类型。
4.分析HCN分子和CH2O分子中的π键。
[汇报]1、2、直线型平面三角型3、sp杂化 sp2杂化4、HCN分子中有2个σ键和2个Π键,即C-H和C-N之间各有一个σ键,另外C-N之间有两个Π键。
甲醛分子中C-H之间有2个σ键,C-O之间有1个σ键和1个Π键[板书]3、AB m杂化类型的判定公式:电子对数n=2荷数电配位原子的成键电子数中心原子的价电子数++教案长春市第二实验中学李佳惠〔lijiahui82@〕配位数:直截了当同中心原子配位的原子的数目叫中心原子的配位数。
配离子的电荷数:配离子的电荷数等于中心离子和配位体的总电荷数的代数和。
[投影][讲]如:[Co(NH3)5Cl]Cl2这种配合物,其配位体有两种:NH3、Cl-,配位数为5+1=6。
[讲]配合物的命名,关键在于配合物内界〔即配离子〕的命名。
命名顺序:自右向左:配位体数〔即配位体右下角的数字〕——配位体名称——〝合〞字或〝络〞字——中心离子的名称——中心离子的化合价。
例如[Zn(NH3)2]SO4读作硫酸二氨合锌[实验2-2]向盛有硫酸铜水溶液的试管里加入氨水,第一形成难溶物,连续添加氨水,难溶物溶解,得到深蓝色的透亮溶液;假设加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
[投影][咨询题]有谁上黑版写出有关的化学方程式?[板书]3、配合物的形成:Cu2++2NH3·H2O=Cu〔OH〕2↓+2NH4+Cu〔OH〕2+4 NH3·H2O=[Cu〔NH3〕4]2++2OH-+4H2O [Cu〔NH3〕4]2+深蓝色[讲]在[Cu〔NH3〕4]2+里,NH3分子的氮原子给出孤对电子对,Cu2+同意电子对,以配位键形成了[Cu〔NH3〕4]2+[投影][板书]4、配合物的性质〔1〕配合物溶于水后难电离[讲]配合物溶于水易电离为内界配离子和外界离子,而内界的配体离子和分子通常不能电离。
