国际相对原子质量表
2015年国际相对原子质量计

2015年国际相对原子质量计1.介绍2015年国际相对原子质量计,是国际纯粹与应用化学联合会(IUPAC)于2015年推出的相对原子质量的新计算方法。
该计算方法旨在提供更精确的相对原子质量数据,以便在科学研究和工程应用中得到更准确的结果。
2.历史背景相对原子质量是化学元素中各种同位素相对丰度的加权平均值。
早在19世纪末,化学家们就开始研究元素的相对原子质量,并制定了一些初步的计算方法。
20世纪初,随着科学技术的发展,对相对原子质量的测定方法也得到了不断改进。
直到2015年,IUPAC发布了新的国际相对原子质量计。
3.新计算方法2015年国际相对原子质量计采用了现代天平、质谱仪等先进的科学仪器,结合了更为精确的实验数据和更科学的统计方法,对元素的相对原子质量进行了重新计算。
这一计算方法在计算结果的精确度和可靠性上都有了显著提高。
4.科学意义相对原子质量是化学研究中的基础性参数,它直接影响着化学方程式的平衡计算、物质转化的反应热等重要数据的精确性。
新的国际相对原子质量计的推出,为研究人员提供了更为精确的相对原子质量数据,有助于提高科学研究和工程应用中的精确度和准确性。
5.应用前景随着新技术的不断发展,对元素相对原子质量的测定方法也将不断改进,相对原子质量计算的精确度将得到进一步提高。
这将推动化学、物理等学科的发展,同时也对生产制造、环境保护等工程应用带来积极影响。
6.结论2015年国际相对原子质量计的推出,标志着相对原子质量研究进入了一个新的阶段。
这一计算方法的出现,必将在科学研究和工程应用中发挥重要作用,为人类的发展进步提供更为精确和可靠的数据支持。
IUPAC在未来仍然将继续致力于相对原子质量的研究与推广,以不断提升相对原子质量计算的精确度和可靠性。
IUPAC希望通过自己的努力,为全球科学家及其他利益相关者提供更多、更可靠的数据。
由于2015年国际相对原子质量计的推出,化学领域的数据准确性和可靠性得到了显著提高。
附录Ⅱ 相对原子质量表

二、相对原子质量测定的演变
1803年英国著 名化学家道尔 顿提出原子论
1818年瑞典化学 大师用氧的相对 原子质量作基准
18 60 年比利时 化学家斯达改用O = 16 作为相对原
子质量的基准 1961 年, 12C =12.0000 为相 对原子质量的新 基准
可是在1929年,美国化学家乔克等 人在天然氧中发现了16O 、17O 、和18O 三种同位素后, 使以氧的相对原子质 量等于16作基准发生动摇。
解 :设参加反应的氯酸钾的质量为x
2kClO3=M加n热=O22KCl + 302
245
96
x
6g+2g-6.08g
245 x
= 96
质量的基准
1860年比利时化学家斯达改用O= 16作为相对原子量的基准(此基准在化 学领域沿用了整整一个世纪),该基 准可使相对原子质量的数值变小, 同 时保持氢的相对原子质量约等于l,而 所有元素的相对原子质量都大于l等优 点。由于两种体系共存会造成混乱。 在1860年德国的卡尔斯鲁厄会议上, 经意大利化学家康尼查罗的努力, 不 少科学家同意采用斯达体系。这就是 沿用多年的“ 氧单位” 制。
化学小组为了测定某金属元素M的相对原子质量, 设计了如图所示实验,用该金属元素的一种氧化物 (MO)进行实验。(O—16 H—1) 查阅资料知:(1)碱石灰可以吸收水蒸气、二氧化 碳等气体。(2)氯化氢极易溶于水
MO
MO
装置B:除去混合气体中的氯化氢 装置C:除去氢气中的水蒸气 装置E:吸收装置D中生成的水蒸气 装置F:防止空气中的二氧化碳和水蒸气进入E装置
二、相对原子质量测定的演变
1803年英国著 名化学家道尔 顿提出原子论
相对原子质量
国际上为原子质量规定的标准
一 个 碳 原 子 的 质 量:
1.993×10-2 6 kg
一 个 碳 原 子 的 质 量分12等份
1.993×10-2 6 kg 1.661×10-27 kg
12 标准:1.661×10-27 kg
国际上一致同意以一种碳原子质量 的1/12作 为 标 准, 其 他 原 子 的 质 量 跟 它 比 较 所 得 的 值, 就 是 这 种 原 子 的 相 对 原 子 质 量。 例如:
大庆市新潮学校
杨柳
复习提问 1.原子的定义 2.原子的性质
•原子 的 微 观 性 •原 子 的 运 动 性 •原 子 的 间 隔 性
想 一 想
几种原子的质量
几种常 见原子 实际质量/kg 太小了,记忆、书 写、计算都不方便!
-27 1. 674 × 10 氢原子 -26 1.993 × 10 碳原子 -26 2.657 × 10 氧原子 -26 9.288 × 10 铁原子
[小结]:
2.3构成物质的微粒
-------相对原子质量
相对原子质量的定义:
相对原子质量的公式:
请同学们阅读教材51页的《知识视 窗》,你对道尔顿的近代原子理论是 否有疑义?如果有请写一篇小文章发 表你的见解。
根据相对原子质量的定义判断,氮原子的相对 原子质量是( B )
A.14克 C. 2.3254×10-26kg B.14 D. 1.661×10-27 kg
已知一个碳原子质量是n Kg,
一个A原子质量是m Kg,
则A原子的相对原子质量为
( 12m
n
)
铁原子的质量= 9.288×10-26 kg 碳原子质量的1/12= 1.661×10-27kg 求:铁原子的相对原子质量。
相对原子质量和式量

解: H:S:O=(1×2):(32×1):(16 × × ×4)=1:16:32
中各元素的质量比是1:16:32。 答 :H2SO4中各元素的质量比是 。
(1)计算二氧化碳中各元素的质量比。 )计算二氧化碳中各元素的质量比。 (2)计算硫酸铵 (NH4 ) 2SO4)]中 )计算硫酸铵[( 中 各元素的质量比。 各元素的质量比。 (3)计算碳酸氢铵(NH4HCO3)中各 )计算碳酸氢铵( 元素的质量比。 元素的质量比。
相对原子质量 = 质子数 + 中子数
分子由原子构成, 分子由原子构成,一个水分子 的质量大约为多少千克? 的质量大约为多少千克?
2 × 1.674× 10-27千克 2.657× 10-26千克 千克+ × × =2.992 × 10-26千克
原子质量可以用相对质量表示, 原子质量可以用相对质量表示,分子质 量也可以用相对分子质量表示。 相对分子质量表示 量也可以用相对分子质量表示。
3、相对原子质量与原子的实际质量相比, 相对原子质量与原子的实际质量相比, 有什么优点? 有什么优点?
数值比较简单,便于书写、运算、记忆。 数值比较简单,便于书写、运算、记忆。
•4.相对原子质量有没有单位? 4.相对原子质量有没有单位? 4.相对原子质量有没有单位
相对原子质量不是原子的真实质量, 相对原子质量不是原子的真实质量, 而是一个比值,它的SI单位是1 SI单位是 而是一个比值,它的SI单位是1,符 号是1 单位1一般不写出)。 号是1(单位1一般不写出)。
CO2(二氧化碳分子)的相对分子质量: 二氧化碳分子)的相对分子质量: 12 + 16×2 = 44 16× H2SO4(硫酸分子)的相对分子质量: 硫酸分子)的相对分子质量: 1×2 + 32 + 16×4 = 98 × ×
相对原子质量
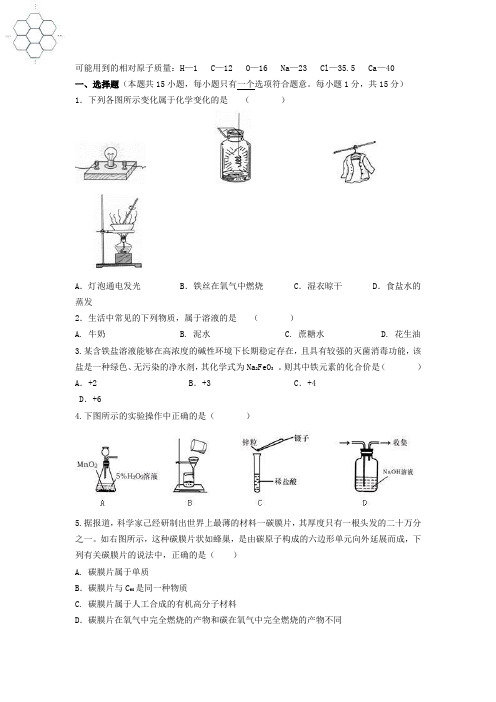
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Cl—35.5 Ca—40一、选择题(本题共15小题,每小题只有一个选项符合题意。
每小题1分,共15分)1.下列各图所示变化属于化学变化的是()A.灯泡通电发光 B.铁丝在氧气中燃烧 C.湿衣晾干 D.食盐水的蒸发2.生活中常见的下列物质,属于溶液的是()A. 牛奶B. 泥水C. 蔗糖水D. 花生油3.某含铁盐溶液能够在高浓度的碱性环境下长期稳定存在,且具有较强的灭菌消毒功能,该盐是一种绿色、无污染的净水剂,其化学式为Na2FeO3。
则其中铁元素的化合价是()A.+2 B.+3 C.+4 D.+64.下图所示的实验操作中正确的是()5.据报道,科学家己经研制出世界上最薄的材料一碳膜片,其厚度只有一根头发的二十万分之一。
如右图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是()A. 碳膜片属于单质B.碳膜片与C60是同一种物质C. 碳膜片属于人工合成的有机高分子材料D.碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同6.学习化学的目的,不在于要成为化学家,重要的是要善于用化学知识去分析、解决生产、生活中的问题。
从化学角度看,下列说法中错误的是()A.发现燃气(天然气、煤气或液化石油气等)泄漏,点火检查出泄漏处B.进入小煤窑严禁吸烟C.炒菜时油锅着火,可用锅盖盖灭火焰D.面料厂、加油站严禁烟火7.在氧化铁(Fe2O3)、氧化亚铁(FeO)和四氧化三铁(Fe3O4)这三种铁的氧化物中,铁的质量分数按由大到小顺序排列的是A.Fe3O4、Fe2O3、FeO B.FeO、Fe2O3、Fe3O4C.FeO、Fe3O4、Fe2O3 D.Fe2O3、Fe3O4、FeO8.为了区别CO(可能混有氧气)与CO2两瓶无色气体,下列方法中可行的是A.分别通入少量澄清石灰水,振荡。
B.伸入燃着的木条。
人教版九年级上册化学:附录Ⅱ 相对原子质量表

大连金石滩实验学校 姚琳
元素
H O C
原子质量
1.674×10-27kg 2.657×10-26kg 1.993×10-26kg
相对原子质量计算
12C一个原子绝对质量 1 1.99310-26 kg 1
12
12
1.66 10-27 kg
中子数
相对原子质量 原子的绝对质量 12C原子质量 1 12
他认为水是由1个氧原子和1个氢原子组 成的。这祥,根据当时拉瓦锡对水的质量 分析的结果,以他选择的氢原子的相对质 量为1做基准,算得氧的相对原子质量为 5.5。
约翰·道尔顿
贝采里乌斯(1779~1848)
瑞典的化学大师贝采里乌斯。这位近代 “化学大厦”的卓越建筑师,对近代化学的贡 献涉及诸多方面。其中最为非凡的是他用 了近二十年的时间,在极其简陋的实验室 里测定了大约两千种化合物的化合量,并 据此在1814~1826年的12年里连续发表了 三张相对原子质量表,所列元素多达49种。 其中大部分相对原子质量已接近现代原子 量数值,这在当时的历史条件下是极其难 能可贵的。
继斯达之后,美国化学家理查兹的 工作更为出色。这使他因此而荣获 1914年诺贝尔化学奖。自1904年起 ,他和他的学生通过大量的分析工作 修正了斯达的相对原子质量值。
相对原子质量基准的演变
道尔顿
斯达
O=100
12C=Байду номын сангаас2
H=1
贝采里乌斯
O=16
尼尔和厄兰
张青莲
张青莲( 1908~2006)
中国著名化学家张青莲教授,中国科学 院资深院士。为相对原子质量的测定作出 了卓越贡献。他于1983年当选为国际原子 量委员会委员。
国际相对原子质量表

原子序數元素名稱元素符號相對原子質量原子序數元素名稱元素符號1氫H 1.00794(7)21鈧Sc 2氦He 4.002602(2)22鈦Ti 3鋰Li 6.941(2)23釩V 4鈹Be9.012182(3)24鉻Cr 5硼B10.811(7)25錳Mn 6碳C12.0107(8)26鐵Fe 7氮N14.0067(2)27鈷Co 8氧O15.9994(3)28鎳Ni 9氟F18.9984032(5)29銅Cu 10氖Ne20.1797(6)30鋅Zn 11鈉Na22.98976928(2)31鎵Ga 12鎂Mg24.3050(6)32鍺Ge 13鋁Al26.9815386(8)33砷As 14硅Si28.0855(3)34硒Se 15磷P30.973762(2)35溴Br 16硫S32.065(5)36氪Kr 17氯Cl35.453(2)37銣Rb 18氬Ar39.948(1)38鍶Sr 19鉀K39.0983(1)39釔Y 20鈣Ca40.078(4)40鋯Zr原子序數元素名稱元素符號相對原子質量原子序數元素名稱元素符號61鉕Pm144.9(2)81鉈Tl 62釤Sm150.36(2)82鉛Pb 63銪Eu151.964(1)83鉍Bi 64釓Gd157.25(3)84釙Po 65鋱Tb158.92535(2)85砹At 66鏑Dy162.500(1)86氡Rn 67鈥Ho164.93032(2)87鈁Fr 68鉺Er167.259(3)88鐳Re 69銩Tm168.93421(2)89錒Ac 70鐿Yb173.054(5)90釷Th 71鑥Lu174.9668(1)91鏷Pa 72鉿Hf178.49(2)92鈾U 73鉭Ta180.94788(2)93錼Np 74鎢W183.84(1)94鈈Pu 75錸Re186.207(1)95鋂Am 76鋨Os190.23(3)96鋦Cm77銥Ir192.217(3)97錇Bk 78鉑Pt195.084(9)98鉲Cf 79金Au196.966569(4)99鑀Es 80汞Hg200.59(2)100鐨Fm相對原子質量原子序數元素名稱元素符號相對原子質量44.955912(6)41鈮Nb92.90638(2) 47.867(1)42鉬Mo95.96(2)50.9415(1)43鎝Tc98.9072(4)51.9961(6)44釕Ru101.07(2)54.938045(5)45銠Rh102.90550(2)55.845(2)46鈀Pd106.42(1) 58.933195(5)47銀Ag107.8682(2) 58.6934(4)48鎘Cd112.411(8) 63.546(3)49銦In114.818(3) 65.38(2)50錫Sn118.710(7) 69.723(1)51銻Sb121.760(1) 72.64(1)52碲Te127.60(3) 74.92160(2)53碘I126.90447(3)78.96(3)54氙Xe131.293(6)79.904(1)55銫Cs132.9054519(2) 83.798(2)56鋇Ba137.327(7) 85.4678(3)57鑭La138.90547(7)87.62(1)58鈰Ce140.116(1)88.90585(2)59鐠Pr140.90765(2) 91.224(2)60釹Nd144.242(3)相對原子質量原子序數元素名稱元素符號相對原子質量204.3833(2)101鍆Md[258.0984] 207.2(1)102鍩No[259.1010] 208.98040(1)103鐒Lr[262.1097] [208.9824]104鑪Rf[261.1088] [209.9871]105 Db[262.1141] [222.0176]106 Sg[266.1219] [223.0197]107 Bh[264.1201] [226.0245]108 Hs[277] [227.0277]109䥑Mt[268] 232.03806(2)110鐽Ds[271] 231.03588(2)111錀Rg[272] 238.02891(3)112鎶Cn[285] [237.0482]113Uut[284] [239.0642]114Fl[289] [243.0614]115Uup[288] [247.0704]116Lv[292][247.0703]117Uus[295] [251.0796]118Uuo[293] [252.0830]119Uue[297] [257.0591]120Ubn[298]。
相对原子质量

记忆下列化学符号
铜、汞、银
Cu、Hg、Ag、 、 、 、
课堂达标
正电荷 1.原子是由居于原子中心、 ______的 1.原子是由居于原子中心、带______的 原子是由居于原子中心 负电荷 原子核和核外带______ 的电子构成, 原子核和核外带______ 的电子构成, 质子 原子核是由_______ ______构成 _______和 中子 构成。 原子核是由_______和______构成。由 相等 于它们所带的电荷总数_______ 于它们所带的电荷总数_______ ,电 相反 不显 _____,所以整个原子______ ______( 性_____,所以整个原子______(填显 或不显)电性。 或不显)电性。
3、月球土壤含有大量氦 原子在,它可 、月球土壤含有大量氦-3原子在 原子在,
能成为未来核能的重要原料。 能成为未来核能的重要原料。氦-3原子 原子 核内有2个质子和 个中子。 个质子和1个中子 核内有 个质子和 个中子。氦-3原子中 原子中 的电子数为( B )
A、1 、 B、2 、 C、3 、 D、4 、
二、 相 对 原 子 质 量
1、原 子 的 实 际 质 量
一 个 碳 原 子 的 质 量: 1.993×10-2 6 千 克 993× 0.000000000000000 00 000000001993 千 克
2、 相 对 原 子 质 量
⑴ 定 义: 国 际 上 以 一 种 碳 原 子(碳12) 质 ) 量 的1/12作 为 标 准, 其 他 原 子 的 质 量 跟 它 作 比 较 所 得 的 值, 就 是 这 种 原 子 的 相 对 原 子质量
氢原子的相对原子质量 = 1.6726×10- 27 kg÷ 1.66×10- 27 kg × ÷ × ≈1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
镎
Np
237.0482
107
钅波
Bh
(262)
80
汞
Hg
200.59
94
钚
Pu
(244)
108
钅黑
Hs
(265)
81
铊
Tl
204.383
95
镅
Am
(243)
109
钅麦
Mt
(266)
82
铅
Pb
207.2
96
锔
Cm
(247)
83
铋
Bi
208.9804
97
锫
Bk
(247)
*括弧中的数值使该放射性元素已知的半衰期最长的同位素的原子质量数。
84
钋
Po
(209)
98
锎
Cf
(251)
71
镥
Lu
174.967
85
砹
At
(210)
99
锿
Es
(252)
72
铪
Hf
178.49
86
氡
Rn
(222)
100
镄
Fm
(257)
73
钽
Ta
180.9479
87
钫
Fr
(223)
101
钔
Md
(258)
74
钨
W
183.85
88
镭
Re
226.0254
102
锘
No
(259)
3
锂
Li
6.941
26
铁
Fe
55.847
49
铟
In
114.82
4
铍
Be
9.01218
27
钴
Co
58.9332
50
锡
Sn
118.710
5
硼
B
10.811
28
镍
Ni
58.69
51
锑
Sb
121.75
6
碳
C
12.011
29
铜
Cu
63.546
52
碲
Te
127.60
7
氮
N
14.0067
30
锌
Zn
65.39
53
碘
I
126.9045
8
氧
O
15.9994
31
镓
Ga
69.723
54
氙
Xe
131.29
9
氟
F
18.998403
32
锗
Ge
72.59
55
铯
Cs
132.9054
10
氖
Ne
20.179
33
砷
As
74.9216
56
钡
Ba
137.33
11
钠
Na
22.98977
34
硒
Se
78.96
57
镧
La
138.9055
12
镁
Mg
75
铼
Re
186.207
89
锕
Ac
227.0278
103
铹
Lr
(262)
76
锇
Os
190.2
90
钍
Th
232.0381
104
鑪
Rf
(261)
77
铱
Ir
192.22
91
镤
Pa
231.0359
105
钅杜
Db
(262)
78
铂
Pt
195.08
92
铀
U
238.0289
106
钅喜
Sg
(263)
79
金
Au
196.9665
44
钌
Ru
101.07
67
钬
Ho
164.9304
22
钛
Ti
47.88
45
铑
Rh
102.9055
68
铒
Er
167.26
23
钒
V
50.9415
46
钯
Pd
106.42
69
铥
Tm
168.9342
原子
序数
名称
元素
符号
相对原
子质量
原子
序数
名称
元素
符号
相对原
子质量
原子
序数
名称
元素
符号
相对原
子质量
70
镱
Yb
173.04
62
钐
Sm
150.36
17
氯
Cl
35.453
40
锆
Zr
91.224
63
铕
Eu
151.96
18
氩
Ar
39.948
41
铌
Nb
92.9064
64
钆
Gd
157.25
19
钾
K
39.0983
42
钼
Mo
95.94
65
铽
Tb
158.9254
20
钙
Ca
40.078
43
锝
Tc
(98)*
66
镝
Dy
162.50
21
钪
Sc
44.95591
附录
附录一国际相对原子质量表
[以相对原子质量Ar(12C)=12为标准]
原子
序数
名称
元素符号Βιβλιοθήκη 相对原子质量原子
序数
名称
元素
符号
相对原
子质量
原子
序数
名称
元素
符号
相对原
子质量
1
氢
H
1.0079
24
铬
Cr
51.9961
47
银
Ag
107.868
2
氦
He
4.002602
25
锰
Mn
54.9380
48
镉
Cd
112.41
24.305
35
溴
Br
79.904
58
铈
Ce
140.12
13
铝
Al
26.98154
36
氪
Kr
83.80
59
镨
Pr
140.9077
14
硅
Si
28.0855
37
铷
Rb
85.4678
60
钕
Nd
144.24
15
磷
P
30.97376
38
锶
Sr
87.62
61
钷
Pm
(145)
16
硫
S
32.066
39
钇
Y
88.9059
