2019IVD及耗材市场分析16页
IVD市场分析报告

IVD市场分析报告1.引言1.1 概述IVD是体外诊断的缩写,是指在体外进行的诊断检验,包括临床化学、免疫学、分子诊断、微生物学和血液学等领域。
近年来,随着人们对个体化医疗的需求增加以及医疗技术的不断进步,IVD市场迎来了快速增长的机遇。
本报告旨在对IVD市场进行深入分析,探讨其发展现状、竞争对手及未来发展趋势,为相关行业提供参考和建议。
"1.2 文章结构":本报告将首先介绍IVD市场的概况,包括市场规模、增长趋势、产品分类等相关信息。
接着,将分析主要竞争对手的情况,包括市场份额、产品特点、市场策略等方面。
然后,将详细分析IVD市场的发展趋势,包括技术创新、消费者需求变化、市场政策影响等方面。
最后,我们将对市场现状进行总结,并展望未来发展,提出建议与展望。
1.3 目的本文旨在对IVD市场进行深入分析,以揭示当前市场现状、主要竞争对手和市场发展趋势。
通过对市场的概况和竞争对手的分析,我们将为读者提供全面的市场了解和行业发展趋势,为投资者和相关行业从业者提供决策参考。
同时,本文也将展望IVD市场的未来发展趋势,为相关企业提供发展建议和展望。
我们旨在让读者对IVD市场有一个全面的认识,从而更好地把握市场机遇和风险,促进市场健康有序发展。
文章1.4 总结部分:在本文的引言部分,我们对IVD市场进行了概述,介绍了文章的结构和目的。
通过对IVD市场概况、主要竞争对手以及市场发展趋势的分析,我们可以得出以下结论:IVD市场具有巨大的发展潜力,市场竞争激烈,未来发展趋势向着个性化定制和数字化转型方向发展。
对于企业来说,需要加强产品创新和技术研发,优化营销渠道,以及加强与医疗机构的合作,以应对市场竞争和满足消费者需求。
在展望未来发展方面,我们对IVD市场的发展持乐观态度,并提出相关的建议与展望,希望能够为企业在IVD 市场中取得成功提供一些建议和思路。
2.正文2.1 IVD市场概况IVD市场概况IVD(体外诊断)市场是医疗行业中一个非常重要的领域,在临床诊断和治疗中起着至关重要的作用。
2019年最新体外诊断(IVD)行业分析报告

目录1、全球IVD行业集中,新兴市场需求旺盛 (3)1.1、全球看行业稳健增长,新兴市场需求强劲。
(3)1.2、行业集中度高,四大巨头占据全球半壁江山 (4)2、巨头发展路径:优势领域精耕细作,外延实现全领域覆盖 (5)2.1、优势领域深耕细作,高研发投入稳固龙头地位 (5)2.2、外延并购实现全领域覆盖,助力全球巨头诞生 (7)3、IVD四大巨头成长史,并购一直在路上 (8)3.1、罗氏:百年罗氏,全球IVD行业霸主 (8)3.1.1、百年跌宕起伏,造就辉煌之路 (8)3.1.2、并购助力登顶,确立体外诊断龙头地位 (8)3.2、雅培:IVD行业元老,多元化的医疗保健公司 (9)3.2.1、专注于医疗保健,产品多元化 (9)3.2.2、体外诊断项目齐全,大并购成就POCT霸主 (10)3.3、西门子:产品线布局最丰富的综合解决方案提供商 (11)3.3.1、医疗设备不断拓新是西门子医疗的历史主旋律 (11)3.3.2、大并购快速实现诊断业务全领域布局 (12)3.4、丹纳赫:热衷并购的全球知名医疗器械公司 (13)3.4.1、涉及领域丰富,实业界并购整合之王 (13)3.4.2、体外诊断业务不断加码,收入快速增长 (14)4、国内借鉴:小时修炼内功,大了外延扩张 (15)1、 全球IVD 行业集中,新兴市场需求旺盛1.1、 全球看行业稳健增长,新兴市场需求强劲。
近年全球体外诊断年均复合增速达5%,预计2020年市场规模达到747亿美元。
随着全球经济的发展、人们保健意识的提高以及全球多数国家医疗保障政策的完善,全球IVD 行业持续发展。
2016 年,全球IVD 行业市场规模约为617亿美元,据Allied Market Research 预测,未来几年内全球IVD 行业将以约5%的年均复合增长率增长,并在2020 年达到747 亿美元。
图1:全球IVD 行业稳健增长(亿美元)欧美市场占据主导地位,新兴市场需求增速迅猛。
2019年医用耗材行业运行现状分析,国家政策大力扶持,助推行业快速发展「图」
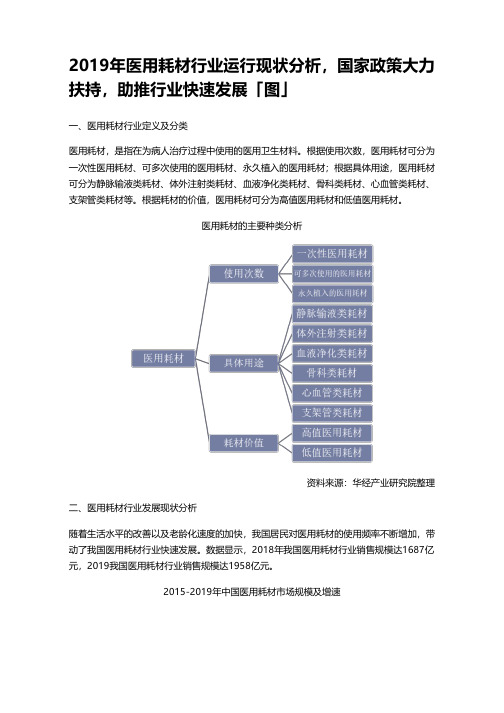
2019年医用耗材行业运行现状分析,国家政策大力扶持,助推行业快速发展「图」一、医用耗材行业定义及分类医用耗材,是指在为病人治疗过程中使用的医用卫生材料。
根据使用次数,医用耗材可分为一次性医用耗材、可多次使用的医用耗材、永久植入的医用耗材;根据具体用途,医用耗材可分为静脉输液类耗材、体外注射类耗材、血液净化类耗材、骨科类耗材、心血管类耗材、支架管类耗材等。
根据耗材的价值,医用耗材可分为高值医用耗材和低值医用耗材。
医用耗材的主要种类分析资料来源:华经产业研究院整理二、医用耗材行业发展现状分析随着生活水平的改善以及老龄化速度的加快,我国居民对医用耗材的使用频率不断增加,带动了我国医用耗材行业快速发展。
数据显示,2018年我国医用耗材行业销售规模达1687亿元,2019我国医用耗材行业销售规模达1958亿元。
2015-2019年中国医用耗材市场规模及增速资料来源:公开资料整理近年来,高值医用耗材市场保持持续增长,但受集中采购、进口替代等因素影响,增速将逐年趋缓, 2018年高值医用耗材市场规模达1046亿元,2019年高值医用耗材市场规模增至1200亿元。
2015-2019年中国高值医用耗材市场规模资料来源:公开资料整理相比高值医用耗材,低值医用耗材因应用广泛,同时受益于我国人民生活水平的提高和医疗需求的增长,将继续保持高速增长,2018年低值医用耗材市场规模为641亿元,同比增长19.81%,2019年中国低值医用耗材市场规模增长至758亿元。
2015-2019年中国低值医用耗材市场规模资料来源:公开资料整理三、医用耗材行业竞争格局分析近年来随着我国企业自主创新意识不断提升,技术水平不断提高,以及政府对医用耗材行业的政策扶持,国内医用耗材市场逐步健康、发展,涌现出一批技术领先的龙头企业。
目前我国已上市高值耗材企业共计17家,分别为乐普医疗、威高股份、健帆生物、大博医疗、欧普康视、启明医疗-B、昊海生物科技、微创医疗、心脉医疗、凯利泰、爱康医疗、赛诺医疗、先健科技、正海生物、春立医疗、冠昊生物及佰仁医疗等。
中国IVD免疫诊断市场深度分析
中国IVD免疫诊断市场深度分析一、免疫诊断市场情况作为IVD领域最大最赚钱的细分领域,基本占了整个IVD的30%-40%的市场份额,对于公司而言,免疫甚至占比超过80%以上,可见,免疫市场,不管对于行业而言,还是公司而言,都是香饽饽。
1.1免疫诊断技术发展免疫诊断历经30多年的技术革新,化学发光已经成为了当前的主流技术。
1.2免疫诊断市场情况中国免疫诊断市场在过去五年整体保持约20%增速,预计2022年市场规模将达524亿。
其中,中高通量市场占主导地位,规模达456亿(见图4)。
相对于低通量市场所面对的急诊科或中小型医院,中高通量市场面对三级医院等大型医院客户,测试量较大且设备单价高,因此中高通量市场规模较大,贡献了大部分的免疫诊断市场体量,免疫流水线在三级医院普及率已经足够高,未来会下沉到二级以下市场,流水线会成为免疫诊断市场的战略高地,各家都是积极布局。
2018-2022年免疫诊断市场规模二、免疫诊断背景政策分析免疫市场如此高的市场份额,和背景政策密不可分,技术的升级,检测项目的扩大,医疗体系改革,国民健康意识提高等是密不可分的。
技术革新,替代进行时“十四五”规划大力强调推进创新产品的开发和产业化,鼓励中国医疗器械创新发展。
化学发光对酶联免疫的替代、仪器的模块化发展和流水线整合推动了三级医院市场的发展,引领免疫诊断行业高速增长。
同时,国产厂家发展也将进一步推动免疫诊断市场下沉,让更多医院能配置诊断结果精准度高且成本低的免疫诊断仪器。
项目扩增,特色项目持续增香目前,中国临床层面所开展的免疫诊断项目可达200多项,并在各级医院广泛普及,主要集中于肿瘤标志物、传染病、甲状腺功能等领域。
相较于美国的常规检测项目,中国目前的常规检测项目仍有很大的扩增空间,而特色检测项目可望成为免疫诊断的增长驱动力。
未来,在国家带量采购(VBP)及疾病诊断相关分组制度(DRG)影响下,常规检测项目竞争将愈加激烈,可能对价格造成冲击。
2019年中国医疗器械行业市场分析:市场需求旺盛,已具备进口替代资质

2019年中国医疗器械行业市场分析:市场需求旺盛,已具备进口替代资质国产高端医疗器械,已经具备进口替代的资质截止至2017年中国医疗器械市场规模约为4450亿元,行业增速20%,远超全球增速增长。
医疗器械细分领域较多,其中包括体外诊断、心血管、影像、骨科等细分,在中国,影像类国产占比约为20-30%,体外诊断类约为30-40%,整体国产占比较低,具备较大的进口替代空间。
近年来随着国产民企的崛起,部分细分领域产品已经可以满足临床需求,政策、资本、专利、人才的完善,都加速了国产替代进口的进程,一些细分如体外诊断的血球市场,国产已经具备替代进口的能力。
预测2019年我国医疗器械行业市场规模将超6400亿随着我国居民生活水平的提高和医疗保健意识的增强,医疗器械产品需求持续增长。
据前瞻产业研究院发布的《中国医疗器械行业市场需求预测与投资战略规划分析报告》统计数据显示,2014-2018年中国医疗器械市场保持高速增长态势。
2014年我国医疗器械行业市场规模已达2556元,2015年我国医疗器械行业市场规模突破3000亿元。
到了2017年我国医疗器械行业市场规模增长至4450亿元,截止至2018年底,我国医疗器械行业市场规模达到了5300亿元。
预测2019年我国医疗器械行业市场规模将达6450亿元。
2014-2019年我国医疗器械行业市场规模统计情况及预测数据来源:前瞻产业研究院整理药品器械估值差异,器械具备三大特性享有高估值相比于制药公司,资本市场对于器械公司给予更高的估值,美股成熟市场的器械估值相对增长(PE/G)平均为2-3(医药为1-1.5),拉长时间周期来看,投资器械公司的复合收益率高于制药公司,我们认为有以下原因:1、增长的稳定性:药品的重磅专利药到期,出现估值悬崖,器械专利壁垒逾越难度大,器械产品生命周期器械更长;2、风险较低:创新药研发,临床结果决定巨额投入可能完全失败,器械没有明确的生杀节点;3、投入产出比高:研发投入产出比更高,器械是门更划算的生意。
2019年版中国医用高值耗材行业市场调研分析报告

2019年版中国医用高值耗材行业市场调研分析报告(部分内容)China's Industrial Market Research and Prospect Forecast Analysis Report(2019-2025)(专业、精准、高效,助力企业决策)2015-2017年中国医用高值耗材行业发展分析一、明确集中采购《高值医用耗材集中采购工作规范》突出重点、以点带面和因地制宜的原则,此次涉及的高值医用耗材采购范围包括血管介入、非血管介入、骨科植入、神经外科、电生理类、起搏器类、体外循环及血液净化、眼科材料等。
《工作规范》明确,县级及县级以上人民政府、国有企业(含国有控股企业)举办的有资质的非营利性医疗机构采购高值医用耗材,必须全部参加集中采购。
同时也鼓励其他具有资质的医疗机构自愿参与高值医用耗材集中采购。
更多详情,请进入机构主页面点击机构官网。
《工作规范》对集中采购工作参与各方提出了相应要求。
包括要求医疗机构必须具备开展相关高值医用耗材临床治疗的有关资质,加强内部管理,对高值医用耗材的采购、储存和使用全过程进行规范管理。
要求医用耗材生产经营企业必须提供合法生产的高值医用耗材,并按照购销合同规定的通用名、规格、包装、品牌、价格和有效期等及时供货,不得提供入围品种外的高值医用耗材。
同时,《工作规范》要求,集中采购要建立科学的评价办法,坚持“质量优先、价格合理、性价比适宜”的原则,考虑临床疗效、质量标准、科技水平、应用范围等因素,对质量、价格、服务和信誉等进行综合评价。
积极研究探索将经济学评价指标纳入综合评价体系。
二、高值耗材编码启动《医疗器械分类目录》修订草案已于2016年完成,形成改革分类目录框架及结构的新版分类目录。
目前,国家总局医疗器械标准管理中心已经按照工作方案组织中检院以及北京、北大、天津、沈阳、上海、济南、杭州、湖北、广州等医疗器械质量监督检验中心和江苏省医疗器械检验所,抽调业务骨干组成专项工作组,并会同各检验机构开展分类目录的修订工作。
2019年中国科研试剂行业市场现状分析,全球龙头企业竞争优势较为明显「图」

2019年中国科研试剂行业市场现状分析,全球龙头企业竞争优势较为明显「图」一、科研试剂的应用领域科研试剂最初诞生于实验室。
教学、科研和生产检验的实验室部门迫切需要一些分析试剂和化学反应用制剂对物质进行定性、定量分析,科研试剂的生产便应运而生。
科研试剂不仅用于测定和验证物质世界的组成和变化,也用于新物质发展和创制,一直被喻为“科学的眼睛”和“质量的标尺”。
随着科研实验需求的不断升级,科研试剂越来越倾向于多样、高纯。
国民经济各行业的研发实验和生产制造越来越向着高精密度的方向发展,科研试剂的品种和需要量逐渐增加。
20世纪50年代以后,新兴的工业如电子工业、核工业、航天工业等和新的科学技术部门如生命科学、材料科学、生物工程、等迅速发展,都要求科研试剂企业提供成千上万个高纯、特纯试剂新品种满足对新物质测定和验证的需要。
科研试剂主要应用领域资料来源:公开资料整理二、中国科研试剂行业发展现状分析2018年中国R&D支出为2971.15亿美元,仅次于美国,规模排名全球第二。
与1998年相比,中国R&D支出20年间增长了接近44倍,而同期间,美国仅增长1.47倍。
2018年全球各国R&D支出规模统计资料来源:公开资料整理近年来,我国R&D经费投入继续呈现逐年上升的趋势,据统计,截至2019年我国R&D 经费投入达到22144亿元,同比增长12.5%,我国研发投入强度已经连续6年超过2%,且呈现出持续上升的态势,目前已超过世界平均水平2.03%。
2010-2019年我国研究与试验发展经费支出及增长资料来源:国家统计局,华经产业研究院整理我国R&D经费投入从活动主体上来看主要由企业、政府属研究机构成,企业是R&D经费投入的绝对主力,2019年我国R&D在企业中投入16887.2亿元,占比76.26%,在政府属研究机构中投入4537.3亿元,占比20.49%。
2024年IVD试剂原料市场调研报告

IVD试剂原料市场调研报告引言本报告对IVD(体外诊断)试剂原料市场进行了全面调研,分析了市场规模、增长趋势、主要参与者以及市场动态等方面的数据。
通过对市场趋势的了解,帮助行业相关企业做出更加明智的决策。
市场概览IVD试剂原料市场是一个快速增长的市场,随着全球医疗卫生服务需求的增加,该市场预计将继续扩大。
市场的主要推动力是疾病的高发率,以及对早期诊断和个性化医疗的需求增加。
市场规模IVD试剂原料市场的规模在过去几年稳步增加,根据我们的研究,市场价值预计在2022年达到100亿美元。
亚太地区是最大的市场,而北美地区则是增长最快的市场。
增长趋势IVD试剂原料市场的增长主要受到技术创新、新产品开发和人口老龄化的影响。
随着新的技术不断涌现,市场的竞争将进一步加剧。
另外,不断增长的老年人口也推动了市场需求的增加,尤其是针对慢性疾病的早期诊断。
主要参与者IVD试剂原料市场的竞争激烈,主要参与者包括但不限于生物技术公司、制药公司和医疗器械公司。
这些公司通过不断创新和研发新产品来增强竞争优势。
同时,市场上也存在一些小型公司和创业公司,它们通过专注于某一特定领域来获取市场份额。
市场动态在IVD试剂原料市场中,监管环境和政府政策对市场发展起着重要作用。
严格的监管和政策限制可能对市场增长产生负面影响。
因此,了解并遵守相关的法规和政策对企业来说至关重要。
结论综上所述,IVD试剂原料市场是一个具有巨大潜力的市场,预计在未来几年将继续高速增长。
随着技术的进步和需求的增加,市场将面临更多机遇和挑战。
在这个竞争激烈的市场中,公司需要不断创新,不断提高产品质量和服务水平,以保持竞争优势和市场份额。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
体外诊断试剂及耗材行业分析本报告以诊断试剂和耗材为主。
体外诊断(IVD)行业包括仪器、试剂和耗材,其中IVD市场80%是试剂,本报告以诊断试剂为主,兼顾部分耗材情况,较少讨论诊断仪器。
目录1.体外诊断试剂1.1 体外诊断试剂是什么1.2 体外诊断试剂分类2.体外诊断试剂产业链情况2.1 体外诊断仪器情况2.2 体外诊断耗材情况2.3 下游需求情况3.体外诊断试剂市场分析3.1 我国体外诊断试剂行业现状3.2 全球体外诊断试剂行业情况——核酸诊断异军突起4. 我国体外诊断试剂行业未来驱动因素4.1 诊疗人次稳步增长,卫生费用增长乏力,结构调整或成为扩容动力4.2 传染病形势严峻,刺激诊断试剂行业发展4.3 血站系统核酸检测大力推广,或带来市场扩容4.4 行业整合,由分散走向集中1.体外诊断试剂概况体外诊断,即In Vitro Diagnosis,缩写IVD,这是一个宽泛的概念,指在人体之外,通过对人体的样品(血液、体液、组织等)进行检测而获取临床诊断信息的产品和服务,包括试剂、试剂产品、校准材料、控制材料、成套工具、仪表、装置、设备或系统等等,包括血液检测、尿液检测等等。
本报告以体外诊断试剂为核心,并兼顾部分耗材情况,探讨这个行业的发展趋势和投资机会。
1.1 体外诊断试剂是什么体外诊断试剂隶属于生物制品行业,是下属诊断试剂行业中的一个细分领域。
体外诊断试剂是指用于单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品(物)等,其作用原理为:诊断试剂与体内物质在体外发生生物化学反应,体液内某些物质——比如糖、脂肪和蛋白质——会和体外诊断试剂在特定条件下发生特定的反应,生成特定的产物,消耗定量的体外诊断试剂,而这些是可以被定性或者定量测量出来的,再通过与正常值的对比,从而判断检测对象的生理状态是否正常。
1.2 体外诊断试剂分类体外诊断试剂的分类方法比较多,通常的分类方法有以下几种:第一,按照检测原理分类,这也是现在的主流分类方法。
根据检测原理或者检测方法,体外诊断试剂可以分为生化诊断试剂、免疫诊断试剂、分子诊断试剂、微生物诊断试剂、尿液诊断试剂、凝血类诊断试剂、血液学和流式细胞诊断试剂等,生化、免疫和分子诊断试剂为我国诊断试剂主要的三大类品种,目前分子诊断中的核酸诊断占据主要市场,生物芯片是未来发展的重要趋势,但目前由于成本较高,开发难度大,使用量还比较小。
图表2:根据检测原理的分类对于以上三种分类,如果从检测端角度来看,其中生化诊断检测项目的检测原理基本相同,主要是利用某些特定的生物化学反应的特定底物或者产物,然后再通过检测仪器(如分光光度计)定量检测出标的物浓度,从而推算出人体的某些生化指标,如糖、脂肪和蛋白质含量是否在正常范围内。
免疫诊断在原理上是利用抗原抗体的特异性结合,但是检测端的方法就比较多了,检测方式多样化,比如利用放射性元素的放射性而准确测量抗原抗体结合的放射免疫(放免)、利用氯金酸在特定环境下通过静电作用与蛋白质大分子结合的胶体金技术、利用活性酶作为标记物的酶联免疫(酶免)、利用镧系元素(稀土元素)螯合物荧光寿命长的特定进行检测的时间分辨荧光法(TRFIA)和利用化学发光原理和免疫反应原理相结合的化学发光检测(CLIA)。
放免由于对环境污染较大,现在逐渐被其他免疫诊断方法所替代,目前酶免是免疫诊断中比较主流的方法。
核酸诊断是目前分子诊断中的主要部分,另一种是生物芯片技术。
分子诊断的检测目标直接是决定生命性状的遗传物质和表现形式,包括DNA、RNA和蛋白质。
在具体诊断技术方面,核酸诊断中的代表技术是聚合酶链式反应(PCR),此外还有NDA测序、荧光原位杂交技术(FISH)、DNA印迹技术(DNA blotting)、单核苷酸多态性(SNP)和连接酶链反应(LCR)。
生物芯片包括基因芯片和蛋白质芯片等。
目前PCR是核酸检测中主要使用的方法。
第二,按医疗器械受理和审评的体外诊断试剂,它包括临床血液学和体液学检验试剂、临床化学检验试剂、临床免疫学检验试剂和微生物学检验试剂等共计九种。
需要特别指出的是按照医疗器械生产监督管理办法管理的体外诊断试剂,不包括国家法定用于血源筛查和采用放射性核素标记的体外诊断试剂产品。
第三,按药品受理和审评的体外诊断试剂。
按照这一分类原则,可将体外诊断试剂分为六大类,包括ABO血型定型试剂(盒)、乙型肝炎表面抗原(HBsAg)试剂(盒)、丙型肝炎病毒(HCV)抗体试剂(盒)、人类免疫缺陷病毒HIV(1+2型)抗体试剂(盒)、人类免疫缺陷病毒抗原/抗体诊断试剂(盒)、梅毒螺旋体抗体试剂(盒)和放射免疫检测试剂(盒)。
除放免试剂(盒)外,前五种诊断试剂如果用于血源筛查时,按照药品受理和审评;如果用于临床诊断,按照第三类医疗器械进行管理。
前五种诊断试剂如果用于血源筛查则需要进行批批检,以保障临床用血的安全。
第四,按照《体外诊断试剂注册管理办法》分类,根据产品风险程度由高至低的顺序,将按照医疗器械进行管理的体外诊断试剂依次分为第三类、第二类、第一类产品,并实施分类注册管理,其中第三类产品注册管理部门为国家食品药品监督管理局,第二类产品为省、自治区、直辖市药品监督管理部门,第一类产品为设区的市级药品监督管理机构。
(一)第三类产品:国家药监局直接管理1.与致病性病原体抗原、抗体以及核酸等检测相关的试剂;2.与血型、组织配型相关的试剂;3.与人类基因检测相关的试剂;4.与遗传性疾病相关的试剂;5.与麻醉药品、精神药品、医疗用毒性药品检测相关的试剂;6.与治疗药物作用靶点检测相关的试剂;7.与肿瘤标志物检测相关的试剂;8.与变态反应(过敏原)相关的试剂。
(二)第二类产品:各省、自治区、直辖市级药监局管理1.用于蛋白质检测的试剂;2.用于糖类检测的试剂;3.用于激素检测的试剂;4.用于酶类检测的试剂;5.用于酯类检测的试剂;6.用于维生素检测的试剂;7.用于无机离子检测的试剂;8.用于药物及药物代谢物检测的试剂;9.用于自身抗体检测的试剂;10.用于微生物鉴别或药敏试验的试剂;11.用于其他生理、生化或免疫功能指标检测的试剂。
(三)第一类产品:市级药监局管理1.微生物培养基(不用于微生物鉴别和药敏试验);2.样本处理用产品,如溶血剂、稀释液、染色液等。
2.体外诊断试剂产业链情况体外诊断试剂上游的核心原料包括诊断酶、引物、抗原、抗体等等,此外还有各种精细化学原料,包括氯化钠、碳酸钠和各种氨基酸以及有机酸等,这些精细化工品的作用主要是调配诊断试剂的缓冲溶液系统。
体外诊断试剂的下游主要是医疗和科研机构,按照用途可以大致划分为医学检测和血源筛查两块。
和体外诊断试剂相关的两个平行的行业包括体外诊断仪器和体外诊断耗材两部分。
2.1 体外诊断仪器情况体外诊断仪器目前以进口产品居多,尤其是中高端市场这一块,国外设备占据了主要市场份额。
不同类型的体外诊断试剂对仪器的依赖度也不同,例如生化诊断仪器以开放式居多,免疫诊断仪器以封闭式居多。
此外,同种类型的体外诊断仪器自动化程度不同,对于试剂的开放程度也不相同,通常高度自动化的仪器是封闭式的,自动化程度较低的仪器是开放式的。
以生化检测设备为例,生化分析仪是临床生化诊断的主要诊断仪器,也是大多数医院最基本的和必备的检验设备。
与手工、半自动生化分析仪相比,全自动生化分析仪具有操作简便、检测速度快、精密度高、重复性好、检测结果不受操作影响等优势,是生化检测发展的方向。
发达国家大部分生化诊断均已实现自动化,我国由于经济发展水平的差异,全自动生化分析仪在二三级医院高端市场中使用较多,基层医院还处于手工、半自动与全自动生化分析仪并存的时期在我国的全自动生化分析仪市场中,日立、奥林巴斯、贝克曼(奥林巴斯诊断业务被贝克曼收购)三家公司占据了约60-70%的市场份额,其中日立占有约30-40%的市场份额。
生化试剂主要用于配合手工、半自动和全自动生化分析仪等检验设备使用。
2.2 体外诊断耗材情况体外诊断耗材主要指真空采血管,由于静脉血液所含有的丰富病理信息,临床检验实验室常用标本中70%是人体静脉血液标本,真空采血管作为主要的体外诊断样本容器,在诊断过程中起着至关重要的作用。
目前真空采血已经发展到第三代,是循证医学发展的产物。
最早的采血管是开放式,很容易受到外部环境的污染,第一代真空采血管采用负压技术,使得整个采血过程与外界隔离,第一代真空采血管的出现是传统采血方式的革命性事件。
在第一代真空采血管的基础上,第二代产品在血液样本采集、盛装和转运环节制定了标准化和规范化流程,使得真空采血管的规格、材质、抽吸量、添加剂等关键指标有了国际标准。
第三代真空采血系统考虑到了血液样本离开人体后的变异作用,这样的变异作用将对检测结果造成影响,所以这一代真空采血管的作用已由静脉血液标本的采集和转运装置转变为静脉血液标本分析前变异控制和处理系统。
采血管是血液离开人体后的第一站,血液离开人体过程中和离开人体后,由于活细胞与活性蛋白对环境的变化发生应激反应,致使血液标本的物理性质、化学性质、生物学性质、生理学性质等发生变化,改变其原始性状,是血液检测面临的主要问题。
血液标本发生变异导致检验结果无法确切地说明在体组织与器官之间的真实情况,医疗机构的检验结果可能是一个失真信息的报告,从而违背了循证医学追求的目标。
所以针对不同的血液检测项目,要使用不同的真空采血管。
在具体实践中,某些诊断项目,不同的诊断试剂对真空采血管的要求也不同,某些诊断试剂的诊断结果会受到采血管的显著影响。
2.3 下游需求情况体外诊断试剂和仪器的下游需求端可以分为两类,一类是用于医学检测,包括医院、体检中心、独立实验室以及防疫站,其中医院是体外诊断行业最大的下游需求端;第二类是用于血源筛查,这个领域的需求端主要是血站系统,其使用总量相对较小,但是对于诊断试剂有着较高的灵敏度的要求。
单从使用量上来看,血站系统在体外诊断试剂市场中占比较低,从检测项目上来看,血站系统的检测项目相对较窄,但是从诊断试剂的使用结构上来看,目前血源筛查主要使用的免疫诊断试剂中的酶联免疫试剂,同时目前在推广核酸诊断,而在医院市场中,核酸诊断的使用则相对较少,所以血站系统的体外诊断试剂使用量虽然比较小,但是对于某些特定的诊断试剂的需求量相对比较大。
3.体外诊断试剂市场分析3.1 我国体外诊断试剂行业现状体外诊断市场中包括诊断试剂、耗材和仪器设备三部分,其中诊断试剂是占比最大的一块,比例在80%左右,其余20%左右的市场是诊断设备和耗材。
2019 年,我国体外诊断市场的总规模预计在146亿元左右,从2019年至2019年,我国体外诊断市场整体增速平稳上升。
