化工原理下册--第六章吸收习题标准答案
化工原理吸收课后习题及答案

化工原理吸收课后习题及答案The latest revision on November 22, 2020第五章 吸收相组成的换算【5-1】 空气和CO 2的混合气体中,CO 2的体积分数为20%,求其摩尔分数y 和摩尔比Y 各为多少解 因摩尔分数=体积分数,.02y =摩尔分数摩尔比 ..020251102y Y y ===--. 【5-2】 20℃的l00g 水中溶解lgNH 3, NH 3在溶液中的组成用摩尔分数x 、浓度c 及摩尔比X 表示时,各为多少解 摩尔分数//117=0.010*******/18x =+浓度c 的计算20℃,溶液的密度用水的密度./39982s kg m ρ=代替。
溶液中NH 3的量为 /311017n kmol -=⨯ 溶液的体积 /.33101109982 V m -=⨯溶液中NH 3的浓度//.33311017==0.581/101109982n c kmol m V --⨯=⨯ 或 . 3998200105058218s sc x kmol m M ρ==⨯=../ NH 3与水的摩尔比的计算或 ..00105001061100105x X x ===--.【5-3】进入吸收器的混合气体中,NH 3的体积分数为10%,吸收率为90%,求离开吸收器时NH 3的组成,以摩尔比Y 和摩尔分数y 表示。
吸收率的定义为解 原料气中NH 3的摩尔分数0.1y =摩尔比 (11101)01111101y Y y ===-- 吸收器出口混合气中NH 3的摩尔比为 摩尔分数 (22200111)=0010981100111Y y Y ==++ 气液相平衡【5-4】 l00g 水中溶解lg 3 NH ,查得20℃时溶液上方3NH 的平衡分压为798Pa 。
此稀溶液的气液相平衡关系服从亨利定律,试求亨利系数E(单位为kPa )、溶解度系数H[单位为/()3kmol m kPa ⋅]和相平衡常数m 。
南工大化工原理第六章习题解答
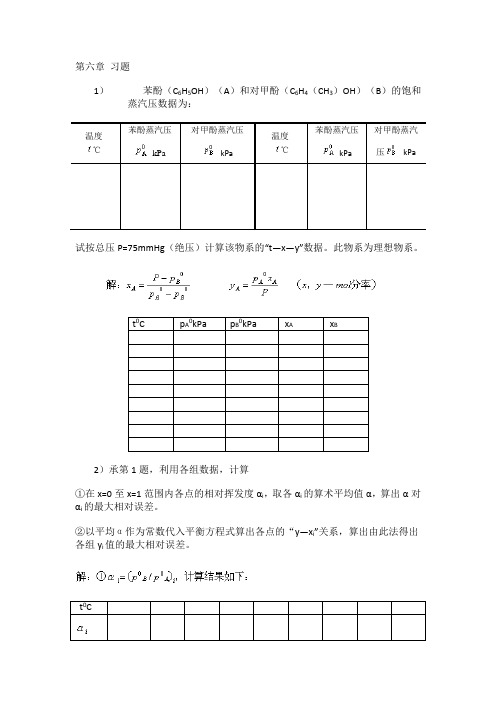
第六章习题1)苯酚(C6H5OH)(A)和对甲酚(C6H4(CH3)OH)(B)的饱和蒸汽压数据为:温度℃苯酚蒸汽压kPa对甲酚蒸汽压kPa温度℃苯酚蒸汽压kPa对甲酚蒸汽压 kPa试按总压P=75mmHg(绝压)计算该物系的“t—x—y”数据。
此物系为理想物系。
t0C p A0kPa p B0kPa x A x B2)承第1题,利用各组数据,计算①在x=0至x=1范围内各点的相对挥发度αi,取各αi的算术平均值α,算出α对αi的最大相对误差。
②以平均α作为常数代入平衡方程式算出各点的“y—x i”关系,算出由此法得出各组y i值的最大相对误差。
t0Ct0Cx i0y i0最大误差=3)已知乙苯(A)与苯乙烯(B)的饱和蒸汽压与温度的关系可按下式算得:式中p0的单位是mmHg,T的单位是K。
问:总压为60mmHg(绝压)时,A与B的沸点各为多少℃在上述总压和65℃时,该物系可视为理想物系。
此物系的平衡汽、液相浓度各为多少摩尔分率4)苯(A)和甲苯(B)混合液可作为理想溶液,其各纯组分的蒸汽压计算式为式中p0的单位是mmHg,t的单位是℃。
试计算总压为850mmHg(绝压)下含苯25%(摩尔百分率)的该物系混合液的泡点。
5)试计算总压为760mmHg(绝压)下,含苯、甲苯(摩尔分率)的混合蒸汽的露点。
若令该二元物系降温至露点以下3℃,求平衡的汽、液相摩尔之比。
6)有一苯(A)、甲苯(B)、空气(C)的混合气体,其中空气占2%,苯与甲苯浓度相等(均指摩尔百分数),气体压强为760mmHg(绝压)。
若维持压强不变,令此三元物系降温至95℃,求所得平衡汽相的组成。
A、B组分均服从拉乌尔定律。
已知95℃时,。
设X A算得的X‘A7)常压下将含苯(A)60%,甲苯(B)40%(均指摩尔百分数)的混合液闪蒸(即平衡蒸馏),得平衡汽、液相,汽相摩尔数占总摩尔数的分率——汽化率(1-q)为。
物系相对挥发度α=,试求:闪蒸所得平衡汽、液相的浓度。
化工原理第六章吸收习题答案解析

等于水扩散出管口的量,即
N A Ad
M
AdZ
则 dZ N AM 5.03 10 6 18 9.054 10 8 m / s
d
1000
在 0, Z 0 到 0, Z 2103m 之间积分,得
2 10-3 9.054 10-8
2.21104 s
6-6 含组分 A 为的混合气,用含 A 为(均为摩尔分数)的液体吸收其中的 A。
解
根据定义式 N A KG
pA p*A
K L c*A cA
和
p
* A
c*A H
,可知
KL
1 H
KG
所以只要求出 KG 即可。又
1 KG
1 kG
1 Hk L
1 5.67 10-5
1
1.98 10-3 0.075
17637
6734
24371
所以
KG 4.110-5 kmol / m2 • h • Pa
3.347104 kmol/
kPa• m3
所以得
c* CO2
HCO2
pCO2
3.347104 50 0.0167kmol/ m3
于是:(1)为吸收过程, c 0.0067kmol/ m3 。
(2)为解吸过程, c 0.0333kmol/ m3 。
分析 (1)推动力的表示方法可以有很多种,比如,用压力差表示时:
1000 kg / m3 )
解:(1)根据已知条件
定义
p* NH3
987Pa
cNH 3
1/17 101/1000
0.5824kmol/ m3
p* NH 3
cNH3
H NH3
HNH3 cNH3 pNH3 5.9104 kmol/ m3 • Pa
化工原理下册答案

第五章 蒸馏一、选择与填空1、精馏操作的依据是 混合液中各组分挥发度的差异 。
实现精馏操作的必要条件是 塔顶液相回流 和 塔底上升蒸汽 。
2、汽液两相呈平衡状态时,汽液两相温度⎽相同⎽,但液相组成⎽小于⎽汽相组成。
3、用相对挥发度α表达的汽液平衡方程可写为1(1)x y xαα=+-。
根据α的大小,可用来 判定用蒸馏方法分离的难易程度 ,若α=1则表示 不能用普通的蒸馏方法分离该混合液 。
4、在精馏操作中,若降低操作压强,则溶液的相对挥发度 增加 ,塔顶温度 降低 ,塔釜温度 降低 ,从平衡角度分析对该分离过程 有利 。
5、某二元物系,相对挥发度α=3,在全回流条件下进行精馏操作,对第ν、ν+1两层理论板,已知 ψν=0.4,则 ψν+1=⎽0.182⎽。
全回流通常适用于 开工阶段 或 实验研究 。
6、精馏和蒸馏的区别在于 精馏必须引入回流;平衡蒸馏和简单蒸馏的主要区别在于前者为连续的稳态过程而后者是间歇的非稳态过程 。
7、精馏塔的塔顶温度总是低于塔底温度,其原因是 塔底压强高 和 塔底难挥发组分含量高 。
8、在总压为101.33κ∏α、温度为85℃下,苯和甲苯的饱和蒸汽压分别为πA 0=116.9κ∏α,πB 0=46 κ∏α,则相对挥发度α= 2.54,平衡时液相组成ξA = 0.78 ,气相组成ψA = 0.90 。
9、某精馏塔的精馏段操作线方程为ψ=0.72ξ+0.275,则该精馏塔的操作回流比为⎽2.371⎽,馏出液组成为⎽0.982⎽。
10、最小回流比的定义是 在特定分离任务下理论板数为无限多时的回流比 ,适宜回流比通常取 1.1~2.0 P μιν11、精馏塔进料可能有 5 种不同的热状况,当进料为气液混合物且气液摩尔比为2:3时,则进料热状况θ值为 0.6 。
注:23()550.6V V L VF V L V LI I I I I q I I I I -+-===-- 12、在塔的精馏段测得 ξ∆=0.96、ξ2=0.45、ξ3=0.40(均为摩尔分率),已知P=3 ,α=2.5,则第三层塔板的气相默弗里效率 E Mς⎽44.1%⎽。
化工原理课后习题答案6气体吸收

第6章气体吸收1)总压100 ,温度25C 的空气与水长时间接触,水中的’的浓度为多少?分别用摩尔浓度和摩尔分率表示。
空气中的体积百分率为0.79。
解:将空气看作理想气体:y=0.79 p*=yp=79kPa 查表得 E=8.76X i05kPa6x p*/E 10H= /(EMS) 1000/(8.76 105 18)6.342 10 6kmoL/(kN.m)C=p*H=79 0.342 X0-5=5.01 X0-4kmol/m 32)已知常压、25T 下某体系的平衡关系符合亨利定律, 亨利系数E 为」… 大气压,溶质A 的分压为0.54大气压的混合气体分别与三种溶液接触: ①溶 质A 浓度为':,f的水溶液;②溶质A 浓度为门八的水溶液; ③溶质A 浓度为的水溶液。
试求上述三种情况下溶质 A 在二相 间的转移方向。
0.001 x2 ------------ 31 10180.003x 3---- 31 10 "8解: E=0.15X 104atm ,p=0.054atm , E015 P0.021 103/18X 1 104 3.6 10 • y 1 mx 1 0.054 P=1atm, y=p/P=0.054y 1 •••平衡 18 10 0.027y 2•••气相转移至液相54 10• y 3 mx30.08 1 y3P=3atm y=0.054 … yE=0.15X 104atm•••液相转移至气相4m=E/P=0.05X 10X4=X3=5.4X 10-5• y 4 mx4 0.027 • y y y4 0 •••气相转移至液相3)某气、液逆流的吸收塔,以清水吸收空气〜硫化氢混合气中的硫化氢。
总压为1大气压。
已知塔底气相中含 "一「- 1.5% (摩尔分率),水中含 "八的浓度为-- !.■(摩尔分率)。
试求塔底温度分别为5C及30E时的吸收过程推动力。
化工原理吸收习题及答案

化工原理吸收习题及答案化工原理吸收习题及答案化工原理是化学工程专业的一门基础课程,主要涉及化学反应原理、物质转化和传递过程等内容。
其中,吸收是一种常见的分离和纯化技术,在化工生产中起到重要作用。
为了帮助学生更好地理解和掌握吸收原理,以下将介绍一些化工原理吸收习题及答案。
习题一:某化工厂需要将氨气从废气中吸收出来,工艺流程如下:氨气从废气中通过气体吸收塔进入吸收液中,吸收液中的氨气通过反应与溶液中的酸发生反应生成盐类。
请回答以下问题:1. 吸收液中的酸应选择什么样的性质?2. 如何选择合适的吸收液浓度?3. 吸收液中酸的浓度越高,吸收效果会如何变化?答案一:1. 吸收液中的酸应选择具有较强酸性的物质,例如硫酸、盐酸等。
这样的酸性物质可以与氨气快速反应生成盐类,实现氨气的吸收。
2. 吸收液的浓度应根据氨气的浓度和吸收效果要求来选择。
一般来说,如果氨气浓度较高,吸收液的浓度也应相应提高,以增加吸收效果。
3. 吸收液中酸的浓度越高,吸收效果会更好。
因为酸浓度越高,氨气与酸反应生成盐类的速率越快,吸收效果也就越好。
习题二:某化工过程中,需要从气体混合物中吸收二氧化硫。
已知气体混合物中的二氧化硫浓度为10%,请回答以下问题:1. 选择合适的吸收液时,应考虑哪些因素?2. 如果吸收液中的溶剂选择不当,会对吸收效果产生什么影响?3. 吸收液中的溶剂浓度选择应如何确定?答案二:1. 在选择合适的吸收液时,应考虑溶剂与待吸收气体的亲和力、反应速率、溶解度等因素。
合适的吸收液应能够与二氧化硫发生反应生成稳定的产物,并且具有较高的溶解度。
2. 如果吸收液中的溶剂选择不当,可能会导致吸收效果不佳甚至无法吸收。
例如,如果溶剂与二氧化硫反应生成的产物不稳定,会导致产物再次分解释放出二氧化硫,从而无法实现吸收的目的。
3. 吸收液中的溶剂浓度选择应根据二氧化硫的浓度和吸收效果要求来确定。
一般来说,如果二氧化硫浓度较高,吸收液的溶剂浓度也应相应提高,以增加吸收效果。
化工原理习题答案-第六章-第九章
第六章 习题1)1) 苯酚(C 6H 5OH )(A )和对甲酚(C 6H 4(CH 3)OH )(B )的饱和蒸汽压数据为:试按总压P=75mmHg (绝压)计算该物系的“t —x —y ”数据。
此物系为理想物系。
分率)—,(解:mol y x P xp y p p p P x AA A BA BA 00=--=2)承第1题,利用各组数据,计算①在x=0至x=1范围内各点的相对挥发度αi ,取各αi 的算术平均值α,算出α对αi 的最大相对误差。
②以平均α作为常数代入平衡方程式算出各点的“y —x i ”关系,算出由此法得出各组y i 值的最大相对误差。
,计算结果如下:)(解:①i A B i p p 00/=α%46.1299.1299.1318.1318.1=-===∑最大误差niαα计,结果如下:按)()318.1112αααiii x x y -+=t 0C113.7 114.6 115.4 116.3 117.0 117.8 118.6 119.4 120.0 x i 1.0 0.837 0.692 0.558 0.440 0.321 0.201 0.0952 0 y i1.0 0.871 0.748 0.625 0.509 0.384 0.249 0.122 0最大误差=31060.2385.0385.0384.0-⨯-=-3)已知乙苯(A )与苯乙烯(B )的饱和蒸汽压与温度的关系可按下式算得:式中p 0的单位是mmHg ,T 的单位是K 。
问:总压为60mmHg (绝压)时,A 与B 的沸点各为多少℃?在上述总压和65℃时,该物系可视为理想物系。
此物系的平衡汽、液相浓度各为多少摩尔分率?CK T T Ln B t p p CK T T Ln A t p p B B A A 00007.6985.34272.63/57.33280193.16608.6195.33495.59/47.32790195.1660)1==∴--====∴--==)(的沸点为,算得的令)(的沸点为算得的,令解:mmHgp Lnp KC t mmHg p A A 81.6895.5915.338/47.32790195.1615.33865602000=∴--====)(,)639.060557.081.68557.092.4881.6892.486092.4872.6315.338/57.33280193.1600=⨯==--==∴--=A A B B y x mmHgp Lnp )(4)苯(A )和甲苯(B )混合液可作为理想溶液,其各纯组分的蒸汽压计算式为式中p 0的单位是mmHg ,t 的单位是℃。
南工大化工原理第六章 习题解答
第六章习题1)苯酚(C6H5OH)(A)和对甲酚(C6H4(CH3)OH)(B)的饱和蒸汽压数据为:温度℃苯酚蒸汽压kPa对甲酚蒸汽压kPa温度℃苯酚蒸汽压kPa对甲酚蒸汽压 kPa113.710.07.70117.811.999.06 114.610.47.94118.612.439.39 115.410.88.2119.412.859.70 116.311.198.5120.013.2610.0 117.011.588.76试按总压P=75mmHg(绝压)计算该物系的“t—x—y”数据。
此物系为理想物系。
t0C pA 0kPa pB0kPa xAxB113.7 10.0 7.70 1.0 1.0 114.6 10.4 7.94 0.837 0.871 115.4 10.8 8.2 0.692 0.748 116.3 11.19 8.5 0.558 0.624 117.0 11.58 8.76 0.440 0.509 117.8 11.99 9.06 0.321 0.385 118.6 12.43 9.39 0.201 0.249 119.4 12.85 9.70 0.0952 0.122 120.0 13.26 10.0 0.000 0.0002)承第1题,利用各组数据,计算①在x=0至x=1范围内各点的相对挥发度αi ,取各αi的算术平均值α,算出α对αi的最大相对误差。
②以平均α作为常数代入平衡方程式算出各点的“y—xi”关系,算出由此法得出各组yi值的最大相对误差。
t0C 113.7 114.6 115.4 116.3 117.0 117.8 118.6 119.4 120.01.299 1.310 1.317 1.316 1.322 1.323 1.324 1.325 1.326t0C 113.7 114.6 115.4 116.3 117.0 117.8 118.6 119.4 120.0 x1.0 0.837 0.692 0.558 0.440 0.321 0.201 0.0952 0i1.0 0.871 0.748 0.625 0.509 0.384 0.249 0.122 0yi最大误差=3)已知乙苯(A)与苯乙烯(B)的饱和蒸汽压与温度的关系可按下式算得:式中p0的单位是mmHg,T的单位是K。
化工原理吸收课后习题及答案
相组成的换算【5-1】 空气和CQ 的混合气体中,CQ 的体积分数为20%求其摩尔分数y 和摩尔比Y 各为多解 因摩尔分数=体积分数,y 0.2摩尔分数x 0.0105或 X 021061 x 1 0.0105【5-3】进入吸收器的混合气体中, NH 的体积分数为10%吸收率为 90%求离开吸收器时 NH的组成,以摩尔比 Y 和摩尔分数y 表示。
吸收率的定义为解原料气中NH 的摩尔分数y 0.1 W 0.1 Y 1 1 0.1111 y 1 0.1吸收器出口混合气中 NH 的摩尔比为少?时, 摩尔比 丫 —1 y 【5-2 】20 C 的 l00g 0251 0.2水中溶解IgNH s NH 在溶液中的组成用摩尔分数 x 、浓度c 及摩尔比X 表示各为多少?解摩尔分数x 1/17 1/17 100/18=0'0105浓度c 的计算20C, 溶液的密度用水的密度998.2 kg / m 3 代替。
溶液中NH 的量为 31 10 /17kmol 溶液的体积 101 10 3 / 998.2 m 33 1 10 /1733 ----------------- =0 281kmol/ mV 101 10 3/ 998.2[、. s998 23或 c -x .02105 0.582kmoJ/m 3M s18NH 与水的摩尔比的计算溶液中NH 的浓度c 摩尔比 摩尔分数y 2 ~^= 0.01110.010981 Y2 1 0.0111【5-4】l00g 水中溶解lg NH 3,查得 气液相平衡20C 时溶液上方 NH 3的平衡分压为798Pa 。
此稀溶液的气 液相平衡关系服从亨利定律,试求亨利系数 E(单位为kPa)、溶解度系数H[单位为kmol/(m 3 kPa)]和相平衡常数总压为100kPa 。
1/17解液相中NH 3的摩尔分数x 1/17 100/18-溶解多少克氧?已知 10C 时氧在水中的溶解度表达式为 衡分压,单位为kPa ; x 为溶液中氧的摩尔分数。
化工原理吸收课后习题及答案
化工原理吸收课后习题及答案The latest revision on November 22, 2020第五章 吸收相组成的换算【5-1】 空气和CO 2的混合气体中,CO 2的体积分数为20%,求其摩尔分数y 和摩尔比Y 各为多少解 因摩尔分数=体积分数,.02y =摩尔分数摩尔比 ..020251102y Y y ===--. 【5-2】 20℃的l00g 水中溶解lgNH 3, NH 3在溶液中的组成用摩尔分数x 、浓度c 及摩尔比X 表示时,各为多少解 摩尔分数//117=0.010*******/18x =+浓度c 的计算20℃,溶液的密度用水的密度./39982s kg m ρ=代替。
溶液中NH 3的量为 /311017n kmol -=⨯ 溶液的体积 /.33101109982 V m -=⨯溶液中NH 3的浓度//.33311017==0.581/101109982n c kmol m V --⨯=⨯ 或 . 3998200105058218s sc x kmol m M ρ==⨯=../ NH 3与水的摩尔比的计算或 ..00105001061100105x X x ===--.【5-3】进入吸收器的混合气体中,NH 3的体积分数为10%,吸收率为90%,求离开吸收器时NH 3的组成,以摩尔比Y 和摩尔分数y 表示。
吸收率的定义为解 原料气中NH 3的摩尔分数0.1y =摩尔比 (11101)01111101y Y y ===-- 吸收器出口混合气中NH 3的摩尔比为 摩尔分数 (22200111)=0010981100111Y y Y ==++ 气液相平衡【5-4】 l00g 水中溶解lg 3 NH ,查得20℃时溶液上方3NH 的平衡分压为798Pa 。
此稀溶液的气液相平衡关系服从亨利定律,试求亨利系数E(单位为kPa )、溶解度系数H[单位为/()3kmol m kPa ⋅]和相平衡常数m 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6-1 已知在101.3 kPa(绝对压力下),100 g 水中含氨1 g 的溶液上方的平衡氨气分压为987 Pa 。
试求:(1) 溶解度系数H (kmol ·m -3·Pa -1); (2) 亨利系数E(Pa); (3) 相平衡常数m ;(4) 总压提高到200 kPa(表压)时的H ,E ,m 值。
(假设:在上述范围内气液平衡关系服从亨利定律,氨水密度均为10003/m kg )解:(1)根据已知条件Pa p NH 987*3=3/5824.01000/10117/13m kmol c NH ==定义333*NH NH NH H c p =()Pa m kmol p c H NH NH NH ∙⨯==-34/109.5333(2)根据已知条件可知0105.018/10017/117/13=+=NH x根据定义式333*NH NH NH x E p =可得Pa E NH 41042.93⨯=(3)根据已知条件可知00974.0101325/987/**33===p p y NH NH 于是得到928.0333*==NH NH NH x y m(4)由于H 和E 仅是温度的函数,故3NH H 和3NH E 不变;而pE px Ex px p x y m ====**,与T 和p 相关,故309.0928.031'3=⨯=NH m 。
分析(1)注意一些近似处理并分析其误差。
(2)注意E ,H 和m 的影响因素,这是本题练习的主要内容之一。
6-2 在25℃下,CO 2分压为50 kPa 的混合气分别与下述溶液接触:(1) 含CO 2为0.01 mol/L 的水溶液; (2) 含CO 2为0.05 mol/L 的水溶液。
试求这两种情况下CO 2的传质方向与推动力。
解: 由亨利定律得到*2250CO CO Ex kPa p == 根据《 化工原理》 教材中表 8-1 查出()kPa E CO 51066.1252⨯=℃ 所以可以得到4*1001.32-⨯=CO x 又因为()()34525/10347.3181066.11000222m kPa kmol EM H OH OH CO ∙⨯=⨯⨯=≈-ρ℃ 所以得34*/0167.05010347.3222m kmol p H c CO CO CO =⨯⨯==- 于是:(1)为吸收过程,3/0067.0m kmol c =∆。
(2)为解吸过程,3/0333.0m kmol c =∆。
分析 (1)推动力的表示方法可以有很多种,比如,用压力差表示时:① kPa H c p CO CO CO 9.2910347.301.04*222=⨯==- 推动力 kPa p 1.20=∆(吸收)② kPa H c p CO CO CO 4.14910347.305.04*222=⨯==- 推动力 kPa p 4.99=∆(解吸) 或者 , 用摩尔分数差表示时 ① 由4108.118100001.02-⨯==CO x ,判断出将发生吸收过程,推动力410201.1-⨯=∆x ;②由 41092-⨯=CO x ,判断出将发生解吸过程,推动力41099.5-⨯=∆x (2)推动力均用正值表示。
6-3 指出下列过程是吸收过程还是解吸过程,推动力是多少,并在x-y 图上表示。
(1) 含SO 2为0.001(摩尔分数)的水溶液与含SO 2为0.03(摩尔分数)的混合气接触,总压为101.3 kPa ,t=35℃; (2) 气液组成及总压同(1) ,t=15℃;(3) 气液组成及温度同(1) ,总压为300 kPa(绝对压力)。
解 (1) 根据《化工原理》教材中表 8-1 知T = 35℃时,SO 2 的kPa E 410567.0⨯=, 故563.10110567.04=⨯==P E m根据相平衡关系 , 得056.0001.056*=⨯==A A mx y由于A A y y >*,所以将发生解吸过程。
传质推动力为026.003.0056.0=-=∆y(2 ) T = 15℃时 , SO 2的 kPa E 410294.0⨯=,故293.10110294.04=⨯==P E m根据相平衡关系 , 得029.0001.029*=⨯==A A mx y由于A A y y <*,所以将发生吸收过程。
传质推动力为001.0029.003.0=-=∆y(3)同理可知 , 当 T = 35℃,p = 300 kPa 时 ,kPa E 410567.0⨯=,故9.18==PEm 0189.0001.09.18*=⨯==A A mx y由于A A y y <*,所以将发生吸收过程。
推动力为0111.00189.003.0=-=∆y示意图见题6-3 图。
题6-3 图分析 体会通过改变温度和总压来实现气液之间传质方向的改变 ,即吸收和解吸。
6-4 氨-空气混合气中含氨0.12(摩尔分数),在常压和25℃下用水吸收,过程中不断移走热量以使吸收在等温下进行。
进气量为1000 m 3 ,出口气体中含氨0.01(摩尔分数)。
试求被吸收的氨量(kg )和出口气体的体积(m 3) 。
解 惰性气体量 388088.01000m V =⨯=,进口中 NH 3 之量为3120m ,出口中NH 3 之量为3988.012.099.001.0120m =⨯,于是总出气量= 880 + 9 =3889m ,被吸收的NH 3量为mol 45442988.3141013258890.01-298314.8101325100012.0=⨯⨯⨯⨯⨯⨯,为 77.3kg 。
分析 (1) 进行物料衡算时应以摩尔数或者质量为基准,一般不以体积为基准。
此处由于温度和压力均不变,故摩尔数的变化正比于体积的变化,所以以体积作为衡算的基准。
(2) 本题是并流还是逆流? 有区别吗 ?(3) 如何才能不断移走热量? 该用填料塔还是板式塔 ? (4) 不移走热量对吸收有什么影响 ?6-5 一浅盘内存有2mm 厚的水层,在20℃的恒定温度下靠分子扩散逐渐蒸发到大气中。
假定扩散始终是通过一层厚度为5mm 的静止空气膜层,此空气膜层以外的水蒸气分压为零。
扩散系数为2.6×10-5m 2/s ,大气压强为1.013×105Pa 。
求蒸干水层所需时间。
解:本题中水层Z 的变化是时间θ的函数,且与扩散速率有关。
122121lnB B B B A A A p p p p p p RTZ DP N --=查教材附录水的物理性质得,20℃时水的蒸汽压为2.3346kPa 。
已知条件为:,3.101,97.983346.23.101,3.101,0,3.101221221kPa p p P kPa p kPa p kPa p kPa p B A B B A A =+==-====代入上式得:()sm kmol p p p p p p RTZ DP N B B B B A A A ∙⨯=--⨯⨯⨯⨯⨯=--=26-5-122121/1003.597.983.101ln97.983.10103.101005.0293314.83.1011060.2ln 水的摩尔质量kmol kg M /18=,设垂直管截面积为A ,在θd 时间内汽化的水量应等于水扩散出管口的量,即AdZ M Ad N A ρθ= 则s m M N d dZ A /10054.91000181003.586--⨯=⨯⨯==ρθ在0=θ,0=Z 到0=θ,m Z 3102-⨯=之间积分,得s 48-3-1021.210054.9102⨯=⨯⨯=θ 6-6 含组分A 为0.1的混合气,用含A 为0.01(均为摩尔分数)的液体吸收其中的A 。
已知A 在气、液两相中的平衡关系为y x =,液气比为0.8,求:(1)逆流操作时,吸收液出口最高组成是多少?此时的吸收率是多少?若5.1=G L,各量又是多少?分别在y-x 图上表示;(2) 若改为并流操作,液体出口最高组成是多少?此时的吸收率又是多少? 解 (1) 逆流操作(题6-6 图(a))时,已知题6-6 图01.001.0101.02≈-=X ,11.01.011.01=-=Y① 当18.0=<=m V L ,以及塔高无穷高时,在塔底达到两相平衡(题8-9图(b)),11.01*1max 1===m Y X X 。
根据物料衡算可知()()03.001.011.08.011.02*112=-⨯-=--=X X VL Y Y 此时 , 吸收率为%7.7211.003.011.0=-=E② 当15.1=>=m V L ,以及塔高无穷高时,在塔顶达到吸收平衡(题 8-9图(b)),01.02*2min 2===mX Y Y 。
仍可以根据物料衡算 ()()min 2121Y Y V X X L -=-,求出077.01=X%9.9011.001.011.0=-=E(2) 并流操作且8.0=V L 时(题8-9 图(c)),因为∞=H ,所以有11mX Y =根据操作线关系,有VLX X Y Y -=--1212式①,②联立,求得:0655.011==Y X于是%5.4011.00655.011.0=-=E分析 逆流吸收操作中,操作线斜率比平衡线斜率大时,气液可能在塔顶呈平衡;此时吸收率最大,但吸收液浓度不是最高。
操作线斜率小于平衡线斜率时,气液在塔底呈平衡;吸收液浓度是最高的,但吸收率不是最高。
6-7 用水吸收气体中的SO 2 ,气体中SO 2 的平均组成为0.02(摩尔分数),水中SO 2 的平均浓度为1g/1000g 。
塔中操作压力为10.13kPa(表压),现已知气相传质分系数G k =0.3×10-2kmol/(m 2·h·kPa ),液相传质分系数L k = 0.4 m/h 。
操作条件下平衡关系50y x =。
求总传质系数K Y (kmol/(m 2·h ))。
解 根据()()()()()()()()*********11111111y y p p p K y y y y p p K y y y y K y y y y K Y Y K N A A Y Y Y Y Y A ---=---=---=⎪⎪⎭⎫ ⎝⎛---=-=和()*A A G A p p K N -=得()()*11y y pK K G Y --=现已知kPa p 4.111=,02.0=y ,4*1081.218100064164150-⨯=+⨯==A mx y ,因此要先根据下式求出G K 才能求出Y K :LG G Hk k K 111+= 因此还要求出 H :()kPa m kmol pmx c x p c H A A A A ∙=⨯≈==3*/01.0504.111181000 于是便可求出()kPa h m kmol K G ∙∙=2/0017.0和()h m kmol K Y ∙=2/187.0分析 此题主要练习各种传质系数之间的转换关系,第二目的是了解各系数的量级。
