氮族元素知识的复习精品PPT课件
合集下载
氮族元素复习PPT教学课件

A.①③ B.①④ C.②③④ D.③④⑤
练习3将一盛满等体积NO和NO2混合 片刻后水面上升的高度为试管容积的
气体的
试管,倒置于水槽中 ( D)
,
A. 2/3
B.1/2
C.5/6
D.1/3
第二节 遥感技术及其应用
上述景观图像是采用什么技术 形成的?
平时的拍照是遥感技术的应用吗?
的污染范围。
课堂小结
三、氮的重要氧化物——NO、NO2
物理 性质
化 学 性 质
NO
NO2
无色,刺激性气味,难溶
红棕色,刺激性气
于水,有毒(机理同CO)
味,易溶 于水,有毒
(1)与O2反应: 2NO + O2 = 2NO2 无色变红棕色
(1)与H2O反应: 3NO2 + H2O = 2HNO3+ 2NO 红棕色褪去
Байду номын сангаас
(2)与水、O2反应:
练习:05天津下列除杂质的方法不可行的是 A、用过量氨水除去Al3+溶液中的少量Fe3+ B、将混合气体通过灼热的铜网除去N2中少量O2 C、用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 D、用盐酸除去AgCl中少量的Ag2CO3
练习:(01综合科化学试测题12)氮是蛋白质的基本组成元素之一, 所有生物体均含蛋白质,氮循环涉及到生物圈的全部领域,以下关 于氮的生物体的吸收途径正确的是 ⑴氮在大气中高达78%,可被生物体直接利用。 ⑵通过高能固氮可将空气中游离的氮转化为硝酸盐和氨,而被植物 吸收。
二、氮气
1、分子结构 思考:N2有哪些重要的物理、化学性质? 2、性质
物理性质:
思考:常温下氮气的化学性质是否活泼?为什么?
氮族元素PPT课件全文

NH2OH可与醛、酮形成肟,是聚酰胺纤维和尼龙的中间体
(3) 叠氮酸 HN3
无色液体或气体
12
3
∶N-N=N∶
1 sp2 杂化 2 sp杂化 π34
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击
NaN3 Zn(N3)2+H2↑
N2↑ +H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂 NaN3、KNO3、SiO2为主要成分用于汽车安全气囊
熔点63K,沸点75K,1mL水仅溶0.023mL,标况下密度为1.25g/L
(2)N2分子中1个σ键和2个π键,无未成对电子,反磁性 (3) N2 不活泼,具有特殊的稳定性,常温下不与任何元
素化合,升高温度可促进反应活性
(4)与锂、钙、镁等活泼金属可生成离子型化合物 室温下仅有 6Li + N2 → 2Li3N
2024/8/19
NH2OH 白色固体
N2H4 无色液体
14
联氨 (NH2-NH2,肼)性质
无色发烟液体,熔点275K,沸点386.5K,极性溶剂,与水 互溶,可溶解多种盐,溶液导电性好
热稳定性差(N-N键能小),250 ℃分解为NH3、N2和H2 二元弱碱(碱性小于NH3)
N2H4 + H2O N2H5+ + OH- K1= 1.7×10-6 N2H5+ + H2O N2H6+ + OH- K2= 7.6×10-15 氧化还原性 酸性溶液中强氧化剂,碱性溶液中是强还原剂 配位性 如 Co(N2H4)6Cl2 、 Fe(N2H4)2Cl2
氮族元素
2024/8/19
(3) 叠氮酸 HN3
无色液体或气体
12
3
∶N-N=N∶
1 sp2 杂化 2 sp杂化 π34
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击
NaN3 Zn(N3)2+H2↑
N2↑ +H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂 NaN3、KNO3、SiO2为主要成分用于汽车安全气囊
熔点63K,沸点75K,1mL水仅溶0.023mL,标况下密度为1.25g/L
(2)N2分子中1个σ键和2个π键,无未成对电子,反磁性 (3) N2 不活泼,具有特殊的稳定性,常温下不与任何元
素化合,升高温度可促进反应活性
(4)与锂、钙、镁等活泼金属可生成离子型化合物 室温下仅有 6Li + N2 → 2Li3N
2024/8/19
NH2OH 白色固体
N2H4 无色液体
14
联氨 (NH2-NH2,肼)性质
无色发烟液体,熔点275K,沸点386.5K,极性溶剂,与水 互溶,可溶解多种盐,溶液导电性好
热稳定性差(N-N键能小),250 ℃分解为NH3、N2和H2 二元弱碱(碱性小于NH3)
N2H4 + H2O N2H5+ + OH- K1= 1.7×10-6 N2H5+ + H2O N2H6+ + OH- K2= 7.6×10-15 氧化还原性 酸性溶液中强氧化剂,碱性溶液中是强还原剂 配位性 如 Co(N2H4)6Cl2 、 Fe(N2H4)2Cl2
氮族元素
2024/8/19
氮族元素复习课ppt化学课件PPT

A、1.0×10-3mol
B、 1.6×10-3mol
C、 2.2×10-3mol
D、 2.4×10-3mol
例二:在氧气中灼烧0.44g铁的某种硫化物,使其中 的硫完全转化为SO2,然后再将生成SO2的转化为 SO3 ,将SO3溶于H2O后,可以与 20mL0 .5mol/LNaOH溶液完全中和。计算原物质中 硫的质量分数。
90.奋斗是万物之父。——陶行知 63.成大事不在于力量多少,而在能坚持多久。 65.在漫长崎岖的人生旅途中,人们要想实现自己的理想和事业,就必须走好自己人生的每一步,就必须领悟到成功者的经验和智慧。幸福和快乐存在于自己抗争困难的过程中,决不是对困难的 妥协。放弃自己就等于放弃一切。Leabharlann 1、推算出x =y=
2、配平以上化学反应方程式。
3、反应中氧化剂为:
4、请标出电子转移的方向与数目。
55.一个人只有在全力以赴的时候才能发挥最大的潜能。 34.请你别悄悄松开你的梦想,迟早有一天它会在你手里发光。 10.生存是人类第一要务,而快乐却是生存的唯一原则。快乐是一个人心灵和精神所表现出来的满足,是最最纯洁和高尚的享受。 68.一个懒惰的少年将来就是一褴褛的老人。 77.有钱的人更有钱,这往往是一种必然。 13.吃得苦中苦,方为人上人。 64.当我们遇到这样或那样的不开心时,不妨静下心想一想,我们做这些事究竟是为了什么。 91.记住该记住的,忘记该忘记的。改变能改变的,接受不能改变的。 70.障碍与失败,是通往成功最稳靠的踏脚石,肯研究、利用它们,便能从失败中培养出成功。 49.给自己定目标,一年,两年,五年,也许你出生不如别人好,通过努力,往往可以改变%的命运。破罐子破摔只能和懦弱做朋友。 69.当我们懂得珍惜平凡的幸福时,就已经成了人生的赢家。 12.如果缺少破土面出并与风雪拚搏的勇气,种子的前途并不比落叶美妙一分。 38.永远不要放弃你真正想要的东西。等待虽难,但后悔更甚。 45.世上没有不弯的路,人间没有不谢的花。人生如四季轮回,既然有春天的花开,也就有秋天的落叶;既然有夏天的骄阳,也就有冬天的风雪。一个人只有经过困境的砥砺,才能焕发出生命的光 彩。
高一化学氮族元素复习PPT教学课件

二氧化氮和溴蒸气的鉴别
NO2和溴蒸气在性质上的相似之处:
A.均有氧化性
B.溶于水后溶液呈酸性
C.能与碱溶液反应
鉴别两者不能用淀粉KI试纸、碱溶液等。
NO2和溴蒸气在性质上的差异之处:
A.通入水中,NO2溶于水发生反应后溶液无色 而溴蒸气溶于水溶液呈橙色
B.通入AgNO3溶液,有淡黄色沉淀生成的为溴蒸气 C.通入CCl4有机溶剂中, 溶于CCl4而且CCl4溶液呈
有毒(机理同CO)
NO2
红棕色,刺激性气味
有毒
与水 与O2
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
与O2、H2O 4NO + 3O2 + 2H2O = 4HNO3 4NO2 + O2 + 2H2O = 4HNO3
NO + NO2 + 2NaOH = 2NaNO2 + H2O
②N2分子的稳定性; ③白磷分子的结构;
④磷的氧化物(P2O5) 、含氧酸(H3PO4)的 性质;
⑤氮的氧化物对大气的污染及防止大气污染。
练习1、As为第四周期第ⅤA族元素,则
As不可能具有的性质是(CD )
A.砷单质通常条件下为固体;
B.砷可以有-3、+3、+5等多种化合价
C.As2O5对应水化物的酸性比H3PO4强 D.砷的还原性比磷弱
性
减
弱
物质类别 单质
氢化物 氧化物 含氧酸
碱 盐
络合物 有机物
化学式或微粒符号
物质类别 单质
氢化物 氧化物
含氧酸 碱 盐
络合物 有机物化学式或微粒符号N2 NH3 N2O、 NO、 N2O3、 NO2、 N2O4、N2O5 HNO3 NH3·H2O NH4+ NO3-
氮族元素--精品PPT课件_OK
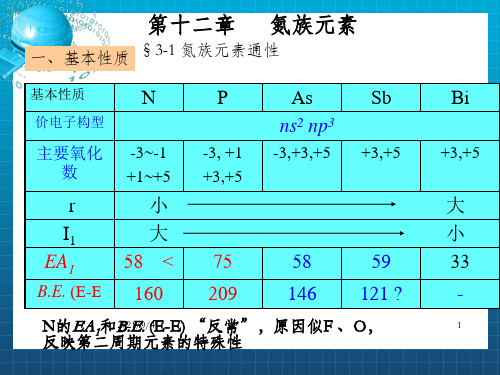
第十二章 氮族元素
一、基本性质 §3-1 氮族元素通性
基本性质
N
价电子构型
主要氧化 数
r I1 EA1
B.E. (E-E
-3~-1 +1~+5
小 大 58 <
160
P
-3, +1 +3,+5
75 209
As ns2 np3
-3,+3,+5
Sb
+3,+5
58
59
146 121 ?
N反的映E第A二1和周B20期.2E1/9.元/(4E素-E的) “特反殊常性”,原因似F 、O,
砷 黄砷 As4 分子晶体 灰砷 金属状晶体(层状)
锑 黄锑 Sb4 分子晶体 灰锑 金属状晶体(层状)
铋 金属晶体,(层状)(教材P.80,图3-4)
2021/9/4
13
As、Sb、Bi皆为亲硫元素→硫化物存在
As2S3, As2S5 Sb2S3, Sb2S5 Bi2S3 3.2 As、Sb、Bi与N、P的比较
它的分子结构如图学方程式
(2) 在上述生成的含氧酸溶液中滴加AgNO3溶液, 有银析出,在试管口有红棕色气体出现,写出反应的化学方程
式。
(3)在NaH2PO4溶液中加入AgNO3溶液,有黄色沉淀生成,请设 计一个简单实验,确定沉淀的成分是
Ag2H2PO4还是Ag3PO4.
可以置换Au+、Ag+、Cu2+、Pb2+
(2)在热碱溶液中歧化
P4 3KOH 20231/H9/42O PH3 3KH2PO2
类似Cl2、Br2、I2、S
( 次磷酸钾) 12
2.2 红磷 结构:有人认为是若干白磷分子断开一键后 互相结合为链状。 化性不如白磷活泼
一、基本性质 §3-1 氮族元素通性
基本性质
N
价电子构型
主要氧化 数
r I1 EA1
B.E. (E-E
-3~-1 +1~+5
小 大 58 <
160
P
-3, +1 +3,+5
75 209
As ns2 np3
-3,+3,+5
Sb
+3,+5
58
59
146 121 ?
N反的映E第A二1和周B20期.2E1/9.元/(4E素-E的) “特反殊常性”,原因似F 、O,
砷 黄砷 As4 分子晶体 灰砷 金属状晶体(层状)
锑 黄锑 Sb4 分子晶体 灰锑 金属状晶体(层状)
铋 金属晶体,(层状)(教材P.80,图3-4)
2021/9/4
13
As、Sb、Bi皆为亲硫元素→硫化物存在
As2S3, As2S5 Sb2S3, Sb2S5 Bi2S3 3.2 As、Sb、Bi与N、P的比较
它的分子结构如图学方程式
(2) 在上述生成的含氧酸溶液中滴加AgNO3溶液, 有银析出,在试管口有红棕色气体出现,写出反应的化学方程
式。
(3)在NaH2PO4溶液中加入AgNO3溶液,有黄色沉淀生成,请设 计一个简单实验,确定沉淀的成分是
Ag2H2PO4还是Ag3PO4.
可以置换Au+、Ag+、Cu2+、Pb2+
(2)在热碱溶液中歧化
P4 3KOH 20231/H9/42O PH3 3KH2PO2
类似Cl2、Br2、I2、S
( 次磷酸钾) 12
2.2 红磷 结构:有人认为是若干白磷分子断开一键后 互相结合为链状。 化性不如白磷活泼
氮族元素基础知识要点课件

氮族元素的化合物
• 氨气(NH3) • 硝酸(HNO3) • 亚硝酸(HNO2) • 氮氧化物(NOx)
氮气的制备和应用
1
制备方法
氮气可以通过加热含氮化合物(如氨)并与空气中的氧反应,或者通过液态空气分离 获得。
2
工业应用
氮气广泛用于保护食品、制造电子产品、灭火和制造氨肥料等工业应用。
3
实验室应用
氮族元素基础知识要点 ppt课件
本课件介绍氮族元素的基础知识要点,包括原子结构和周期表中的位置,氮 族元素的常见性质,以及氮族元素在生活中的重要应用。
原子结构和周期表
原子结构
周期表
氮族元素的原子结构包括核子、 原子核和电子云,这些结构决 定了元素的化学性质。
氮族元素在周期表中位于第15 族,具有相似的电子排布和化 学性质。
氮气被用于实验室中的反应保护、干燥溶剂和制备高纯度化合物。
氮族元素室气体的 一种,对全球气候变暖 起着重要作用。
2 水体富营养化
氮肥的过度使用导致农 业污染,水体富营养化 对水生生物造成危害。
3 酸雨形成
氮氧化物和硫氧化物共 同导致酸雨的形成,对 植被和环境造成破坏。
不活泼
氮族元素在常温下较为稳定,不与大多数物 质发生反应,适合作为惰性气体使用。
氮族元素的重要应用
肥料生产
氮族元素广泛用于农业肥料的 制造,促进植物生长和提高农 作物产量。
液态氮的应用
液态氮被用于制冷冻藏食品、 保护生命器官和制造高温超导 体等领域。
爆炸物制造
一些氮族元素化合物具有爆炸 性,被广泛用于炸药和火箭推 进剂的制造。
氮分子
氮分子由两个氮原子通过共享 电子形成,具有较高的稳定性 和广泛的应用。
氮族元素复习课ppt精选教学PPT课件
第一章:氮族元素
复习课
结构:结构式;电子式;空间构型;化学键与分
氮
子极性
(
金
NH3 物性:易液化;极易溶于水
N
) 磷
属 性 逐
(渐
)
增 强
N2
化性
与水反应:方程式;水溶液显碱性
不稳定性
与酸反应
铵盐
实验室制NH3
与碱
P
氮 族属 性
锑逐
与氧气反应 反应
还原性 与氮氧化物反应
与氯气反应
检验NH4+
Sb
(渐
减 弱
NO= NO2
HNO3
强酸性 不稳定性
与金属反应 与非金属反应
) 铋 (
红磷
P
O2 P2O5 热水
强氧化性 与还原性化合物反应
H3PO4 (具有酸的通性)
)
白磷
Cl2 PCl3
Bi
PCl5
例一:38.4mg金属铜与适量的浓硝酸反应后,生成 标准状况下22 .4mL气体,反应消耗的硝酸的物质 的量可能是:
假如人生不曾相遇,我不知道自己有那样一个习惯,收集你的欢笑,收集你的感情,收集你的一切一切。 假如人生不曾相遇,我不能深刻的体会孤独和忧伤,有着莫名的感动,激荡着热泪盈眶的心情入眠。
假如人生不曾相遇,我不会保持着一个人的想象,即使这想象难免寂寞无奈,但我仍然坚持着这样的梦想。 假如人生不曾相遇,我怎会理解一个人的孤独是那样铭心,但却可以释放自我的彷徨与无助。含泪的沧桑,无限的困惑,因为遇见了你,才会有更深的意义。可为什么在爱的时候,总伴着淡淡的心伤?
A、1.0×10-3mol
B、 1.6×10-3mol
C、 2.2×10-3mol
复习课
结构:结构式;电子式;空间构型;化学键与分
氮
子极性
(
金
NH3 物性:易液化;极易溶于水
N
) 磷
属 性 逐
(渐
)
增 强
N2
化性
与水反应:方程式;水溶液显碱性
不稳定性
与酸反应
铵盐
实验室制NH3
与碱
P
氮 族属 性
锑逐
与氧气反应 反应
还原性 与氮氧化物反应
与氯气反应
检验NH4+
Sb
(渐
减 弱
NO= NO2
HNO3
强酸性 不稳定性
与金属反应 与非金属反应
) 铋 (
红磷
P
O2 P2O5 热水
强氧化性 与还原性化合物反应
H3PO4 (具有酸的通性)
)
白磷
Cl2 PCl3
Bi
PCl5
例一:38.4mg金属铜与适量的浓硝酸反应后,生成 标准状况下22 .4mL气体,反应消耗的硝酸的物质 的量可能是:
假如人生不曾相遇,我不知道自己有那样一个习惯,收集你的欢笑,收集你的感情,收集你的一切一切。 假如人生不曾相遇,我不能深刻的体会孤独和忧伤,有着莫名的感动,激荡着热泪盈眶的心情入眠。
假如人生不曾相遇,我不会保持着一个人的想象,即使这想象难免寂寞无奈,但我仍然坚持着这样的梦想。 假如人生不曾相遇,我怎会理解一个人的孤独是那样铭心,但却可以释放自我的彷徨与无助。含泪的沧桑,无限的困惑,因为遇见了你,才会有更深的意义。可为什么在爱的时候,总伴着淡淡的心伤?
A、1.0×10-3mol
B、 1.6×10-3mol
C、 2.2×10-3mol
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3. 化学性质: 常温下比较稳定
(1) 与氢气的反应
催化剂
N2 + 3H2 高温高压 2NH3 (放热反应) — 合成氨
(2)与O2反应 N2 + O2 放电 2NO (无色)
2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO
NO: 无色、有刺激性气味的难溶于水的有毒气体 NO2:红棕色、有刺激性气味的易溶于水的有毒气 体 (3)与活泼金属反应:N2+3Mg==Mg3N2
性 减
砷 As2O5 H3AsO4 弱
PH3 AsH3
定 性 降 低
硝酸分子所含的氧原子比磷酸、 砷酸少。为什么?
氮原子半径小,限制了它跟氧原子 成键的数目。
二、氮气
1. 物理性质 纯净的氮气是一种无色无味的气体,
难溶于水,难液化,密度比空气略小(与空 气密度相近,只能用排水法收集N2)。
2.N2的结构 电子式:N N 结构式: N≡N
2F2 + 2H2O = 4HF + O2
3NO2+H2O = 2HNO3+NO
硝酸的化学性质
强酸性(与金属反应,不生成氢气) 强氧化性 (浓度越大,氧化性越强)
氧化金属(金、铂 除外)(常温下浓硝酸使铁铝钝化) 氧化非金属(C,S,P) 氧化有机物 (浓热硝酸能使石蕊试液褪色) 氧化还原剂 (H2S, HI, HBr, SO2, Na2SO3,Fe2+等)
C+4HNO3(浓) △ 4NO2↑+ CO2↑+2H2O
HNO3在一定条件下能氧化 C、S、P等非金属单质
HNO3具有 强氧化性
6.浅绿色的硝酸亚铁稀溶液中滴入稀硫酸 (离子方程式)
3Fe2++4H++NO3- =NO↑+3Fe3++2H2O
NO3 -在酸性溶液中能氧化 许多具有还原性的化合物
NO3-在酸性溶液 中具有强氧化性
•氮N •磷P • 砷 As • 锑 Sb • 铋 Bi
最外层有___5___个电子 位于第__Ⅴ__A___族
原子半径逐渐_增___大_
非金属性逐渐__减__弱___ 金属性逐渐___增__强___
怎样证明氮、磷、砷元素的非金属性逐渐减弱?
氮 N2O5 HNO3 酸 NH3
稳
磷 P2O5 H3PO4
7.将过量的铜与少量的浓硝酸作用
Cu+4HNO3 (浓)=Cu(NO3)2+ 2NO2↑+2H2O 3Cu+8HNO3 (稀) =3Cu(NO3)2+ 2NO↑+4H2O
硝酸表现强氧 化性和酸性
浓度变化,还原产物很可能要变化!
一般认为,浓硝酸被还原为NO2 稀硝酸被还原为NO
3.试用不同的方法鉴别溴蒸汽和NO2两种 红棕色气体。
2NH3+H2SO4=(NH4)2SO4
③还原性:
4 NH3+5O2
4NO+6H2O
(氨气的催化氧化)
3、氨的实验室制法
(1) 原理:
2NH4Cl+Ca(OH)2=△= CaCl2+2NH3↑+2H2O
(2) 装置: 与制O2相同 (3)收集方法: 向下排空气法 (4)检验方法:湿润红色石蕊试纸
c、注意事项:
(氨气是中学阶段唯一显示碱性的气体)
体现了碱性
2、化学性质: 思考:氨气
①NH3与水反应: 用向下排空
NH3+H2O
NH3·H2O (可气何逆收验反集满应时?)如
②NH与3·H酸2O反应:NH4++OH—(思氨可考气逆:用反干什应燥么)
NH3+HCl=NH4Cl
干燥剂?
NH3+HNO3=NH4NO3
HNO3能与弱酸盐反应
HNO3的酸性强
3.在王水中体积分数较小的酸与某碱性气体相遇时出现白烟
NH3+HNO3=NH4NO3
HNO3具有挥 发性和酸性
HNO3能与碱、碱性物质反应
4.硝酸久置后变黄
4HNO3 △或光照 4NO2↑+O2↑+2H2O HNO3易分解,越浓越易分解
HNO3具有 不稳定性
5. 某红热的固态单质投入到浓硝酸中有两种酸性气体生成
①验满 湿润红色石蕊试纸 沾浓盐酸的玻璃棒
②干燥剂 碱石灰(NaOH+CaO),
不可用浓H2SO4、P2O5和CaCl2
③简单方法制氨气:
浓氨水
碱石灰 或△
氨气
拓展延伸
1.尾气处理(防倒吸装置选择) 思考:以下各种尾气吸收装置中,适合于吸收易溶 性气体,而且能防止倒吸的是
倒扣漏斗式
知识链接 1.氮族元素的连续氧化
碘化银降雨原理
2.氧族元素的连续氧化
考考自已
能证明氮元素比磷元素非金属性强的事实是
( C D)
(A) 氮气在常温下是气体,而磷单质是固体. (B) N2在空气中不能燃烧,而磷在空气中能燃烧. (C) NH3在空气中不能燃烧,而PH3可以自燃. (D) PH3比NH3还原性强,加热时更容易分解.
1、你能写出哪些氮的氧化物的化学式?O、NO、NO2、N2O4、N2O3、N2O5
N2O、NO、NO2、N2O4均无对应含氧 酸,属不成盐氧化物。N2O3、N2O5分 别是亚硝酸和硝酸的酸酐。
思考题:1.下列混合气体通入水中后, 有一种气体消失另一种气体体积增大 的是( )BC (A)HCl和CO2 (B)O2和F2 (C)NO和NO2 (D)H2和H2S
不稳定性 (变黄原因 ,如何保存?)
1.常温下某黑色不溶物被稀HNO3溶解之后得到蓝色溶液
CuO+2HNO3=Cu(NO3)2+H2O
HNO3能与碱性氧化物反应
HNO3具有酸性
2.HNO3与某种盐的反应证明了氮元素的非金属性比碳元素的非 金属性强
NaHCO3+HNO3=NaNO3+CO2↑+H2O
一、氨气
1、物理性质:
无色;
思考:用 什么方法 收集氨气?
有刺激性气味的气体;
比空气轻;
极易溶于水(1:700)。 氨水的
NH3+H2O
NH3·H2O
(可逆反应)
成分有 哪些?
NH3·H2O
NH4++OH—(可逆反应)
氨水成分:
• 分子: NH3·H2O 、NH3、H2O • 离子: NH4+、OH—、H+ • 氨水为弱电解质? • 氨水和液氨有何区别?
考考自已
现有X、Y两种ⅤA族元素,下列事实不能
说明X的非金属性比Y强的是 ( C)
(A) 酸性强弱:H3XO4 > H3YO4 (B) 气态氢化物的稳定性: XH3 > YH3 (C) 最高价氧化物的稳定性: X2O5 > Y2O5 (D) 气态氢化物的还原性: YH3 > XH3
一、氮族元素成员:
