2002大连理工大学物理化学考研
大连理工大学884物理化学及物理化学实验专...考研内部资料

考研专业课系列辅导之大连理工大学884物理化学及物理化学实验强化讲义全国考研专业课教研中心编光华职业教育咨询服务有限公司目录第一部分强化阶段的“一个目标两项任务” (3)第二部分强化课程主讲内容 (4)第一章化学热力学基础 (4)第二章相平衡热力学 (8)第三章相平衡状态图 (10)第四章化学平衡热力学 (17)第五章统计热力学初步 (20)第六章化学动力学基础 (21)第七章界面层的热力学及动力学 (28)第八章电解质溶液 (29)第九章电化学系统的热力学及动力学 (31)第十章胶体分散系统及粗分散系统 (36)第十一章物理化学实验 (38)第三部分历年真题解析 (39)3.1大连理工大学884物理化学及物理化学实验2010年真题解析 (39)3.2大连理工大学884物理化学及物理化学实验2009年真题解析 (39)3.3大连理工大学884物理化学及物理化学实验2008年真题解析 (41)3.4兄弟院校试题练习 (41)第四部分结束语 (83)第一部分强化阶段的“一个目标两项任务”专业课强化阶段学习时间是9月初至11月初,通过该阶段的学习,学员要达到“一目标”完成“两任务”。
“一个目标”是指做专业课真题自我模拟成绩达到最少120分。
得到这个分数,说明学员已经全面掌握了目标学校的考研基础知识点。
“两项任务”是指掌握教材知识点,研究真题并总结思路。
具体如下:强化阶段任务一:在认真学习完考研专业课公用知识点的基础上,扩展并掌握目标院校目标专业的考研知识点,完成强化、巩固过程,并逐步建立清晰的知识框架图,形成学员自有的知识体系,具体步骤如下(1)通识教材针对指定教材,毫无遗漏的将教材的章节知识点、例题及习题,仔细完整的进行一遍自学,并对把握不准的知识点做好标记;(2)阅读讲义在听课前,先自学一遍强化班讲义,在自学过程中,将讲义中涉及到的知识点标记在教材中。
如果同学还没有完成前面两步,我建议你暂时不要听课,先完成以上两个步骤,然后再听课,这样效果甚佳。
大连理工823复试科目

大连理工823复试科目大连理工大学的823复试科目主要涉及到物理和化学的内容,具体包括以下几个方面:一、复试科目总体情况大连理工大学的823复试科目主要包括物理和化学两门课程。
物理部分主要涉及普通物理学、热力学、电磁学和光学等,化学部分则包括无机化学、分析化学和有机化学等。
这些科目是理工科研究生入学考试的重要内容,也是复试中考察的重点。
二、考试范围和要求1. 普通物理学:考生需要掌握物理的基本概念和规律,如力学、电磁学、光学等。
同时,考生需要具备一定的数学基础,能够运用数学知识解决物理问题。
2. 热力学:考生需要掌握热力学的基本原理和定律,如热力学第一定律和第二定律等。
同时,考生需要了解热力学在工程中的应用,如能量转换和传输等。
3. 电磁学:考生需要掌握电磁学的基本概念和规律,如电场、磁场、电磁感应等。
同时,考生需要了解电磁波的传播和辐射等。
4. 光学:考生需要掌握光的波动性和粒子性,以及光的干涉、衍射、折射等基本光学现象。
同时,考生需要了解现代光学技术如激光技术等的应用。
5. 无机化学:考生需要掌握无机化学的基本原理和反应规律,如酸碱反应、氧化还原反应、沉淀溶解等。
同时,考生需要了解无机化合物在工业生产中的应用。
6. 分析化学:考生需要掌握分析化学的基本原理和方法,如光谱分析、色谱分析等。
同时,考生需要了解分析化学在环境监测、食品检测等领域的应用。
7. 有机化学:考生需要掌握有机化学的基本概念和反应规律,如烷烃、烯烃、醇酚等。
三、考试形式和难度考试形式通常为笔试,考试时间为3小时。
题目难度中等偏难,考察内容广泛且深入。
要求考生具备扎实的基础知识和较强的解决问题能力。
四、复试准备建议考生在准备复试时,首先要夯实基础,把高中和大学期间的物理和化学知识熟练掌握。
其次,要通过习题练习提升解题能力,学会用物理和化学知识解决实际问题。
最后,要认真研读大连理工大学的复试考试大纲,按照要求进行针对性复习。
2002大连理工物理化学

2002大连理工物理化学2002大连理工物理化学2011年05月17日一、判定题(包括10小题,每小题1分,共10分),正确的在题前的括号内画“?”,错误的画“×”:( )1. 一定量理想气体,从相同的始态出发,分别经(i)尽热可逆膨胀; (ii) 尽热不可逆膨胀到的终态体积相同。
则(i)的终态温度比(ii)的终态温度低。
( )2. 催化剂既能加速反应,又能改变反应的DrGmy。
( )3. 在一定温度下,电解质溶液的电导率k与摩尔电导率Lm均随其浓度的增大而增大。
( )4. 使用可充电的化学电池播放录音机时,电池对外输出的电压小于电池的电动势;而对电池充电时,外加电压要大于其电动势。
( )5. 100℃,101 325Pa的H2O(l)向真空膨胀为同温同压的水蒸气为不可逆过程,所以DG<0。
( )6. 反应系统H2(g)+ O2(g)=H2O(g)在温度为T压力为py时,定温定压反应的摩尔焓[变] DrHm为H2O(g)的标准摩尔天生焓[变]DfHm y。
( )7. 由于化学反应的标准平衡常数只是温度的函数,所以只要温度不变,已达成的化学平衡不可能移动。
( )8. 由于大分子溶液是真溶液,是均相的热力学稳定系统,所以无丁达尔效应。
( )9. 稀溶液的依数性是指稀溶液的凝固点降低、沸点升高和渗透压的数值与溶液中所含溶质的分子(或离子)的数目(浓度)成正比,而与溶质分子(或离子)的性质无关。
( )10.鞍点是反应的最低能量途径上的最高点,但它不是势能面上的最高点,也不是势能面上的最低点。
1.二、选择题(包括8小题,每小题2分,共16分),选择正确答案的编号,填在题前的括号内:( )1.定温定压下,一定量纯物质由气态变为液态,则系统和环境的熵变为:(A)DS系>0,DS环<0 (B) DS系<0,DS环>0(C) DS系<0,DS环=0 (D) DS系>0,DS环=0( )2.一定量组成一定的均相系统,无非体积功且定温时,其吉布斯函数随压力的增大而(A) 增大 (B) 减小(C) 不变 (D) 无法确定( )3.20℃时,相同浓度(均为0.005mol×kg-1)的LaCl3,CaCl2和KCl三种电解质水溶液,离子均匀活度因子由大到小的顺序是:(A) LaCl3> CaCl2 >KCl (B) LaCl3 > KCl> CaCl2(C) CaCl2> LaCl3 >KCl (D) KCl > CaCl2 >LaCl3( )4. Al(NO3)3,Mg(NO3)2和NaNO3对AgI水溶胶的聚沉值分别为0.067mol×dm-3,2.60mol×dm-3和140mol×dm-3,则该AgI溶胶是:(A) 正溶胶 (B) 胶粒呈电中性 (C) 负溶胶 (D) 无法确定( )5.某平行反应含有主、副两个反应,主反应的产物为Y,活化能为E1;副反应的产物为Z,活化能为E2,且E1>E2 。
大连理工大学物理化学考研试题

大连理工大学一九九二年硕士生入学考试物理化学及物理化学实验试题一、是非题(包括7小题,每小题2分,共14分)认为正确的用“+”号;错误的用“-”号,于各小前括号内:()1、298K时,H2(g)的标准燃烧热与H20(l)的标准生成热数值上相等。
()2、亨利定律适用于稀溶液中的溶质,而且该溶质在气、液两相中的分子形态必须相同。
()3、半径为r的球形肥皂泡,所产生的附加压力ΔP=(γ为表面张力)()4、分子分散体系是热力学不稳定体系,而胶体分散体系是热力学稳定的体系。
()5、Boltzmann分布即是最可几分布,它可以代替平衡分布。
()6、热电偶的温差电势与热电偶的长度及粗细无关,而与两个接点的温度差有关。
()7、在对峙测定原电池电动势的实验中,当调节电位差计的工作电流时,如果工作电池和标准电池的正负极均接反了,则无论怎样调电阻,检流计的“光点”总是偏向一方。
二、填空题(包括8小题,每小题2分,共16分)在各个小题中画有横线处填上答案:焦-汤系数的定义为μH_______,若某气体的μH<0,则该气体节流后,温度______。
NaHCO3(s)在真空容器中部分分解为Na2CO3(s),H20(g),CO2(g),达到平衡时,该体系的相数φ=___;组分数c=___;自由度数f=___。
电解质的离子强度定义的I_______,1mol·kg-1的CaCl2水溶液I=_____mol·kg-1。
0.1mol·kg-1的CaCl2水溶液,离子平均系数γ±=0.219,则其离子平均活度a±=_____。
在测定二组分完全互溶体系的沸点-组成图的实验中,测定平衡时气、液两相的组成常用的仪器是_____,直接测定的物理量是_____。
在测定双液电池的电动势时,所用的盐桥中填入的电解质溶液通常是____溶液,其浓度必须是____的,该电解质的正负离子的______近似相等。
大连理工大学考研物理真题及详细答案

大连理工大学考研物理真题及详细答案大连理工大学二00四年硕士生入学考试《物理化学》试题一. 是非题1. 如某溶质的稀溶液随溶质浓度的加大其表面张力变小,则在平衡态下该溶质在界面层中的浓度一定大于在溶液本体中的浓度。
2. 一定温度下,化学反应的一定大于该反应的。
3. 二组分真实液态混合物的总蒸气压与组分B的摩尔分数xB成直线关系。
4. 定温定压下,纯物质A的化学势就是该条件下的摩尔吉布斯函数Gm,A5. A和B 形成的固熔体由A(s)和B(s)两相构成。
6. 水在玻璃毛细管中时正常沸点高于100℃。
7. 对于封闭体系,在定压下没有非体积功时,系统从环境吸收的热量全部用来增加热力学能。
8. 物质B有从化学势大的一相转移到化学势小的一相的趋势9. 对于由A和B两组分组成的均相系统,定温定压下再向该系统加入少量A或B时,A的偏摩尔体积V A增加时,B的偏摩尔体积VB就减少。
10. 在其他条件相同时,电解质对溶胶的聚沉值与反离子的化合价数成反比,即反离子的化合价数越高,其聚沉值越小。
11. 在液相进行的A和B间的非催化反应。
其反应速度不受惰性溶剂存在与否的影响。
12. 光化学反应的光量子效率总是在0—1之间二.选择题1. 浓度为0.005mol kg-1的蔗糖水溶液和0.01 mol kg-1的葡萄糖水溶液,二者沸点:A 0.005 mol kg-1 蔗糖水溶液和0.01 mol kg-1的葡萄糖水溶液的沸点大致相同B 0.01 mol kg-1的葡萄糖水溶液的沸点高于0.005 mol kg-1蔗糖水溶液C 无法比较2. 封闭系统内的状态变化:A 如果系统的 Ssys>0,则该变化过程自发B 变化过程只要对环境放热,则该变化过程自发C 仅从系统的 Ssys,变化过程是否自发无法判断3. 真实液态混合物:A 活度因子f的取值在0—1之间B 活度因子f的取值有时大于1C 活度因子f的大小符合: bB趋近于0时,fB的取值趋近于14 在定压下,NaCl晶体,蔗糖晶体,与它们的饱和混合水溶液平衡共存时,独立组分数C和条件自由度:A C=3, =1B C=3, =2C C=4, =2D C=4, =35 若一种液体在某固体表面能铺展,则下列几种描述正确的是:A S<0, >90°B S >0, >90°C S >0, <90°6 下列三种胶体分散系统中,热力不稳定的系统是:A 大分子溶胶B 胶体电解质C 溶胶7 对于NaSO ,其离子平均活度与平均活度因子,质量摩尔浓度间的关系为:A B CD 以上A,B,C 给出的关系都不对三.推导题(10分)A和B两种吸附质在同一均匀固体表面上竞争(同种吸附中心)吸附,每个吸附分子吸附在一个吸附中心上,如果符合兰缪尔(langmuir)假设,试推导证明:达到吸附平衡时,A的表面覆盖度与A,B在气相平衡分压pA和pB 之间的关系为:=( pA)/(1+ pA+ pB) (其中和分别为A,B在该表面的吸附平衡常数)四.作图题(共15分)在固相金属A,B 与它们生成的化合物间完全不互溶,用热分析法测得A和B双组分系统的步冷曲线的转折温度及停歇温度数据如下: 转折温度/℃停歇温度/℃转折温度/℃停歇温度/℃0 - 6300.20 550 4100.37 460 4100.47 - 4100.50 419 410 0.58 - 4390.70 400 2950.93 - 2951.00 - 321(1) 由以上数据绘制A-B系统熔点-组成图(2) 已知A和B的摩尔质量分别为121.8g mol-1和112.4 g mol-1,由相图求A和B形成化合物的最简分子式(3) 对相图中各相区排号,在下表中列出相图中所有液-固两相区的固相成分:相区(号) 固相成分(4) 当为0.25的A-B双组分系统由700℃逐步降低时,液相l(A+B)中B的含量怎样变化(在一定温度区间或温度点的的大小及变化) 五计算题(要求详细计算过程)1.(10分)以知某物质B在液体和固体状态的饱和蒸汽压p(l)及p(s)与温度的关系式分别为:=- +22.405=- +27.650(1) 计算下述过程的G: B(s,1mol,300kPa,200k) B(l,1mol,300kPa,200k)(2) 判断在200k,300kPa下,物质在液态能否稳定存在?2. (6分)已知在定压下某液相反应A B,k1和标准平衡常数与反应温度T有下列关系:=- +6.0 ,则,该正向反应为______________级反应,其标准摩尔焓变和逆向反应的活化能分别为____________________和_________________________________________3. (18分)某溶液中的反应A+B X+Y,反应开始时,A和B的物质的量相等,反应进行1h时A的转换率为75%,求,当反应分别符合下列假设时,进行到2h的时候反应物A剩余多少(以起始量的百分数表示)未反应(液体总体积随反应的变化可忽略)?A) 对A为1级,对B为0级B) 对A和B均为1级C) 对A和B均为0级D) 对A为0级,对B为1级E) 对A为0级,对B为2级F) 对A为2级,对B为0级4.(14分)已知以下数据(I)298.15k的热力学数据物质/(kg mol-1) /(kg mol-1)HgO(s) 73.22O (g) 205.1H O(g) -285.85 70.08Hg(l) 77.4H (g) 130.7(ii)电池的Pt|H (p )|NaOH(aq)|HgO(s)|Hg(l)的E=0.9265V(1)写出阴、阳两极电极反应和电池反应(2)计算该电池反应的(3)计算HgO(s)的分解反应HgO=Hg(l)+(1/2)O2(g)的(298.15K)(4)计算HgO(s)在25℃的分解压5.(12分)某分子B,其运动形式只有三个可及的能级ε1, ε2, ε3,其基态能级是非简并的。
大连理工 考研 科目 参考 用书
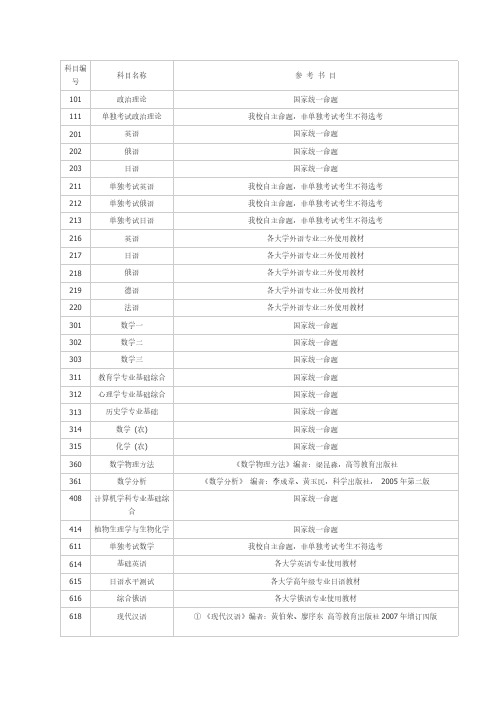
科目编科目名称参考书目号101 政治理论国家统一命题111 单独考试政治理论我校自主命题,非单独考试考生不得选考201 英语国家统一命题202 俄语国家统一命题203 日语国家统一命题211 单独考试英语我校自主命题,非单独考试考生不得选考212 单独考试俄语我校自主命题,非单独考试考生不得选考213 单独考试日语我校自主命题,非单独考试考生不得选考216 英语各大学外语专业二外使用教材217 日语各大学外语专业二外使用教材218 俄语各大学外语专业二外使用教材219 德语各大学外语专业二外使用教材220 法语各大学外语专业二外使用教材301 数学一国家统一命题302 数学二国家统一命题303 数学三国家统一命题311 教育学专业基础综合国家统一命题312 心理学专业基础综合国家统一命题313 历史学专业基础国家统一命题314 数学(农) 国家统一命题315 化学(农) 国家统一命题360 数学物理方法《数学物理方法》编者:梁昆淼,高等教育出版社361 数学分析《数学分析》编者:李成章、黄玉民,科学出版社,2005年第二版408 计算机学科专业基础综国家统一命题合414 植物生理学与生物化学国家统一命题611 单独考试数学我校自主命题,非单独考试考生不得选考614 基础英语各大学英语专业使用教材615 日语水平测试各大学高年级专业日语教材616 综合俄语各大学俄语专业使用教材618 现代汉语①《现代汉语》编者:黄伯荣、廖序东高等教育出版社2007年增订四版②《现代汉语语法研究教程》编者:陆俭明,北京大学出版社,2005年版619 传播学《传播学原理》,编者:张国良复旦大学出版社1995年12月《传播学教程》,编者:郭庆光中国人民大学出版社1999年11月620 民商法原理《民法》编者:魏振瀛,北京大学出版社、高等教育出版社,第三版《商法》编者:范健,北京大学出版社、高等教育出版社,第三版621 马克思主义哲学原理《马克思主义哲学原理》编者:陈先达,中国人民大学出版社,第二版《马克思主义哲学教程》编者赵家祥,聂锦芳,张立波,北京大学出版社,2003年622 管理学基础(1)《管理学》编者:汪克夷等,大连理工大学出版社,2006年第4版(2)《行政管理学》编者:夏书章,高等教育出版社、中山大学出版社,2008年版(3)《教育管理学》编者:陈孝彬,北京师范大学出版社,1999年修订本注:(2)、(3)任选其一623 城市规划历史与理论《中国城市建设史》中国建筑工业出版社《外国城市建设史》中国建筑工业出版社《城市规划原理》中国建筑工业出版社(第3版)624 建筑设计理论综合《中国建筑史》中国建筑工业出版社《外国建筑史(19世纪末叶以前)》中国建筑工业出版社《外国近现代建筑史》中国建筑工业出版社625 中外美术史《中国美术史》洪再新编著,中国美术学院出版社《外国美术简史》中央美术学院美术史系外国美术史教研室编著,高等教育出版社或中国青年出版社626 分析化学及分析化学实《分析化学》编者宫为民等,大连理工大学出版社,2006年第三版验《仪器分析》编者刘志广等,大连理工大学出版社,2007年第二版627 药物化学《药物化学》郑虎主编,第五版,人民卫生出版社《药物化学》,仉文生,李安良主编,高等教育出版社630 无机化学《无机化学》无机化学教研室主编,高等教育出版社,2006 第五版631 分子生物学《现代分子生物学》编者:朱玉贤、李毅,北京高等教育出版社636 体育学专业基础综合《学校体育学》人民体育出版社出版,周登嵩主编,2004《运动训练学》人民体育出版社,体育院校通用教材《运动生理学》人民体育出版社,体育院校通用教材678 社会保障学《社会保障学》编者:陈树文、郭文臣,大连理工大学出版社,第一版501 建筑设计(6小时)《中国建筑史》建工出版社《外国建筑史(19世纪末以前)》建工出版社《建筑空间组合论》编者:彭一刚502 规划设计(6小时)《城市规划资料集》中国建筑工业出版社,第5、6分册,城市设计503 命题创作(手绘)(6小时)801 英语专业综合语言学部分(50分):参考书目:《语言学教程》(修订版),胡壮麟,北京大学出版社。
大连理工大学考研真题物理化学及物理化学实验2003(有答案)

大 连 理 工 大 学二○○三年攻读硕士学位研究生入学考试物理化学及物理化学实验试题一、判断题( )1.绝热过程Q ﹦0,故必是定熵过程。
( )2.某系统从初态Ⅰ经过一个不可逆过程到终态Ⅱ,此过程环境的熵变一定大于该系统由态Ⅰ→态Ⅱ经历可逆过程时环境的熵变。
( )3.H 2(g)和O 2(g)在绝热钢瓶中反应生成水,反应系统的∆H ﹦0, ∆U ﹦0,∆ p ﹦0。
( )4.理想液体混合物与其蒸气达成气、液两相平衡时,气相总压力p 与液相组成x B呈线性关系。
( )5.如果某一化学反应的0r m H ∆>,则该反应的K 随温度升高而增大。
( )6.任何化学反应的半衰期都与反应物的初始浓度有关。
( )7.对同一反应,活化能一定,则反应的起始温度愈低,反应的速率系数对温度的变化愈敏感。
( )8.用能斯特公式算得电池的电动势为正值,表示该电池反应在定温定压下可正向进行。
( )9.可逆过程中,系统的熵不变;不可逆过程中,熵值增大。
( )10.一定量纯气体定温变压时,其转动配分函数不变化。
( )11.胶束溶液是高度分散的均相热力学稳定系统。
( )12.垂直插入水中一支干净的玻璃毛细管,当在管中水上升至平衡液面处加热时,水柱会上升。
( )13.真实液态混合物中组分B 的活度因子值:0<f B <1( )14.一级反应肯定是单分子反应。
( )15.BET 吸附定温式可用于物理吸附。
二、选择题( )1.298.15 K ,已知气相反应2CO (g)﹢O 2(g)→2CO 2(g)的r m G ∆﹦-514.2。
2014年大连理工大学各个专业考研资料

2014年大连理工大学考研资料876管理学--------------------------------------第3页877经济学原理----------------------------------第4页829材料力学(土)------------------------------第4页873公共经济学617公共管理学--------------------第5页传播学、新闻学---------------------------------第6页875信息管理与信息系统--------------------------第7页851电子技术------------------------------------第8页823机械制造基础--------------------------------第9页841热工基础------------------------------------第10页630无机化学------------------------------------第11页880生物化学与生物化学实验----------------------第11页884物理化学与物理化学实验----------------------第12页816材料力学------------------------------------第13页846汽车理论------------------------------------第13页828工程管理------------------------------------第14页885有机化学与有机化学实验----------------------第15页853电路理论------------------------------------第15页854自动控制原理--------------------------------第16页886化工原理与化工原理实验----------------------第16页848船舶静力学--------------------------------- 第17页852信号系统与通信原理--------------------------第18页825材料科学基础------------------------------- 第19页627药物化学-----------------------------------------第19页804高等代数和602数学分析---------------------------第20页806量子力学和601数学物理方法-----------------------第21页QQ:572944604;淘宝店:在校研究生出售专业课资料,淘宝店为876管理学1)2000,2001,2002年大连理工大学考研管理学初试试题(电子版)2)2003,2004,2005年大连理工大学考研管理学初试试题(大部分完整版含答案,电子版)3)2007,2008,2009,2010,2011、2012年大连理工大学考研管理学初试试题(完整版,含答案)4)2013年大连理工大学管理学初试考题(回忆版,稍后更新完整版)5)2010年8月领先教育版辅导班大工管理学辅导班课件(含计算题目,电子版)6)2003,2005,2006,2010,2011年大连理工大学本科生期末考试题(扫描版)5套7)管理学背诵知识点总结(一位管理学考分为133分的学长总结)8)大连理工大学老教授辅导班最新管理学讲义(授课老师为易学东)9)老教授辅导班管理学模拟题(含答案,授课老师为易学东)模拟题目按照题型来划分,详细很符合考试题型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、 判断题(包括10小题,每小题1分,共10分),正确的在题前的括号内画“√”,错误的画“×”:( )1. 一定量理想气体,从相同的始态出发,分别经(i)绝热可逆膨胀; (ii) 绝热不可逆膨胀到的终态体积相同。
则(i)的终态温度比(ii)的终态温度低。
( )2. 催化剂既能加速反应,又能改变反应的∆r G m 。
( )3. 在一定温度下,电解质溶液的电导率κ与摩尔电导率Λm 均随其浓度的增大而增大。
( )4. 使用可充电的化学电池播放录音机时,电池对外输出的电压小于电池的电动势;而对电池充电时,外加电压要大于其电动势。
( )5. 100℃,101 325Pa 的H 2O(l)向真空膨胀为同温同压的水蒸气为不可逆过程,所以∆G <0。
( )6. 反应系统H 2(g)+21O 2(g)=H 2O(g)在温度为T 压力为p 时,定温定压反应的摩尔焓[变] ∆r H m 为H 2O(g)的标准摩尔生成焓[变]∆f H m 。
( )7. 由于化学反应的标准平衡常数只是温度的函数,所以只要温度不变,已达成的化学平衡不可能移动。
( )8. 由于大分子溶液是真溶液,是均相的热力学稳定系统,所以无丁达尔效应。
( )9. 稀溶液的依数性是指稀溶液的凝固点降低、沸点升高和渗透压的数值与溶液中所含溶质的分子(或离子)的数目(浓度)成正比,而与溶质分子(或离子)的性质无关。
( )10.鞍点是反应的最低能量途径上的最高点,但它不是势能面上的最高点,也不是势能面上的最低点。
二、选择题(包括8小题,每小题2分,共16分),选择正确答案的编号,填在题前的括号内:( )1.定温定压下,一定量纯物质由气态变为液态,则系统和环境的熵变为:(A)∆S 系>0,∆S 环<0 (B) ∆S 系<0,∆S 环>0(C) ∆S 系<0,∆S 环=0 (D) ∆S 系>0,∆S 环=0( )2.一定量组成一定的均相系统,无非体积功且定温时,其吉布斯函数随压力的增大而(A) 增大 (B) 减小(C) 不变 (D) 无法确定( )3.20℃时,相同浓度(均为0.005mol⋅kg-1)的LaCl3,CaCl2和KCl三种电解质水溶液,离子平均活度因子由大到小的顺序是:(A)LaCl3> CaCl2 >KCl (B) LaCl3 > KCl> CaCl2(C) CaCl2> LaCl3 >KCl (D) KCl > CaCl2 >LaCl3( )4.Al(NO3)3,Mg(NO3)2和NaNO3对AgI水溶胶的聚沉值分别为0.067mol⋅dm-3,2.60mol⋅dm-3和140mol⋅dm-3,则该AgI溶胶是:(A)正溶胶(B) 胶粒呈电中性(C) 负溶胶(D) 无法确定( )5.某平行反应含有主、副两个反应,主反应的产物为Y,活化能为E1;副反应的产物为Z,活化能为E2,且E1>E2 。
则升高温度,(A)对生成Y有利(B) 对生成Z有利(C) 无影响(D) 无法确定( )6. 水平放置的粗细均匀的毛细玻璃管中有一段汞柱,当在玻璃管右端稍稍加热时,管中汞柱将(A)向左移动(B) 向右移动(C) 不移动(D) 无法确定( )7.与分子运动空间有关的分子运动的配分函数是:(A)振动配分函数(B) 转动配分函数(C) 平动配分函数(D)前三个配分函数均与分子运动空间无关( )8.温度T下,氯仿(A)和丙酮(B)形成非理想液态混合物,此二组分系统气液平衡时,气相压力为29 398Pa,蒸气中丙酮的摩尔分数y B=0.818,而该温度下纯氯仿的饱和蒸气压p A*= 29 571 Pa,则以纯氯仿为标准态时在液相中氯仿的活度a A为:(A)0.500 (B) 0.994 (C) 0.818 (D) 0.181三.填空题(每空1分,共14分),在各体的“”处添上答案:1. 无限稀薄的KCl和LiCl混合溶液中,Cl-离子的迁移数为0.505,Li+的迁移数为0.40,则该溶液中K+离子的迁移数为。
2. 比较60℃下水在可润湿的毛细管中(饱和蒸气压p1)、小液珠形态(饱和蒸气压p2)、烧杯中(饱和蒸气压p3)存在时其饱和蒸气压的由大到小顺序: 。
3. Cd(s)的蒸气压与温度的关系为:lg(p/Pa)===-T K5693+ 6.439Cd(l)的蒸气压与温度的关系为:lg(p/Pa)== -T K5218+ 5.772则Cd的三相点温度为______ K,Cd(s)的摩尔升华焓为kJ·mol-1, Cd(s)的摩尔熔化焓为kJ·mol-1。
4. 已知A, B两种液体完全互溶,在常压下具有最低恒沸混合物组成为D。
若有一组成介于B与D之间的A,B二组分溶液,在常压下经精馏后,在塔顶得产物, 在塔底得产物。
5. 对于反应A Y,测得反应物A的浓度c A与反应时间t成线性关系。
则该反应对于反应物A的级数是。
6. 在抽空的容器中放入NH4HCO3(s),发生反应NH4HCO3(s) ===== NH3 (g) + CO2 (g) + H2O (g)且达到平衡,则这个系统的自由度数f=_______。
7. 纯CCl4(A)及纯SnCl4(B)液体可组成理想液态混合物。
在100℃时,纯CCl4(A)的饱和蒸气压为1.933×105Pa。
已知该二组分形成的液态混合物中,SnCl4摩尔分数(x B)为0.726,在外压力为1.013×105Pa的条件下,加热到100℃时液态混合物开始沸腾。
则开始沸腾时的第一个气泡的组成是y A= , y B= 。
8. 一定T, p下,B组分在α相中的化学势低于在β相的化学势,而其在α相中的浓度高于在β相。
则B组分有自发从相向另一相转移的趋势。
9. 氧化铝瓷件上需要披银,需要判断某温度下液态银在氧化铝表面的润湿情况。
已知σ[Al2O3(s)/g]=1×10-3N·m-1,σ[Ag(l)/g]=0.92×10-3N·m-1,σ[Ag(l)/Al2O3(s)]=1.77×10-3N·m-1。
则液态银与氧化铝瓷件表面的接触角为度,由此判断该温度下液态银在氧化铝表面润湿(选填“能”或“不能”)。
四.读图与画图题(共12分)A、B二组分系统在p 下相图(T-w图)如附图1。
(1)(3分) 将①~⑥各区相的聚集态及成份填入下表;(2)(3分) 水平线EF、DH及DC上体系的自由度分别为、和。
(3)(3分) 在附图2中画出a点冷却的步冷曲线,并在转折点处标出相应的相变化。
(4)(3分) 已知最低共熔点J(w B=0.5)和不相合熔点化合物C(w B=0.67),求系统点为a的某熔液(含A 4.0g, B 6.0g)降温时, 在固体A析出之前, 最多可得到克固体C。
五、计算填空题(共35分)(只要求将结果添在空格处,不要求推导及计算过程)1.(4分)已知N 2(g )的振动频率ν=7.075×1013s -1,转动惯量I =1.394×10-46kg·m 2,则N 2(g )的振动特征温度Θν= K ,转动特征温度Θr = K 。
(已知普朗克常数h =6.6262×10-34J·s ,玻尔兹曼常数k =1.3807×10-23J·K -1)2.(6分)1mol 单原子理想气体从300K ,1000kPa 对抗200kPa 的恒外压,绝热膨胀达到平衡。
计算终态温度T 2= K ,此过程∆H = , ∆S = 。
(已知该气体C V ,m =R 23) 3.(7分)电池Hg (l )|Hg 2Br 2(s) |Br - (aq) | AgBr(s) |Ag(s)的电池电动势与温度的关系为:)15.298/K (312.004.68mV /-+=T E 。
写出p ,298.15K 下,电池通过2F 电量时电池的正极反应、负极反应及电池反应:正极反应负极反应电池反应 ;计算该过程电池反应的∆G = , ∆S = 。
(已知法拉第常数F =96485C·mol -1)4.(6分)反应 2NO + O 2−→− 2NO 2 的反应机理为及各元反应的活化能为: 2NO k1−→− N 2O 2 ; E 1=82 kJ·mol -1 N 2O 2 k -−→−1 2NO ; E -1= 205 kJ·mol -1A w BE H C T /Kt f,A *f,B *T 附图1附图2N 2O 2 +O 2 k 2−→− 2NO 2 ; E 2 =82 kJ·mol -1 设前两个元反应达平衡,试用平衡态处理法建立总反应的动力学方程式=tc d )NO (d 2 ,该反应表观活化能E a= 。
5. (6分)某药物A 在一定温度下每小时分解率与物质的量浓度无关。
其分解反应的速率系数与温度的关系为40.20K/8938)h /ln(1A +-=-T k ,则此药物分解所需的活化能E a= 。
药物分解达30%即为失效,欲使此药物有效期延长到2年以上,其保存温度不能超过 K (一年以365天计算)。
6.(6分)丁烯脱氢制取丁二烯的反应为C 4H 8(g ) C 4H 6(g )+H 2(g)已知298.15K 下C 4H 8(g ),C 4H 6(g )的标准摩尔生成焓[变]分别为-0.125kJ·mol -1和110.06kJ·mol -1;C 4H 8(g ),C 4H 6(g )和H 2(g)的标准摩尔熵分别为305.3J·mol -1·K -1, 278.5 J·mol -1·K -1和130.6 J·mol -1·K -1.(1)计算:298.15K ,100kPa 下反应的标准摩尔焓[变]∆r H m = ,标准摩尔吉布斯能[变]∆r G m = 。
(2)假定反应的标准摩尔焓变∆r H m 不随温度改变,反应在830.15K 下的标准平衡常数K (830.15K )= 。
六、证明题(5分) (请将答案写在答题纸上)请按兰缪尔吸附模型证明纯气体A 2解离吸附A 2+2* (*为固体表面上的吸附位)→ 2(A -*) ,在一定温度下达平衡时,固体表面覆盖度θ与A 2的压力p 的关系式为 bp bp+=1θ (b 为吸附平衡常数)。
七 实验题 (8分)(统考生必答,单考生不答)在化学实验中,常用的水银温度计有普通温度计、成套温度计、精密温度、贝克曼温度计和水银接触温度计。
