生理盐水中氯化钠含量的测定(银量法) 实验报告
生理盐水中氯化钠含量的测定

生理盐水中氯化钠含量的测定集团标准化工作小组 #Q8QGGQT-GX8G08Q8-GNQGJ8-MHHGN#生理盐水中氯化钠含量的测定2010/10/15一、目的要求:1、学习银量法测定氯的原理和方法;2、掌握莫尔法的实际应用二、实验原理:银量法需借助指示剂来确定终点,根据所用指示剂的不同,银量法又分为莫尔法佛尔哈德法和法扬司法。
本实验在中性溶液中以K2CrO4为指示剂,用AgNO3标准溶液来测定Cl-的含量:Ag+ + Cl-= AgCl↓(白色)Ag+ + CrO42-= Ag2CrO4 ↓(砖红色)由于AgCl的溶解度小于Ag2CrO4的溶解度,所以在滴定过程中AgCl先沉淀出来,当AgCl定量沉淀后,微过量的AgNO3溶液便与CrO42-生成砖红色Ag2CrO4沉淀,指示出滴定的终点。
本法也可用于测定有机物中氯的含量。
三、仪器与试剂:1)仪器:①酸式滴定管、移液管、容量瓶。
②锥形瓶(6个)、洗瓶。
③电子天平。
2)试剂:分析中,除非另有说明,限用分析纯试剂、蒸馏水或相同纯度的水。
①AgNO3②NaCl()③K2CrO4(w为)溶液④生理盐水样品四、实验步骤1)L AgNO3标准溶液的配制:AgNO3标准溶液可直接用分析纯的AgNO3结晶配制,但由于AgNO3不稳定,见光易分解,故若要精确测定,则要基准物(NaCl)来标定。
称取 AgNO3,加适量水溶解,转移到100ml容量瓶中,用水稀释至刻度线。
2)标定:准确称取 NaCl,分别置于三个锥形瓶中,各加25ml水使其溶解。
加1ml K2CrO4溶液。
在充分摇动下,用AgNO3溶液滴定至溶液刚出现稳定的砖红色。
记录 AgNO3溶液的用量。
重复滴定二次。
计算AgNO3溶液的浓度。
表一:各物质加入质量和滴定到终点的体积24蒸馏水(ml)25 25 25n(NaCl)(mol)AgNO3(滴定前 ml) 43)测定生理盐水中NaCl的含量:用移液管精确移取已稀释的生理食盐水25ml置于三个锥形瓶中,各加入1ml K2CrO4指示剂,用标准 AgNO3溶液滴定至溶液刚出现稳定的砖红色(边摇边滴)。
沉淀滴定法—生理盐水中氯化钠含量测定(分析化学课件)

中生理盐水中氯化钠的含量测定 一、实验仪器及试剂 实验仪器:酸式滴定管(25mL) 移液管(25mL) 锥形瓶(250mL)
试剂: 0.1mol/LAgNO3溶液 K2CrO4溶液(50 g/L) 生理盐水
生理盐水中氯化钠含量测定 二、测定步骤
将生理盐水稀释1倍后,用移液管精确移取已稀 释的生理盐水25mL置于锥形瓶中,加1mLK2CrO4 溶液,在不断摇动下,用AgNO3滴定液滴定至溶液 呈砖红色即为终点。
.44 g/mol
生理盐水中氯化钠含量测定 注意事项
ü 滴定必须在中性或弱碱性溶液中进行。 ü 滴定时要注意滴定速度并充分摇动。 ü AgNO3试剂及其溶液具有腐蚀性,能破坏皮
肤组织,注意切勿接触皮肤及衣服。
生理盐水中氯化钠含量测定 三、数据处理
记录项目
生理盐水中NaCl含量 测定
次序
滴定液浓度c(mo1/L) 消耗滴定液体积V(mL)
NaCl含量(g/L) NaCl平均含量(g/L)
相对偏差
1
2
0.1003
19.50
19.30
9.14
9.05
9.09
0.5%
NaCl
c AgNO3
VAgNO3 M NaCl 1
生理盐水中氯化钠含量的测定(银量法) 实验报告

实验二十三 生理盐水中氯化钠含量的测定(银量法)一、实验目的(1)学习银量法测定氯的原理和方法;(2)掌握莫尔法的实际应用。
二、实验原理银量法是指以生成难溶银盐(如、、和)的反应为基础的沉AgCl AgBr AgI AgSCN 淀滴定法成为银量法。
银量法需要借助指示剂来确定滴定终点。
根据作用指示剂的不同,银量法又分为莫尔法。
佛尔哈德法和法扬司法。
本实验是在中性溶液中以为指示剂(莫尔法),用标准溶液来测定的42CrO K 3AgNO -Cl 含量:(白)↓=+-+AgCl Cl Ag (砖红色)↓=++42-24CrO Ag CrO Ag 由于的溶解度小于,沉淀将首先从溶液中析出。
根据分布沉淀原AgCl 4AgCrO AgCl 理进行的计算表明,开始沉淀时已定量沉淀,稍一过量,即与4AgCrO AgCl 3AgNO 离子生成砖红色沉淀,指示终点到达。
-24CrO 实验过程中,应注意以下两点:(1)应控制好指示剂的用量。
因为用量太大时使终点提前到达导致负误差,而用42CrO K 量太小时终点拖后导致正误差。
(2)应控制好溶液的酸度。
因为离子在水溶液中存在下述平衡,-24CrO ⇌+-+O H CrO 324OH HCrO 24+-酸性太强,平衡右移,导致离子浓度下降和终点拖后。
但在碱性太强的溶液中,-24CrO 离子又会生成沉淀:+Ag O Ag 2 ↓=+-+AgOH 2OH 2Ag 2 OH O Ag AgOH 222+↓=所以莫尔法要求溶液的pH 值在6.5~10.5之间。
本法也可用于测定有机物中氯的含量。
三、仪器与试剂仪器:烧杯,电子分析天平,容量瓶(100mL ),坩埚,煤气灯,锥形瓶(250mL ),酸式滴定管(50mL ),移液管(25mL )。
试剂:(s ,A.R.),(s ,A.R.),(5%)溶液,生理盐水样品。
3AgNO NaCl 42CrO K 四、实验步骤1.0.1mol/L 标准溶液的配制3AgNO 标准溶液可直接用分析纯的结晶配制,但由于不稳定,见光3AgNO 3AgNO 3AgNO 易分解,故若要精确测定,则要基准物来标定。
生理盐水中氯化钠含量的测定

生理盐水中氯化钠含量的测定文稿归稿存档编号:[KKUY-KKIO69-OTM243-OLUI129-G00I-FDQS58-生理盐水中氯化钠含量的测定2010/10/15一、目的要求:1、学习银量法测定氯的原理和方法;2、掌握莫尔法的实际应用二、实验原理:银量法需借助指示剂来确定终点,根据所用指示剂的不同,银量法又分为莫尔法佛尔哈德法和法扬司法。
本实验在中性溶液中以K2CrO4为指示剂,用AgNO3标准溶液来测定Cl-的含量:Ag+ + Cl-= AgCl↓(白色)Ag+ + CrO42-= Ag2CrO4↓(砖红色)由于AgCl的溶解度小于Ag2CrO4的溶解度,所以在滴定过程中AgCl先沉淀出来,当AgCl定量沉淀后,微过量的AgNO3溶液便与CrO42-生成砖红色Ag2CrO4沉淀,指示出滴定的终点。
本法也可用于测定有机物中氯的含量。
三、仪器与试剂:1)仪器:①酸式滴定管、移液管、容量瓶。
②锥形瓶(6个)、洗瓶。
③电子天平。
2)试剂:分析中,除非另有说明,限用分析纯试剂、蒸馏水或相同纯度的水。
①AgNO3②NaCl()③K2CrO4(w为0.05)溶液④生理盐水样品四、实验步骤1)0.1mol/L AgNO3标准溶液的配制:AgNO3标准溶液可直接用分析纯的AgNO3结晶配制,但由于AgNO3不稳定,见光易分解,故若要精确测定,则要基准物(NaCl)来标定。
称取1.702g AgNO3,加适量水溶解,转移到100ml容量瓶中,用水稀释至刻度线。
2)标定:准确称取0.0585g NaCl,分别置于三个锥形瓶中,各加25ml水使其溶解。
加1mlK 2CrO4溶液。
在充分摇动下,用AgNO3溶液滴定至溶液刚出现稳定的砖红色。
记录 AgNO3溶液的用量。
重复滴定二次。
计算AgNO3溶液的浓度。
表一:各物质加入质量和滴定到终点的体积24AgNO3(滴定前 ml)413.222.33)测定生理盐水中NaCl的含量:用移液管精确移取已稀释的生理食盐水25ml置于三个锥形瓶中,各加入1ml K2CrO4指示剂,用标准 AgNO3溶液滴定至溶液刚出现稳定的砖红色(边摇边滴)。
盐水中氯化钠含量测定方法的探讨
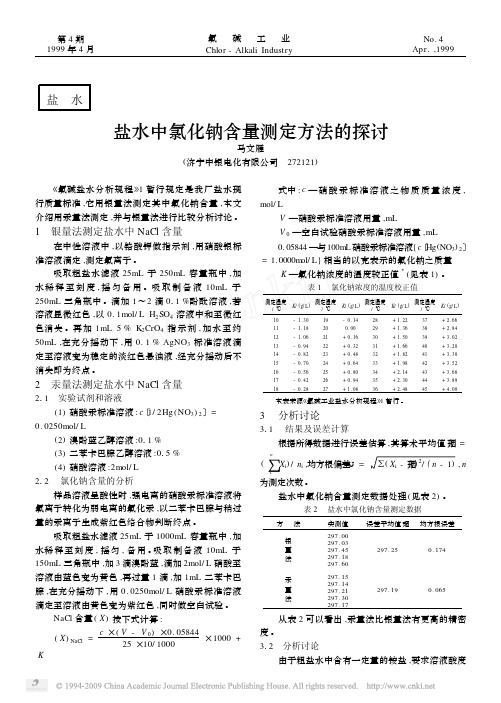
盐 水盐水中氯化钠含量测定方法的探讨马文雁(济宁中银电化有限公司 272121) 《氯碱盐水分析规程》1暂行规定是我厂盐水现行质量标准,它用银量法测定其中氯化钠含量,本文介绍用汞量法测定,并与银量法进行比较分析讨论。
1 银量法测定盐水中NaCl含量在中性溶液中,以铬酸钾做指示剂,用硝酸银标准溶液滴定,测定氯离子。
吸取粗盐水滤液25mL于250mL容量瓶中,加水稀释至刻度,摇匀备用。
吸取制备液10mL于250mL三角瓶中。
滴加1~2滴011%酚酞溶液,若溶液显微红色,以0.1mol/L H2SO4溶液中和至微红色消失。
再加1mL5%K2CrO4指示剂,加水至约50mL,在充分摇动下,用0.1%AgNO3标准溶液滴定至溶液变为稳定的淡红色悬浊液,经充分摇动后不消失即为终点。
2 汞量法测定盐水中NaCl含量211 实验试剂和溶液(1)硝酸汞标准溶液:c〔1/2Hg(NO3)2〕=0.0250mol/L(2)溴酚蓝乙醇溶液:011%(3)二苯卡巴腙乙醇溶液:015%(4)硝酸溶液:2mol/L212 氯化钠含量的分析样品溶液呈酸性时,强电离的硝酸汞标准溶液将氯离子转化为弱电离的氯化汞,以二苯卡巴腙与稍过量的汞离子生成紫红色络合物判断终点。
吸取粗盐水滤液25mL于1000mL容量瓶中,加水稀释至刻度,摇匀,备用。
吸取制备液10mL于150mL三角瓶中,加3滴溴酚蓝,滴加2mol/L硝酸至溶液由蓝色变为黄色,再过量1滴,加1mL二苯卡巴腙,在充分摇动下,用0.0250mol/L硝酸汞标准溶液滴定至溶液由黄色变为紫红色,同时做空白试验。
NaCl含量(X)按下式计算:(X)NaCl=c×(V-V0)×0.0584425×10/1000×1000+K式中:c—硝酸汞标准溶液之物质质量浓度, mol/LV—硝酸汞标准溶液用量,mLV0—空白试验硝酸汞标准溶液用量,mL0.05844—与100mL硝酸汞标准溶液{c〔Hg(NO3)2〕=1.0000m ol/L}相当的以克表示的氯化钠之质量K—氯化钠浓度的温度较正值3(见表1)。
生理盐水中含氯化钠含量的测

氯化钠与钾、镁等电解质共同作用,维持人体内的电 解质平衡。
传递信息
氯离子在神经传导中起重要作用,参与动作电位的产 生和传递。
氯化钠在生理盐水中的存在形式
1
在生理盐水中,氯化钠以离子的形式存在,即钠 离子和氯离子。
2
生理盐水通常是指0.9%的氯化钠溶液,即每100 毫升水中含有0.9克氯化钠(相当于6滴)。
感谢您的观看
天平、容量瓶、滴定管、烧杯、吸管等。
制备生理盐水样品
取适量生理盐水,用吸管吸取并放入烧杯中备用。
准备标准氯化钠溶液
准确称取一定质量的氯化钠,溶解并稀释至一定浓度,作为标准溶 液。
实验操作流程
用天平称取一定质量的生理盐 水样品,记录数据。
将生理盐水样品转移至容量瓶 中,加入适量的标准氯化钠溶
液。
用滴定管滴加指示剂,观察颜 色变化,记录滴定终点时消耗 的标准氯化钠溶液的体积。
氯化钠的化学性质
氯化钠(NaCl)是食盐的主要 成分,属于离子化合物,由钠 离子(Na+)和氯离子(Cl-) 构成。
氯化钠在水中溶解度较高,易 溶于水,形成稳定的盐溶液。
氯化钠在常温下不易分解,但 在高温或电解条件下可发生化 学反应。
氯化钠的生理作用
维持渗透压
氯化钠是人体内渗透压的主要来源,通过调节细胞外 液的渗透压,维持体内水分平衡。
03
本研究为生理盐水中氯化钠含 量的测定提供了有效的方法, 为相关产品的质量控制和监管 提供了科学依据。
研究展望
01
进一步研究其他品牌生理盐水中氯化钠含量的差异,以全面 了解市场上的产品质量情况。
02
探索其他可能影响生理盐水质量的因素,如生产工艺、原材 料等,以提高产品的质量和稳定性。
氯化钠的含量测定(精)

氯化钠的含量测定
一、实验说明
利用氯化钠与硝酸银反应生成的氯化银胶态沉淀的吸附作用,以荧光黄为指示剂,进行测定。
每1 mL硝酸银滴定液(0.1 mol·L-1)相当于5.844 mg的NaCl。
《中国兽药典》规定,按干燥品计算,含NaCl不得少于99.5%。
通过本实验的训练,熟练掌握滴定操作技术,加深对吸附指示剂的变色原理的理解。
二、仪器与试剂
(1)仪器
电子天平,棕色酸式滴定管(50 mL),量筒(50 mL、10 mL),锥形瓶(250 mL)。
(2)试剂
氯化钠,2%糊精溶液,硝酸银滴定液(0.1 mol·L-1),荧光黄指示液。
三、测定方法
取本品约0.12 g,精密称定,加水50 mL溶解后,加2%糊精溶液5 mL与荧光黄指示液5~8滴,用硝酸银滴定液(0.1 mol·L-1)滴定,即得。
四、数据记录与报告
样品名称样品批号
天平型号仪器编号
检验依据:
滴定液名称:滴定液浓度:
测定次数 1 2 3 供试品质量,g
滴定液初读数,mL
滴定液终读数,mL
滴定液消耗体积,mL
供试品含量,%
含量平均值,%
相对平均偏差,%
含量计算公式:
标准规定:
结果判断:
检验人:复核人:
五、注意事项
自来水中的Cl- 对测定有影响,所用仪器必须用蒸馏水洗涤。
氯化钠含量测定

氯化钠含量测定一、检测项目概述氯化钠,无机离子化合物,化学式NaCl,是一种无色、透明的立方形结晶或白色结晶性粉末,在水中易溶,在乙醇中几乎不溶,稳定性较好,在空气中微有潮解性。
我们日常使用的调味料食盐其主要成分就是氯化钠,除调味料外氯化钠还可用于制造纯碱烧碱及其他化工产品,医药领域氯化钠对维持正常的血液和细胞外液的容量和渗透压起着非常重要的作用,可作为电解质一种补充药物,临床上0.9%的氯化钠溶液称为生理盐水,用来溶解药物,用静脉输液的方式将药物输入人体。
二、检测方法参考2020版药典中采用银量法测定氯化钠含量,取本品约0.12g,精密称定,加水50ml溶解后,加2%糊精溶液5ml、2.5%硼砂溶液2ml 与荧光黄指示液5~8滴,用硝酸银滴定液(0.1mol/L)滴定。
每1ml 硝酸银滴定液(0.1mol/L)相当于5.844mg的NaCl。
实验室今天另外为大家介绍下另一种,通过离子色谱检测氢化钠含量的方法。
利用离子色谱以3.2mMNa2C03+1.0mMNaHCO3为淋洗液,以20~80mmol/LH2SO4为抑制液分析测定样液中的阴离子含量测定样品中的氯化钠的含量。
结果表明,氯化钠的检出限为0.01%,回收率达98%。
此方法操作快捷、准确度高、专属性更强,能够满足辅料中的氯化钠分析要求。
三、检测应用范围实验室可通过离子色谱(IC)、高效液相色谱(HPLC)、电位滴定等方法,精准的检测氯化钠的含量变化。
对化学试剂、无机盐中的氯化钠进行溶解度、碘化物、溴化物、硫酸盐、亚硫酸盐、磷酸盐、亚铁氰化物、铝盐、钡盐、钙盐、镁盐、钾盐、铁盐、砷盐、重金属等物化性质、成分检测、元素分析项目测试。
根据送样样品,依据药典及其他各行业标准,个性化定制检测服务,并提供分析测试报告。
四、实验室优势实验室拥有气相色谱、高分辨液质、液质三重四级杆、气质质、扫描电镜、透射电镜、核磁、二次离子质谱等多类专业检测设备仪器,遵照ISO17025和GMP等高标准进行管理,为生物医药、化工领域等领域伙伴产品生产过程中可能产生的杂质提供评估报告、方法开发、验证及样品检测等一系列完整的解决方案,工程师全程服务出现问题及时沟通。
