高二化学水的电离和溶液的酸碱性
水的电离和溶液的酸碱性典型例题及习题
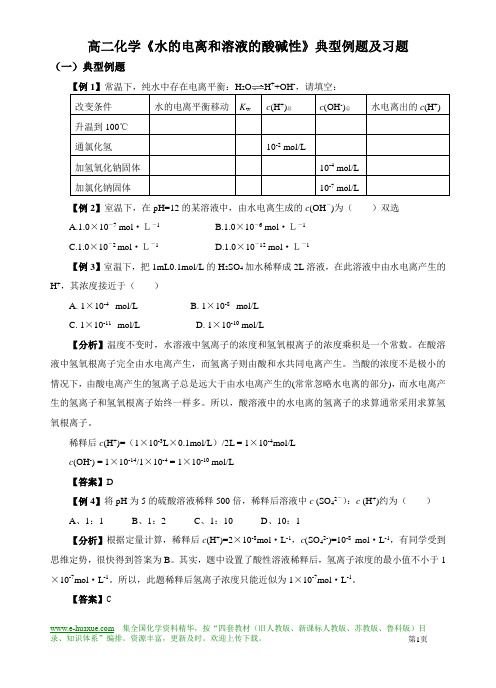
高二化学《水的电离和溶液的酸碱性》典型例题及习题(一)典型例题【例1】常温下,纯水中存在电离平衡:H+-,请填空:改变条件水的电离平衡移动K w c(H+)总c(OH-)总水电离出的c(H+) 升温到100℃通氯化氢10-2 mol/L加氢氧化钠固体10-4 mol/L加氯化钠固体10-7 mol/L【例2】室温下,在pH=12的某溶液中,由水电离生成的c(OH-)为()双选A.1.0×10-7 mol·L-1B.1.0×10-6 mol·L-1C.1.0×10-2 mol·L-1D.1.0×10-12 mol·L-1【例3】室温下,把1mL0.1mol/L的H2SO4加水稀释成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于()A. 1×10-4 mol/LB. 1×10-8 mol/LC. 1×10-11 mol/LD. 1×10-10 mol/L【分析】温度不变时,水溶液中氢离子的浓度和氢氧根离子的浓度乘积是一个常数。
在酸溶液中氢氧根离子完全由水电离产生,而氢离子则由酸和水共同电离产生。
当酸的浓度不是极小的情况下,由酸电离产生的氢离子总是远大于由水电离产生的(常常忽略水电离的部分),而水电离产生的氢离子和氢氧根离子始终一样多。
所以,酸溶液中的水电离的氢离子的求算通常采用求算氢氧根离子。
稀释后c(H+)=(1×10-3L×0.1mol/L)/2L = 1×10-4mol/Lc(OH-) = 1×10-14/1×10-4 = 1×10-10 mol/L【答案】D【例4】将pH为5的硫酸溶液稀释500倍,稀释后溶液中c (SO42-):c (H+)约为()A、1:1B、1:2C、1:10D、10:1【分析】根据定量计算,稀释后c(H+)=2×10-8mol·L-1,c(SO42-)=10-8mol·L-1,有同学受到思维定势,很快得到答案为B。
【优教通】高二人教版化学选修四教案设计:3-2-1《水的电离和溶液的酸碱性》

其次节水的电离和溶液的酸碱性第1课时水的电离和溶液的酸碱性●课标要求1.知道水的离子积常数。
2.初步把握pH测定的方法,知道溶液pH的调控在工农业生产和科学争辩中的重要应用。
●课标解读1.了解水的电离及水的离子积常数。
2.了解溶液的酸碱性与pH的意义。
●教学地位本课时介绍了水是一种弱电解质,在确定条件下水的离子积是常数。
了解测定溶液pH的方法。
利用pH,c(H +),c(OH-)等推断水溶液的酸碱性是本章的基础。
●新课导入建议追求健康长寿是人类共同的愿望。
人们首先要拥有健康,才有可能获得财宝、地位和幸福。
健康从哪里来呢?水是生命之源,假如没有水,就不行能有生命。
风靡日本、欧美等国的活性离子水是一种高品质的饮用水。
离子水比一般水分子团直径小,渗透作用快,有利于消退体内过多的自由基,能够延缓机体年轻,且对多种疾病有预防和挂念治疗的作用。
它的诞生,在全世界掀起了一场饮水领域的革命,善待生命,从水开头。
你知道水中有哪些粒子吗?【提示】水中有H2O、H+、OH-三种微粒。
●教学流程设计课前预习支配:(1)看教材P45~46,填写【课前自主导学】中的“学问1,水的电离”,并完成【思考沟通1】;(2)看教材P46~47页,填写【课前自主导学】中的“学问2,溶液的酸碱性与pH”,并完成【思考沟通2】。
⇒步骤1:导入新课并对本课时教材地位分析。
⇒步骤2:建议对【思考沟通1、2】多提问几个同学,使80%以上的同学都能把握该内容,以利于下一步对该重点学问的探究。
⇓步骤5:在老师指导下同学自主完成【变式训练1】和【当堂双基达标】中的1、4、5三题,验证同学对探究点的理解把握状况。
⇐步骤4:老师通过【例1】和教材P45~46页的讲解研析,对“探究1”的内容进行总结。
⇐步骤3:师生互动完成“探究1,影响水电离平衡的因素及水的离子积”可利用【问题导思】的设问由浅入深的进行,建议老师除【例1】外,再变换一下命题角度,可接受【老师备课资源】,以拓展同学的思路。
高二化学水的电离和溶液的酸碱性试题答案及解析

高二化学水的电离和溶液的酸碱性试题答案及解析1.常温下,柠檬酸水溶液的pH是3,食用醋的pH是2,可乐的pH是6,三种物质的溶液中c(OH-)分别是()A.1×10-11 mol·L-1,1×10-12 mol·L-1,1×10-8 mol·L-1B.1×10-11 mol·L-1,1×10-8 mol·L-1,1×10-12 mol·L-1C.2×10-11 mol·L-1,1×10-10 mol·L-1,1×10-8 mol·L-1D.1×10-8 mol·L-1,1×10-11 mol·L-1,1×10-12 mol·L-1【答案】A=c(H+)·c(OH-)=1.0×10-14。
【解析】常温下,KWpH=3时,c(OH-)==1.0×10-11 mol·L-1,pH=2时,c(OH-)==1.0×10-12 mol·L-1,pH=6时,c(OH-)==1.0×10-8 mol·L-1。
【考点】pH的计算2.下列说法正确的是A.将25℃纯水加热至95℃时,增大B.将pH=11的Na2CO3溶液加水稀释,增大C.室温下,pH=a的盐酸与pH=b的氨水等体积混合后pH=7,则a+b="14"D.0.1mol·L-酸HA与0.1mol·L-NaOH溶液等体积混合后pH>7,则【答案】A【解析】、A、水的电离是吸热的过程,温度升高,水离子积常数增大,氢离子浓度和氢氧根离子浓度随着增大,而一定温度下存在,由氢离子浓度增大可知增大,所以A正确。B.溶液稀释过程,氢氧根离子浓度、碳酸根离子浓度减小,依据一定温度下,离子积常数不变可知,氢离子浓度增大,因此B选项错误。C选项室温下,pH=a的盐酸与pH=b的氨水等体积混合,若a+b=14,平衡状态下氢离子浓度和氢氧根离子浓度相同,反应后,一水合氨继续电离生成氢氧根离子,溶液显碱性,pH=7的溶液中氯离子浓度等于铵根离子浓度,因此C选项错误。D0.1mol·L-酸HA与0.1mol·L-NaOH溶液等体积混合,恰好反应生成醋酸钠,依据物料守恒得到所以D选项错误。【考点】考查了水电离平衡的相关知识点。3.常温下,pH = 12的NaOH溶液与pH =1的HC1溶液按一定比例混合,所得溶液pH =2,则NaOH溶液与HC1溶液的体积比为A.9:2B.2:9C.1:9D.10:1【答案】A【解析】常温下,pH = 12的NaOH溶液与pH =1的HC1溶液按一定比例混合,所得溶液pH=2,则酸过量,设HCl、NaOH的体积分别是V(HCl)、V(NaOH),则[V(HCl)×0.1-V(NaOH)×0.01]÷[V(HCl)+V(NaOH)]=0.01,解得V(NaOH):V(HCl)=9::2,因此选项是A。
水的电离和溶液的酸碱性 (第3课时 酸碱中和滴定(一))高二化学(人教版选修4)
无 淀粉
无色→浅紫红色 无色→蓝色
3.(2022·江西·赣州市第三中学期中)下列实验操作正确的是( D ) A.用图1装置进行KMnO4溶液滴定未知浓度的FeSO4溶液实验
B.如图2所示,记录滴定终点读数为19.90mL C.图3为酸式滴定管,使 用后需洗涤干净,并轻轻放入烘箱烘干 D.碱式滴定管排气泡的操作方法 如图4,然后轻轻挤压玻璃球使尖嘴部分充满碱液
甲基橙 3.1~4.4 红、Байду номын сангаас、黄
石蕊 5.0~8.0 红、紫、蓝
酚酞 8.2~10.0 无色、浅红、红
指示剂的选择和滴定终点的判断
酚酞 强酸滴定强碱
甲基橙
红→无色 黄→橙
酚酞 强碱滴定强酸
无色→粉红
甲基橙 红→橙
强酸滴定弱碱 甲基橙 黄→橙
强碱滴定弱酸 酚酞
无色→粉红
【小试牛刀】(双选)用已知浓度的NaOH溶液滴定某H2SO4溶液的浓度,
2.(2021·鄂尔多斯市第一中学高二月考)下列滴定中,指示剂的选择或滴定 终点颜色变化有错误的是( B )
选项 滴定管中的溶液 锥形瓶中的溶液 指示剂 滴定终点颜色变化
A
NaOH溶液
CH3COOH溶液 酚酞
无色→浅红色
B
HCl溶液
氨水
酚酞
浅红色→无色
C 酸性KMnO4溶液 K2SO3溶液
D
碘水
亚硫酸溶液
【小试牛刀】(2022·湖北·高二期中)某学生用量程为25mL的酸式滴定管量 取0.1mol•L-1的盐酸,开始时俯视液面,读数为1.00mL,取出部分溶液后,平视
液面,读数为13.00mL,该同学在操作中实际取出的液体体积( B )
A.大于12.00mL
水的电离和溶液的酸碱性

高二化学资料(九)强化训练:水的电离和溶液的酸碱性一、选择题1、常温下,某溶液中由水电离的c(H+)=1×10-13mol·L-1,该溶液可能是①二氧化硫水溶液②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液A.①④B.①②C.②③D.③④2、(双选)常温下,某溶液中,由水电离出的c(H+)=1.0×10-11mol/L,该溶液pH可能为A.11B.3C.8D.73、在水电离出的c(H+)=10-14mol/L的溶液中,一定能大量共存的A.K+、Na+、HCO3-、Cl-B.K+、Br+、AlO2-、Cl-C.SO42-、Na+、NO3-、Cl-D.SO42-、NH4+、Al3+、Cl-4、(双选)向纯水中加入少量的KHSO4固体(温度不变),则溶液的()A、pH值升高B、C(H+)和C(OH-)的乘积增大C、酸性增强D、OH-离子浓度减小5、100℃时,K W=1×10-12,对纯水的叙述正确的是()A、pH=6显弱酸性B、C(H+)=10-6mol/L,溶液为中性C、K W是常温时的10-2倍D、温度不变冲稀10倍pH=76、(双选)100℃时,K w=1.0×10-12,若100℃某溶液中的c(H+)=1.0×10-7mol/L,则该溶液A.呈中性B.呈碱性C.呈酸性D.c(OH-)/ c(H+)=10072、pH相同,物质的量浓度最大的酸是A.HCl B.H NO3C.H2SO4D.CH3COOH8、体积相同、pH相同的盐酸和醋酸,与碱中和时消耗的量A.相同B.盐酸多C.醋酸多D.无法比较9、(双选)pH=2的强酸溶液,加水稀释,若溶液体积扩大10倍,则C(H+)或C(OH-)的变化()A、C(H+)和C(OH-)都减少B、C(H+)增大C、C(OH-)增大D、C(H+)减小10、对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是A.加入适量的氯化铵晶体后,两溶液的pH均碱小B.温度下降10o C,两溶液的pH均不变C.分别加水稀释10倍,两溶液的pH仍相等D.用盐酸中和,消耗的盐酸体积相同11、下列叙述正确的是()A.95℃纯水的pH<7,说明加热可导致水呈酸性B.pH=3的醋酸溶液,稀释至10倍后pH=4C.0.2mol/L的盐酸,与等体积水混合后pH=1D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7....的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是A.a、b、c三点溶液的pH:c<a<bB.a、b、c三点醋酸的电离程度:a<b<cC.用湿润的pH试纸测量a处溶液的pH,测量结果偏小D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b13、某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等四种阴离子。
高二化学课件第3章第2节水的电离和溶液的PH

小结 3、影响水的电离平衡的因素
影响 因素
水的电离平衡移动 影响结果
方向 原因
c(H+) c(OH-) c(H+)与 c(OH-) KW 变化 变化 的关系
温 升温 右移 水的电离 增大 增大 增大 c(H+)=c(OH-)
度 降温 左移 过程吸热 减小 减小 减小 c(H+)=c(OH-)
加酸
左移 增大了 c(H+)
答:c(H+)来源于酸电离和水电离,且c(H+)酸≫c(H+)水 ,c(H+)水可以 忽略;c(OH-)来源于水的电离,且电离程度很小。由水电离出的
c(H+)与c(OH-)仍然相等;KW=[c(H+)酸+c(H+)水]·c(OH-)水≈c(H+)酸
·c(OH-)水。
1.常温下,0.1 mol·L-1 的 NaOH 溶液中由水电离出的 OH-的
4. 任何水溶液中都有c(H+)=c(OH-)。 × 5. c(H+)等于10-6mol/L的溶液一定呈现酸性。×
6. 对水升高温度电离程度增大,酸性增强。×
7.温度一定时,水的电离常数与水的离子积常数 相等。
×
典例(双选)下列关于溶液酸碱性的说法正确的是 ( AC)
A.常温下,pH=7的溶液呈中性 B.中性溶液中一定有c(H+)=1.0×10-7 mol·L-1 C.c(H+)=c(OH-)的溶液呈中性 D.在100 ℃时,纯水的pH<7,因此呈酸性
KW=
c(H+)·c(OH-)
,25 ℃时,KW=1.0×10-14。
分析表格中的数据,有何规律,得出什么结论?并解释之。
人教版高二化学 水的电离和溶液的pH(第二课时)

c(H+)=
n(H+)
=
V(混合液)
0.200 0 mol/L×0.02 mL×10-3 L/mL (20.00+20.02) mL×10-3 L/mL
≈ 0.200 0 mol/L×0.02 mL×10-3 L/mL 40 mL×10-3 L/mL
=1×10-4 mol/L
pH=−lgc(H+)=−lg10-4 =4
pH
10
7
4
12
误差
-0.1% 0
+0.1%
10
8
反应终点
突变范围
6
4
2
pH
0
10
20
30
40
V[HCl(aq)]/mL
指示剂选择原则:在突变范围内指示剂有明显的颜色变化。 石蕊的紫色和蓝色差别不够明显,不用作指示剂。
酚酞 石蕊 甲基橙
0.100 0 mol/L 盐酸
几种常用指示剂的变色范围
25.00 mL 待测NaOH溶液
=1×10-4 mol/L
c(OH-)=1×10-4 mol/L
常温下:c(H+)= c(KOWH-)=
1×10-14 1×10-4
=1×10-10 mol/L
pH=−lgc(H+)=−lg10-10 =10
(3)多加入半滴HCl溶液,即V[HCl(aq)]=20.02 mL时
酸过量:c(H+)→pH
最小分刻度:0.1 mL 可估读到 0.01 mL
二、主要仪器
碱式滴定管
酸式滴定管 滴定管夹 铁架台 锥形瓶
﹡标识 标有量程、使用温度、刻度(“0”刻度 在上方,越往下读数越大)
第3章第2节水的电离和溶液的酸碱性

2011-2012学年高二化学选修4(人教版)同步练习第三章第二节水的电离和溶液的酸碱性一. 教学内容:水的电离和溶液的酸碱性二.重点、难点:1. 本节的重点是水的离子积,氢离子浓度、pH与溶液酸碱性的关系2. 本节的难点是水的离子积,相关溶液pH的简单计算三. 具体内容:(一)水的电离1. 水的电离2. 水的电离水准3. 电离平衡常数4. 水的离子积5. 需注意的6. 影响水的电离平衡的因素(二)溶液的酸碱性与pH1. Kw在电解质溶液中的存有2. 溶液的酸碱性与c(H+)、c(OH-)的关系3. 溶液的酸、碱性与pH的关系4. 溶液酸碱性的表示方法5. pH的测量(三)pH的应用1. 医疗上2. 生活上3. 环保领域中4. 农业生产中5. 科学实验和工业生产中(四)酸碱质子理论A. 溶液pH的计算方法B. 实验测定酸碱滴定曲线1. 实验2. 酸碱指示剂在中和滴定中的应用【典型例题】[例1] 将pH=4的酸溶液与pH=10的NaOH溶液等体积混合后,溶液的pH可能是()A. 等于7B. 大于7C. 小于7D. 无法确定答案:AC解析:考虑弱电解质电离的特点和pH的计算。
[例2] 今有HA、H2B、H3C三种弱酸,根据强酸制弱酸的反应规律,它们之间发生以下反应:HA+HC2-(少量)=A-+H2C-;H2B(少量)+2A-=B2-+2HA;H2B(少量)+ H2C-=HB-+H3C,回答以下问题:(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是____;(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最容易结合质子(H+)的是_____,最难结合质子的是_____;(3)完成以下反应的离子方程式①H3C+OH-(过量)_______________;②HA(过量)+C3-________________。
答案:(1)H2B;(2)C3-;HB-;(3)H3C+3OH-=C3-+3H2O;2HA+C3-=2A-+H2C-解析:掌握酸碱质子理论。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
w66利来
[单选]外阴鳞状上皮增生的主要组织病理变化是()A.表皮层角化不全B.表皮层角化过度C.表皮层角化过度或角化不全D.表皮层角质栓塞E.棘层细胞规则增厚 [填空题]档板“三对应”的内容:()、()、()三者之间对应。 [单选]供电企业对于暂停用电不足15天的大工业电力客户,在计算其基本电费时,()基本电费。A.不计收B.不扣减C.按10天计算D.按实际天数扣减 [单选,A1型题]下述哪项不是羊水栓塞的抢救措施()A.抗循环衰竭B.抗呼吸衰竭C.纠正DIC及继发纤溶D.抗过敏治疗E.在第一产程时,应加强宫缩 [单选]()可以使一些不适宜通过劳动力市场调节实现就业的残疾人开辟特殊并且可行的就业领域。A.自主创业B.灵活就业C.集中就业D.按比例就业 [单选]A类突起路标与B类突起路标的性能区别是()。A.具备减速性能B.具备防滑性能C.具备视线诱导性能D.具备逆反射性能 [多选]关节镜手术的禁忌证有()。A.早中期类风湿关节炎B.有出血性疾患,出血倾向得到控制后C.关节局部皮肤感染D.类风湿关节炎或骨关节炎患者关节间隙严重狭窄者E.色素绒毛结节性滑膜炎病变侵犯软骨下骨者 [单选,A2型题,A1/A2型题]患者,女,72岁。咯痰清稀,喘息短气,自汗畏风,舌淡苔白,脉沉细。其证型是()A.饮停胸胁证B.寒痰阻肺证C.肺气虚证D.风寒束表证E.风寒犯肺证 [单选]混凝土的抗拉强度很低,一般只有抗压强度的()。A.1/2-1/4B.1/10-1/20C.1/5-1/10D.1/15-1/25 [单选]关于书刊印制阶段,下列说法错误的是()。A.印前阶段,这个阶段的主要工作进行图文信息设计等工作,并制出印版B.印刷阶段进行图文信息设计、图文输入、图文处理和图文输出等,并制出印版(或相应的电子文件)C.印刷阶段,这个阶段的主要工作是使用模拟或数字的图文载体,将 [单选,A2型题,A1/A2型题]以下哪项不是有机磷农药中毒的毒蕈碱样作用().A.肌肉强制性痉挛B.心血管活动受抑制C.瞳孔括约肌、睫状肌兴奋D.消化道、呼吸道腺体兴奋E.支气管、胃肠道平滑肌兴奋 [单选]常规神经传导速度检查要求皮肤温度为()A.26℃B.28℃C.34℃D.20℃E.无要求 [单选]锅炉分气缸的主要作用是()。A、储存蒸汽B、蒸汽的汽水分离C、分配蒸汽D、多台锅炉蒸汽并用 [单选]下列各项不属于地方行政立法主体的是()。A.省、自治区、直辖市的人民政府B.省、自治区、直辖市的人民代表大会C.国务院批准的较大的市的人民政府D.省、自治区人民政府所在地的市人民政府 [问答题,简答题]按照相关规定,核电厂应该设置哪几道安全屏障? [判断题]高层医院的液氧储罐总容量不超过3m3时,储罐间可一面贴邻所属高层建筑外墙建造,但应采用防火墙隔开,并应设直通室外的出口。()A.正确B.错误 [单选,A4型题,A3/A4型题]男,55岁,间歇上腹不适5年,餐后加重,嗳气。胃液分析结果:基础胃酸分泌量(BAO)为0(正常值1~2mmol/h),最大胃酸分泌量(MAO)为5mmol/h(正常值17~23mmol/h),壁细胞总数(PCM)为2.5×10个。诊断最可能的疾病是()A.胃溃疡B.十二指肠球部溃疡C.慢性 [单选]周某于2011年4月11日进入甲公司就职,经周某要求,公司于2012年4月11日才与其签订劳动合同。已知周某每月工资2000元,已按时足额领取。甲公司应向周某支付工资补偿的金额是()元。A.0B.2000C.22000D.24000 [问答题,案例分析题]南淮公司为上市公司,有关股份支付资料如下。(1)2×11年12月31日经董事会批准,南淮公司实施股权激励计划,其主要内容如下:公司向其100名管理人员每人授予10万份股票期权,这些人员从2×12年1月1日起必须在该公司连续服务3年,服务期满时才能以每股3元购买 [单选]()是指为改善车辆的技术性能或延长车辆使用寿命,改变原车辆零部件或总成的工作。A.车辆技术改造B.车辆大修C.车辆小修D.车辆改装 [单选]丙烯塔回流泵全坏,操作调整中最应该注意()。A、塔顶压力B、塔底液面C、回流罐液面D、塔底温度 [单选,A1型题]关于慢性肾小球肾炎的特征,描述正确的是()A.多数是由急性肾炎发展所致B.病理类型多为新月体肾炎C.以不同程度蛋白尿、血尿、高血压、水肿为基本临床表现,最终发展为肾衰竭D.尿检异常达1年以上并出现肾功能损害才考虑此病E.对于蛋白尿患者血压控制的理想水平是140 [单选,A1型题]预防哺乳期乳腺炎,下列不恰当的是()A.积极哺乳,避免淤乳B.预防性应用抗生素C.纠正乳头内陷D.保护乳头皮肤,避免皮肤破损E.经常清洗乳头 [单选,A1型题]诱导免疫耐受的方法是()A.切除成年动物的胸腺B.切除成年动物的脾脏C.注射佐剂D.注射极大量AgE.注射有丝分裂素和Ag [单选]《洛神赋图》是出自哪位画家之手()。A、吴道子B、顾恺之C、谢赫D、李公麟 [单选]脊柱结核的好发部位是()A.颈椎B.胸椎C.腰椎D.胸腰交界区E.骶、尾椎 [单选,A1型题]医务人员在医疗活动中发生医疗事故争议,应当立即向()A.所在科室报告B.所在医院医务部门报告C.所在医疗机构医疗质量监控部门报告D.所在医疗机构的主管负责人报告E.当地卫生行政机关报告 [单选,A1型题]涌吐又兼能截疟,为治疟之要药是()A.青蒿B.槟榔C.常山D.鸦胆子E.胆矾 [单选]为使试样处于一种单向和均匀的应力状态下,拉伸试验规定在3个外在条件下进行,这三个条件是。()A.常温、常压、常湿B.常温、等速、常湿C.常温、静载、轴向D.常温、动载、轴向 [单选,A2型题,A1/A2型题]联苯胺引起的肿瘤为我国法定职业性肿瘤的是()。A.肺癌B.皮肤癌C.肝血管瘤D.膀胱癌E.白血病 [单选,A1型题]不属于医学心理学相关学科的是()。A.健康心理学B.变态心理学C.神经心理学D.药物心理学E.教育心理学 [多选]安全生产保证计划中关于安全验收应明确的要求有:()。A.施工作业前,对安全施工作业条件进行验收B.物资、设施、设备和检测器具在投入使用前进行使用验收C.对危险性较大的分部分项工程施工中可能给下道工序造成影响的节点进行过程验收D.建立必要的安全验收标识,未经安全验 [单选]企业应建立的主要目标有销售定额、毛利额、访问户数、新客户数、()和贷款回收率等。A、销售量B、市场份额C、访问费用D、产品定位 [问答题,简答题]人工呼吸概述 [单选]英版海图图式“Cy”表示()。A.贝壳B.黏土C.珊瑚D.泥 [单选,A2型题,A1/A2型题]关于血友病患者关节腔出血的护理,不妥的是()A.抬高患肢B.固定患肢C.冷敷关节D.出血停止后可干农活E.遵医嘱输新鲜血 [单选]车辆心盘竹质垫板除可与钢质垫板叠装外,需单层使用时厚度不小于()。A.10mmB.20mmC.30mmD.40mm [单选]下列哪一项不是过期妊娠的超声表现?A.胎盘老化B.胎儿双顶径小于同孕期胎儿C.胎儿皮下脂肪变薄D.胎儿股骨长度正常高于正常胎儿增长值E.胎儿脐带动脉S/D增多 [单选]一般来说,寻求与价格之间是()。A.正相关关系B.负相关题]透明大体标本的制作,标本存放的最好材料是()。A.有机玻璃标本缸B.玻璃标本缸C.不锈钢标本缸D.树脂标本缸E.塑料标本缸
