精馏实验数据处理实例
化工原理精馏实验报告

化工原理精馏实验报告
实验目的:
通过对精馏实验的进行,掌握精馏原理和操作技术,了解不同物质的沸点差异,进而提高分离纯化的能力。
实验仪器和试剂:
1. 精馏设备,包括加热器、冷凝器、接收烧瓶等。
2. 乙醇-水混合液,作为实验分离物质。
实验步骤:
1. 将乙醇-水混合液倒入精馏烧瓶中。
2. 打开加热器,开始升温。
3. 观察冷凝器中的液体,待观察到有液体滴落时,开始收集液体。
4. 分别收集不同温度下的液体,记录温度和收集时间。
实验结果:
经过实验,我们成功地将乙醇和水分离出来,得到了不同温度下的两种液体。
根据实验数据,我们可以得出乙醇和水的沸点分别为78.5℃和100℃。
实验分析:
根据实验结果,我们可以得出乙醇和水的沸点存在明显差异,这为精馏分离提
供了基础。
在实际工业生产中,可以根据不同物质的沸点差异,采用精馏技术进行纯化和提纯。
此外,实验中的操作技术和设备选择也对实验结果产生了重要影响,操作不当或设备选择不当都会影响分离效果。
实验总结:
通过本次实验,我们深入了解了精馏原理和操作技术,并且成功地将乙醇和水进行了分离。
实验过程中,我们也发现了一些问题和不足之处,需要在以后的实验中加以改进和完善。
精馏作为一种重要的分离技术,在化工生产中具有广泛的应用前景。
结语:
精馏实验的顺利进行,为我们提供了宝贵的实践经验和理论基础,对于化工原理的学习和应用具有重要意义。
希望通过不断的实验探索和学习,能够更好地掌握化工原理,为未来的工程实践和科研工作打下坚实的基础。
精馏塔性能测定实验——数据处理
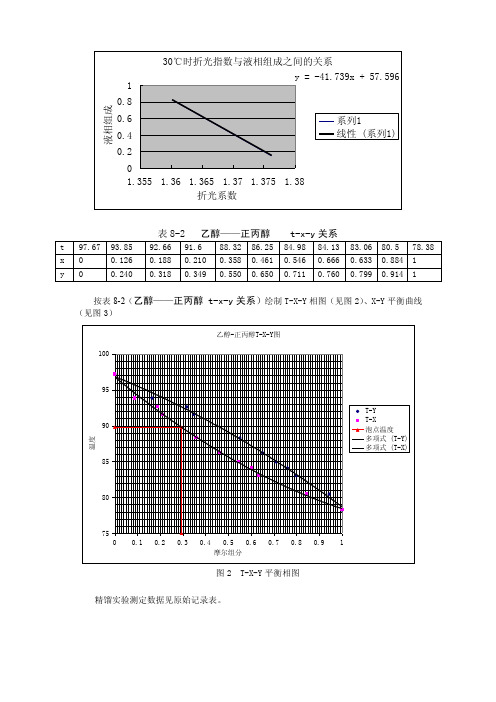
按表8-2(乙醇——正丙醇 t-x-y关系)绘制T-X-Y相图(见图2)、X-Y平衡曲线(见图3)图2 T-X-Y平衡相图精馏实验测定数据见原始记录表。
0.00.20.40.60.81.0y计算实例:1、 求乙醇的质量分率及摩尔分率:以全回流塔顶组成为例 W=57.596-41.739×1.3599=0.83708701.0608370.01468370.0468370.0=-+=A X2、计算精馏塔在全回流条件下,稳定操作后的全塔理论板数和总板效率 总板效率E T 按下式计算:其中N P 为实际塔板数,N T 为塔的理论板数。
%100⨯=PTT N N E图解法求理论板数:根据测值已知: x D =0.8701, x w =0.0655 精馏段操作方程:11+++=R X X R RY D , 对角线方程y=x ,全回流时R=∞,没有提馏段,操作线与对角线重合,理论板数为最少N=N min , N min ,可在x-y 图上的平衡线与对角线上直接图解求得。
N T =5.7(见图3)总板效率E r =5.7/7*100%=81.4%30.00.20.40.60.81.0YX4、计算精馏塔回流比R=4,稳定操作后的全塔理论塔板数和总板效率 根据测值已知:x D =0.8576, x w =0.1990, x F =0.2850精馏段操作方程:17152.08.011+=+++=X R X X R RY D 对角线方程y=x 。
操作线与对角线的交点:x= x D ,y= x D , 见图中a 点。
截距为17152.01=+R XD ,绘制精馏段操作线a-b 。
进料方程:9194.0226.4131.12850.0131.131.111-=---=---=X X q X X q q Y F (通过查表计算得q=1.31。
见后附q 值的计算)联立进料方程与精馏段操作方程,求得交点d(0.3184,0.4263), 进料方程与对角线的交点e (x= x F ,y= x F )) 。
水与乙醇精馏实验 数据处理示范

y = q x − xF 加料线(q 线)方程可表示为: q − 1 q −1
其中
q = 1+ c pF (tS − tF )
rF
式中, q ----进料热状况参数; rF ----进料液组成下的汽化潜热,kJ/kmol;(参照附表 4) tS ----进料液的泡点温度,℃; tf ----进料液温度,℃; cpF ----进料液在平均温度(tS + tf)/2 下的比热容,kJ/(kmol℃);(参
塔釜温度 tw/℃ 26.9 32.3 38.4 45.7 51.9 58.3 64.8 70.7 76.3 81.3 86 88.1 89 89.3 89.7 90 90.2 90.3 90.3 90.3 90.4 90.4 90.4 90.4
回流温度 tL/℃
25.7 25.7 25.7 25.7 25.7 25.7 25.6 25.7 25.7 25.7 25.6 25.7 25.6 25.7 25.7 25.8 31.8 40.3 46.7 48.7 49.9 50.7 51.2 51.1
塔顶温度 tD/℃
26.5 26.5 26.5 26.5 26.5 26.5 26.5 26.5 26.5 26.5 26.5 26.5 26.5 26.5 76.7 79.1 79.2 79.2 79.2 79.2 79.2 79.1 79.1 79.1
图 1 塔顶温度等参数随时间的变化曲线
5
由图 1 可知刚开始加热的前十五分钟时,塔釜温度逐步升高,回流温度和塔 顶温度基本不变,到一定时间(20 分钟左右)后,塔釜温度趋于稳定,塔顶 温度急剧上升到一定温度,回流温度逐步升高,但塔釜温度始终高于回流温 度和塔顶温度。
水与乙醇精馏实验 数据处理示范
精馏实验-数据处理

精馏实验-数据处理精馏实验通过热解混合物的物质来分离单独的化合物。
其原理在于分离液体的不同挥发性,通过逐步升高温度收集不同温度下的馏分,每个馏分代表了物质在该温度下的挥发性,可以获得天然挥发物、精油和其他相关物质。
此实验主要涉及以下步骤:1.收集所有馏分精馏实验的目的是分离不同熔点和沸点的化合物,在实验中所有馏分的容积和重量必须记录下来。
使用电子天平记录重量是一种最简单、最准确的方法。
除了记录重量外,还应尽可能精确地记录馏分容积,如使用天平量取每个馏分的容积,或使用标有刻度的烧瓶测量。
2.摄氏温度计的使用在记录馏分温度时,应使用有准确度的温度计。
常规摄氏温度计可为1度摄氏度,数字温度计可为0.1度摄氏度。
在实验期间,温度计应完全降低到液体表面,以获得准确的水平温度。
3.计算出各个馏分的重量百分比通过记录馏分容积和重量,可以使用以下公式计算出各馏分的重量百分比:重量百分比 = 馏分重量÷ 初始混合物重量×1004.绘制挥发度曲线挥发度曲线显示了每种化合物的挥发性和容易性。
这可以通过在横轴上绘制温度,而在纵轴上绘制挥发性浓度来实现。
每个馏分的挥发度均由各馏分的重量百分比组成。
5.计算每个馏分的平均沸点通过记录每个馏分的温度,可以确定其沸点范围。
计算每个馏分的平均沸点的最简单方法是将其上限和下限平均。
例如,如果一个馏分的下限是80度摄氏度,上限是85度摄氏度,那么它的平均沸点是(85 + 80)÷ 2 = 82.5度摄氏度。
6.计算出混合物的回收率馏分回收率是指在经过精馏过程后,成功收集到单一化合物的百分比。
它可以通过将各馏分的重量百分比相加并将其与初始混合物重量进行比较来计算。
7.计算出馏分的累积体积累积体积是指馏分的总容积,可以通过将各个馏分的容积逐个相加来计算。
此外,还可以用累积体积绘制曲线,以显示随着馏分收集的进行,挥发性的变化。
在精馏实验中,不仅需要记录精确的重量和容积,而且还应将它们用于计算收益率、平均温度和累积体积。
精馏实验报告数据处理

精馏实验报告数据处理引言精馏是一种常用的分离和纯化液体混合物的方法。
在精馏实验中,我们通过加热混合物,使其沸腾并产生蒸汽,然后通过冷凝蒸汽将其重新液化,并收集纯净的组分。
在实验过程中,我们需要进行数据处理来评估实验结果的准确性和可靠性。
本报告旨在详细介绍精馏实验报告中的数据处理步骤和方法。
数据处理步骤数据收集在进行精馏实验过程中,我们需要收集以下数据: 1. 初始混合物的成分及其摩尔分数; 2. 实验过程中的温度随时间的变化; 3. 实验过程中蒸汽的体积变化。
数据整理在收集完实验数据后,我们需要对数据进行整理和准备,以便进行后续的分析和处理。
首先,我们将数据按照不同的实验条件进行分组,并针对每一组数据进行分析。
其次,我们需要将温度和时间的数据进行配对,以得到温度随时间的变化曲线。
最后,我们将蒸汽体积和时间的数据进行配对,以得到蒸汽体积随时间的变化曲线。
数据分析在完成数据整理后,我们可以进行数据分析来评估实验结果的准确性和可靠性。
以下是常用的数据分析方法: 1. 温度-时间曲线分析:通过观察温度随时间的变化曲线,我们可以确定实验中的沸点和凝点,并判断实验过程中是否发生了相变。
2. 蒸汽体积-时间曲线分析:通过观察蒸汽体积随时间的变化曲线,我们可以评估精馏实验的效果,并计算出蒸馏速率。
数据处理在完成数据分析后,我们可以进行数据处理来得到最终的实验结果。
以下是常用的数据处理方法: 1. 计算混合物的摩尔分数:根据初始混合物的成分及其摩尔分数,我们可以计算出分馏后所得到的纯净组分的摩尔分数。
2. 计算纯度:通过观察温度-时间曲线和蒸汽体积-时间曲线,我们可以评估实验结果的纯度,并计算出纯度的数值。
结论通过对精馏实验报告的数据进行处理,我们可以得出实验结果的准确性和可靠性。
通过温度-时间曲线和蒸汽体积-时间曲线的分析,我们可以评估实验的效果和纯度。
通过计算混合物的摩尔分数和纯度,我们可以得到最终的实验结果。
精馏实验数据处理

长春工业大学化工原理精馏试验数据处理化学工程学院高分子材料与工程专业班自己做的,如有错误,敬请谅解,(这个是B5纸)excel作图五.实验数据与处理(1)原始数据(2)计算过程由书后的附录中查得乙醇-水常压下的气液平衡数据如下:序号X Y1 0 02 0.8 7.83 1.6 16.34 4.2 29.55 6.9 38.16 11 45.47 13.8 48.78 16.8 51.39 20 53.110 24.3 55.211 29.8 57.412 34.2 59.113 40 61.414 44.3 6315 48.9 64.716 54 66.917 62.5 71.118 70.6 75.819 72.36 76.9320 74.15 7821 76 79.322 77.88 80.4223 79.8 81.824 81.88 83.2625 83.87 84.2626 85.97 86.427 89.4 89.428 95 94.229 100 1001、全回流部分 已知塔釜组分水的质量分数 ω1=97.7442% 乙醇的质量分数 ω2=2.2558% 则轻组分乙醇的摩尔分数2.2558460.008952.25584697.744218WX ==+ 同理可得6.9249460.84026.92494693.075118D X ==+全回流操作线方程为y n+1=x n在excel 中用乙醇-水常压下的气液平衡数据画出相平衡曲线,并画出全回流的操作线,然后用图解法求出理论塔板数;图形如下;从以上图中可看出全回流的理论塔板数为9-1=8 2、 部分回流 分别求出X D ,X W ,X f91.4921460.808291.49218.50794618D X ==+ 1.9126460.00757298.0874 1.91261846w X ==+13.0540460.0555013.054086.94604618f X ==+pm C m r q 的计算11()+C ()Pm p p C C w K =⨯⨯醇水(1-w )=(2.4613.0540+4.286.9460)/100=3.9729kJ/(kg )11()()(1)=(108013.0540236086.946)/1002192.9088/m r r w r w kJ kg=+-⨯+⨯=醇水() 3.9729(78.522.5)11 1.1010932192.9088pm b m C t t q r -⨯-=+=+=实验过程中保持回流比R=2q 线方程为 y=11f x qx q q --- (1)精馏段操作线方程 y n+1=11D n x Rx R R +++ (2) (1)(2)式联立得 (1)(1)(1)(1)D f q x q x R x q R R q -++=+--0.8082(1.101093-1)+0.05550(2+1)0.080041.101093(21)2(1.1010931)q x ⨯⨯==⨯+-⨯-1.1010930.055500.080040.32281.1010931 1.1010931q y =⨯-=--在excel 中用乙醇-水常压下的气液平衡数据画出相平衡曲线过(,D D x x )(,q q x y )两点作出精馏段操作线 过(,w w x x )(,q q x y )两点作出提馏段操作线 过(,f f x x )(,q q x y )两点作出q 线 图形如下:由图中可以看出理论板数13-1=12 精馏段操作线方程:y = 0.6666x + 0.26942 提馏段操作线方程:y = 4.3499x – 0.q 线方程:y = 10.894x – 0.54916。
实验八精馏实验

实验八精馏实验
【数据记录与处理】
表1 数据记录与处理结果表
实际塔板数: 22 物系:乙醇-水塔低温度:85℃塔顶温度:70 ℃
回流比R ∞
溶液组成进料组成Xf 塔顶组成Xd 塔釜组成Xw 酒精度259516质量分率W%20.48592.48512.97
摩尔分率X%9.2582.85 5.50
理论板数n 6
总板效率27.27%
图解法计算理论塔板数:
1,作y-x相图1(利用附表乙醇-水的液气平衡数据);2,作操作线,由于回流比为∞,所以操作线为相图对角线,过(Xd,0)作垂线交对角线于a点。
如图1;
3,作进料线,过(Xf,0)作垂线交对角线与b点,如图1;
4,提馏段操作线,过(Xw,0)坐垂线交对角线与c点,如图1;
5,从a点开始,在平衡线与操作线之间水平线和铅垂线构成的阶梯,直到c点为止,阶梯数减去1为NT值。
图1 图解法求理论塔板数。
精馏实验数据记录与处理

【数据记录与处理】
进料温度T F=14℃
①由书P150附录六表2:乙醇-正丙醇折射率与其液相组成之间的关系(35℃),作下图:
②将折射率转换计算为乙醇的液相摩尔分数x A,得下表:
③根据附录六表3:乙醇-正丙醇气液相平衡数据作图:
X=0.2587时,得进料泡点温度T b=90.75℃
④根据附录六表1:乙醇、正丙醇气化热和定压比热容数据,确定平均温度(T F+T b)/2=52.4℃下,
⑤回流比R=4,得精馏段操作线方程:y=0.8x+0.1646,求得q线与精馏线交点(0.2860,0.3934),再由各点(x D,x D),(x W,x W),(x F,x F),可分别作出全回流和部分回流下y—x图。
由图可知:
全回流情况下全塔理论板数:N T=6-1=5,实际塔板数N P=7
总板效率E O=(N T/N P)X100%=(5/7)X100%=71.43%
回流比R=4,部分回流下全塔理论板数:N T=7-1=6,实际塔板数N P=7
总板效率E O=(NT/NP)X100%=(6/7)X100%=85.71%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附实验数据处理过程及结果(以下数据仅供参考) :
表四 精馏实验原始数据及处理结果
实验装置:1
实际塔板数:10
实验物系:乙醇-正丙醇
折光仪分析温度:30℃
全回流:R = ∞ 部分回流:R =4 进料量:3 L/h 进料温度:21.7℃ 泡点温度:91℃
塔顶组成 塔釜组成
塔顶组成 塔釜组成 进料组成 折光指数n 1.3610 1.3770 1.3620 1.3775 1.3765 质量分率W 0.847 0.166 0.805 0.144 0.187 摩尔分率 X 0.879
0.206
0.843
0.180 0.231
理论板数 3.6179 6.1187 总板效率
36.18%
61.19%
实验数据处理过程举例: 1.全回流:
塔顶样品折光指数n D =1.3610
乙醇质量分率W=58.844116-42.61325 ×n D
=58.844116-42.61325 ×1.3610 =0.847
摩尔分率
879 . 0 60
) 847 . 0 1 ( ) 46 847 . 0 ( ) 46 847 .
0 ( = - + = Xd 同理:塔釜样品折光指数n D =1.3770
乙醇的质量分率W=58.844116-42.61325 ×n D
=58.844116-42.61325 ×1.3780 =0.66
摩尔分率x w =0.206
在平衡线和操作线之间图解理论板3.6179 (见图-3)
全塔效率η % 18 . 36 10
6179 . 3 = = =
P t
N N 2.部分回流(R=4)
塔顶样品折光指数n D =1.3620 塔釜样品折光指数n D =1.3775
进料样品折光指数n D =1.3765 由全回流计算出质量、摩尔浓度
X D =0.843 ; X w =0.180; X f =0.231
进料温度t f =21.7℃,在X f =0.231下泡点温度91℃
乙醇在59.15℃下的比热Cp 1=3.07(kJ/kg.℃) 正丙醇在59.15℃下的比热Cp 2=2.85(kJ/kg.℃) 乙醇在91℃下的汽化潜热r 1=819(kJ/kg) 正丙醇在91℃下的汽化潜热r 2=680(kJ/kg)
混合液体比热C pm =46×0.231×3.07+60×(1-0.231)×2.85
=160.54(kJ/kmol.℃)
混合液体汽化潜热r pm =46×0.231×819+60×(1-0.231)×680
=39702(kJ/kmol)
24
. 1 39702 39702 ) 7 . 21 91 ( 54 . 160 ) ( = + - ´ = + - ´ = m
m F B r r t t Cpm q q 线斜率 = - =
1
q q
5.16 在平衡线和精馏段操作线、 提馏段操作线之间图解理论板塔板数
6.1187 (见图-4)
全塔效率η % 19 . 61 = =
P
t
N N 附图解法求解理论板:
图-3 全回流总板效率图
图-4 部分回流总板效率图。
