蛋白质中二硫键的定位及其质谱分析解析
如何分析和解读判断蛋白有二硫键的结果?

如何分析和解读判断蛋白有二硫键的结果?蛋白质中的二硫键是一种重要的化学键,能够在蛋白质结构和功能中发挥关键作用。
准确判断蛋白质中是否存在二硫键对于深入理解其结构和功能具有重要意义。
本文将重点介绍如何分析和解读判断蛋白质有二硫键的结果,帮助读者深入了解该领域的相关方法和步骤。
1.二硫键的形成和作用。
二硫键是两个半胱氨酸残基通过氧化反应形成的特殊化学键。
在蛋白质中,二硫键能够稳定蛋白质的立体结构,维持蛋白质的功能和稳定性。
了解二硫键的形成和作用是判断蛋白质中是否存在二硫键的基础。
2.生化实验方法。
判断蛋白质中是否存在二硫键的常用方法包括:2.1二硫键还原:通过还原试剂(如巯基乙醇)将二硫键还原为巯基,从而断开二硫键并使蛋白质在凝胶电泳中出现移动。
2.2还原条件下的质谱分析:利用质谱技术在还原条件下分析蛋白质的质量和离子荷质比,观察差异以判断是否存在二硫键。
2.3差异还原剂标记:使用含有差异还原剂的标记试剂标记蛋白质,通过质谱分析比较标记的蛋白质片段,以鉴定是否存在二硫键。
3.生物信息学方法。
生物信息学方法可以帮助预测蛋白质中是否存在二硫键,并提供判断的参考:3.1二硫键预测算法:通过分析蛋白质的氨基酸序列和结构特征,预测蛋白质中可能存在的二硫键。
3.2蛋白质结构数据库查询:利用已知蛋白质结构数据库,检索与目标蛋白质相似结构的蛋白质,并观察其是否存在已验证的二硫键。
4.结果解读与验证。
对于实验或预测得到的蛋白质二硫键结果,需要进行综合解读和验证:4.1结果的可靠性评估:评估实验方法或生物信息学方法的可靠性,并考虑结果的一致性和重复性。
4.2结果与蛋白质功能的关联:分析蛋白质的结构和功能特征,判断二硫键对蛋白质结构和功能的影响。
4.3进一步验证实验:通过其他实验方法验证蛋白质中是否存在二硫键,如质谱分析、X射线晶体学等。
5.结论。
准确判断蛋白质中是否存在二硫键对于深入理解蛋白质结构和功能具有重要意义。
通过生化实验方法和生物信息学方法的综合应用,可以有效分析和解读判断蛋白质有二硫键的结果。
二硫键定位分析
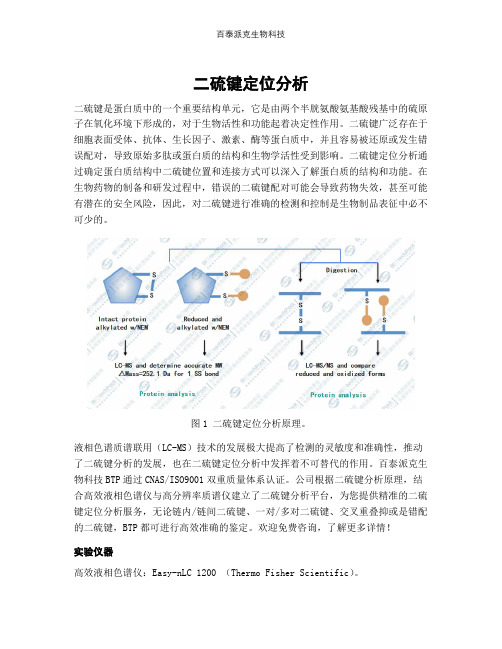
二硫键定位分析二硫键是蛋白质中的一个重要结构单元,它是由两个半胱氨酸氨基酸残基中的硫原子在氧化环境下形成的,对于生物活性和功能起着决定性作用。
二硫键广泛存在于细胞表面受体、抗体、生长因子、激素、酶等蛋白质中,并且容易被还原或发生错误配对,导致原始多肽或蛋白质的结构和生物学活性受到影响。
二硫键定位分析通过确定蛋白质结构中二硫键位置和连接方式可以深入了解蛋白质的结构和功能。
在生物药物的制备和研发过程中,错误的二硫键配对可能会导致药物失效,甚至可能有潜在的安全风险,因此,对二硫键进行准确的检测和控制是生物制品表征中必不可少的。
图1 二硫键定位分析原理。
液相色谱质谱联用(LC-MS)技术的发展极大提高了检测的灵敏度和准确性,推动了二硫键分析的发展,也在二硫键定位分析中发挥着不可替代的作用。
百泰派克生物科技BTP通过CNAS/ISO9001双重质量体系认证。
公司根据二硫键分析原理,结合高效液相色谱仪与高分辨率质谱仪建立了二硫键分析平台,为您提供精准的二硫键定位分析服务,无论链内/链间二硫键、一对/多对二硫键、交叉重叠抑或是错配的二硫键,BTP都可进行高效准确的鉴定。
欢迎免费咨询,了解更多详情!实验仪器高效液相色谱仪:Easy-nLC 1200 (Thermo Fisher Scientific)。
高分辨质谱仪:Q Exactive™ Hybrid Quadrupole-Orbitrap™ Mass Spectrometer (Thermo Fisher Scientific)。
案例示意液相色谱质谱联用法定位二硫键,不进行还原处理,而是直接进行烷基化,这个步骤将游离的巯基封闭。
随后,进行酶切操作,将蛋白质分子切割成小片段。
在这个过程中,存在二硫键的半胱氨酸之间形成了特定的连接,导致分子量发生变化。
接下来,通过质谱仪采集数据,并使用相应的分析软件进行数据库匹配,从而得到二硫键的信息。
表1 二硫键分析。
Site:形成二硫键的半胱氨酸在蛋白中的位置;Enzyme:酶解蛋白所用的酶;Peptide:肽段序列;Peptide_Mass:肽段分子量;Mass_Error(ppm):肽段的质量偏差。
二硫键详细资料大全

二硫键详细资料大全
二硫键(S-S)是连线不同肽链或同一肽链的不同部分的化学键。
它由含硫胺基酸形成,半胱氨酸被氧化成胱氨酸时即形成二硫键,二硫键是比较稳定的共价键,在蛋白质分子中,起著稳定肽链空间结构的作用。
二硫键数目越多,蛋白质分子对抗外界因素影响的稳定性就愈大。
基本介绍
•中文名:二硫键
•外文名:disulfide bond
•性质:蛋白质
•反应:2SH=-S-S-+2H
基本信息,功能,
基本信息
二硫键 disulfide bond 反应:2SH=-S-S-+2H 此键在蛋白质分子的立体结构形成上起著一定的重要作用。
为了确定蛋白质的一级结构,首先必须将二硫键打开,使成为线状多肽链。
为此,需要在2-巯-乙醇、二硫苏糖类、巯基乙酸等的硫化合物与尿素那样的变性剂同时存在下使之发生作用,使还原成-SH基(为了防止再氧化通常用适当的SH试剂将该基团烷基化)或是在过甲酸的氧化作用下衍生成-SO3H基或是采用在氧化剂共存下用亚硫酸的作用诱导成-S-SO3H基的方法。
功能
二硫键与蛋白质高级结构的生物活性有关同时与蛋白质的复性也有关联。
如核糖核酸酶A经巯基乙醇(还原剂)和尿素(蛋白质变性剂)处理后,发生变性作用,4对二硫键断裂,多肽链伸展开来,高级结构发生变化,失去生物活性。
如果用透析法将大量还原剂和变性剂除去,在微量还原剂存在下,4对二硫键在原来的位置重新形成,伸展开的多肽肽链会自发摺叠成天然构象,生物活性得到恢复。
此试验也证明蛋白质高级结构的信息存在于一级结构中。
测定蛋白质中二硫键位置的经典方法

测定蛋白质中二硫键位置的经典方法1. 二硫键还原方法:通过还原蛋白质中的二硫键,使其断裂并形成巯基,然后通过化学反应或质谱分析等方法定位巯基的位置。
常用的还原剂包括二巯基丙醇、巴巴锡、二硫化碳等。
2. 红细胞凝集试验:利用二硫键的存在可以促使红细胞间的凝集反应。
该方法可以快速筛查蛋白质中的二硫键位置,但只能给出大致的结果,不能确定具体的二硫键位置。
3. 巯基标记方法:通过使用巯基化合物(如巯基乙基硫酸酯)标记蛋白质中的巯基,然后通过质谱分析等方法确定巯基的位置。
这种方法可以较准确地确定蛋白质中二硫键的位置,但需要进行复杂的实验操作和分析过程。
4. 立体化学分析:通过测定蛋白质中二硫键的立体结构,可以确定二硫键的位置。
常用的方法包括核磁共振(NMR)和X射线晶体学等。
5. 蛋白质结构预测:利用蛋白质的序列信息和结构模型,通过计算方法预测蛋白质中的二硫键位置。
这种方法可以快速预测二硫键的位置,但需要对蛋白质结构预测方法有一定的了解。
6. 蛋白质质谱分析:通过质谱分析蛋白质中的二硫键,可以确定二硫键的位置。
常用的质谱方法包括质子转移反应质谱(PTR-MS)、质谱成像等。
7. 单分子力谱:通过单分子力谱技术,可以直接测量蛋白质中二硫键的断裂力,从而确定二硫键的位置。
这种方法具有高分辨率和高灵敏度,但需要复杂的实验操作和数据处理。
8. 蛋白质电泳:通过蛋白质电泳分离和检测,可以确定蛋白质中二硫键的位置。
常用的电泳方法包括SDS-PAGE、非变性电泳等。
9. 硫醇还原法:通过使用硫醇还原剂如巴巴锡等,可以将蛋白质中的二硫键还原为巯基,然后通过化学反应或质谱分析等方法确定巯基的位置。
10. 蛋白质交联方法:通过使用交联试剂如二硫化亚砜等,可以将蛋白质中的巯基交联形成二硫键,然后通过质谱分析等方法确定二硫键的位置。
这种方法在研究蛋白质的亚单位组装和结构中起到重要作用。
二硫键的定位修饰

蛋白质药物的二硫键定点修饰摘要:蛋白质中的二硫键在蛋白质分子的立体结构形成上起着重要作用,通过合适的策略可用于定点修饰。
本文简要介绍了利用蛋白质原生二硫键对其进行定点修饰的策略和实施方法,并讨论了该方法的有效性。
前言蛋白质和多肽药物(以下简称蛋白质药物)具有作用位点专一、疗效明确等优点,用于各种疾病治疗的蛋白质药物研制及应用已经成为生物医药产业发展的热点。
蛋白质药物的聚乙二醇修饰,是将活化的聚乙二醇通过化学方法偶联到蛋白、多肽、小分子有机药物和脂质体上,可以有效地解决蛋白质药物所存在的半衰期短、酶稳定性差、具有免疫原性等问题[1, 2]。
自1977年PEG用于修饰牛血清白蛋白以来,已有许多不同种类的活化PEGs 被成功地开发并用于蛋白质修饰。
PEG修饰技术也经历了两个发展阶段,即以传统的随机修饰为特点的第一代PEG修饰技术和以定点修饰为特点的第二代PEG 修饰技术。
相对于随机修饰,定点修饰能够针对特定基团或专一位点进行修饰,有利于保持蛋白质药物的活性,产物易于表征,产品质量更容易控制,已成为PEG修饰蛋白质药物的研究热点[3]。
为了达到这一目标,研究者们设计了不同的合成策略并合成了相应的PEG 修饰剂,不断探索蛋白质药物定点修饰的方法[4,5]。
其中,对于含有自由巯基的半胱氨酸的残基的蛋白质药物,可以利用巯基的高反应活性,选取能够特异性与巯基偶联的PEG修饰剂,能够高效地对蛋白质进行定点修饰。
然而,蛋白质分子中的半胱氨酸残基数量较少且很少以游离形式存在,虽然可以通过基因工程准确将半胱氨酸引入到蛋白质药物预先设计的位置,但这在技术上和成本上均有较高的要求。
另外,在蛋白质的纯化过程,过多的自由巯基将导致二硫键形成,蛋白质空间结构改变,以及蛋白质的不可逆聚集。
虽然利用自由巯基定点修饰蛋白质的方法困难重重,研究者发现大多数蛋白质都具有的二硫键更适于用来定点修饰,可以通过化学还原,使二硫键释放出两个巯基,从而进行定点修饰。
蛋白质中的二硫键

蛋白质中的二硫键
蛋白质是真核生物的主要结构大分子,在蛋白质的结构中,二硫键发挥着非常重要的作用。
二硫键是一种化学键,它使两个原子之间的距离保持在一定的位置,从而形成了蛋白质的可能的二维或三维构型。
二硫键的形成需要一种具有双价的元素,该元素可以与两个不同的原子构成单键,从而形成二硫键。
具有双价性的元素包括硫、氮、氟、氯、氧等。
其中最常用的是硫,因为它们能够在任何形式的环境中稳定地结合。
硫原子在氧原子或氮原子的双键室内形成二硫键时,其电子结构特征成为反应机制的核心。
从电子结构上看,形成二硫键时,硫原子从硫原子轨道中贡献的电子和氮原子从氮原子轨道中贡献的电子被
共享;这种共享的电子产生了一个大的分子穿梭孔,构成了二硫键。
硫原子的双价性可以保持两个原子的距离,并且可以吸收一定的能量,使蛋白质的结构得以稳定。
对二硫键而言,当结合处产生变化时,该能量也会随之变化。
当双硫键受到RF能量的作用时,它们会产生电子转移,从而使蛋白质的结构发生变化。
这些变化有时会影响蛋白质的功能,因此,了解二硫键的特性对于了解蛋白质的功能和机理很重要。
除了维持蛋白质结构的稳定性,二硫键还可以在其他方面发挥作用,如运输和燃烧、精细化学修饰等,这些都是生物体中为构成有机体所需的重要化学反应。
在医学上,二硫键也可以用来治疗某些疾病,
如癌症。
综上所述,蛋白质中的二硫键具有重要的作用,它们保持着蛋白质结构的稳定性,并且可以发挥多重功能。
它们在维护生物体正常功能方面也有重要的意义,因此,有必要进一步探究二硫键的作用机制和其在医学上的应用价值。
二硫键 nhs

二硫键nhs
二硫键在生物学中是一个非常重要的概念,特别是在蛋白质的结构和功能方面。
二硫键是由两个硫原子之间形成的化学键,通常在蛋白质的二级结构中起到关键作用。
它能够稳定蛋白质的结构,并且在一些生物过程中起着至关重要的作用。
在蛋白质中,二硫键是由两个巯基(-SH)之间的反应形成的。
当两个巯基相遇并反应时,它们会形成一个稳定的二硫键。
这个过程需要一个氧化环境,通常由一些特殊的酶来催化。
这些酶被称为二硫键异构酶或二硫键还原酶,它们在生物体内起着调节二硫键形成和断裂的作用。
二硫键的形成对于维持蛋白质的特定构象和稳定性非常重要。
在蛋白质折叠的过程中,二硫键的形成可以稳定蛋白质的三维结构,使其在生理条件下保持稳定。
此外,二硫键还可以影响蛋白质的功能,因为它可以影响蛋白质的构象和与其他蛋白质的相互作用。
在生物体内,二硫键的形成和断裂是动态的过程。
一些氧化剂和还原剂可以调节这个过程,从而影响蛋白质的结构和功能。
此外,一些疾病也会影响二硫键的形成和断裂,例如某些遗传性疾病和氧化应激相关疾病。
因此,研究二硫键的形成和断裂对于理解生物学过程和疾病机制具有重要意义。
总之,二硫键是生物学中的一个重要概念,它对于维持蛋白质的结构和稳定性起着关键作用。
通过研究二硫键的形成和断裂,我们可以更深入地了解生物学过程和疾病机制,为未来的生物医学研究提供更多有价值的信息。
质谱检测二硫键

百泰派克生物科技
质谱检测二硫键
蛋白质二硫键
蛋白质二硫键(S-S)是由不同蛋白肽链或同一蛋白质肽链上的两个半胱氨酸残基-巯基被氧化而形成的共价键。
伴随着二硫键的形成,蛋白质或多肽的空间结构也会发生变化,因此二硫键在维持多肽或蛋白质的空间结构,和由此决定的生物学功能方面有着重要作用。
二硫键广泛存在于细胞表面受体、抗体、生长因子、激素、酶、血浆以及毒液等蛋白质中,且容易被还原而断裂或发生错配,从而影响原多肽或蛋白的正常结构和生物学活性。
因此,分析多肽或蛋白质中的二硫键有助于我们理解和解释其高级结构和生物学功能,在生物医学和生物制药方面具有重要意义。
质谱检测二硫键
目前,质谱技术正蓬勃发展,其检测范围广、分辨率高、准确度好、分析速度快,已广泛运用于蛋白二硫键的分析检测。
利用高效液相串联质谱可以对单个或混合体系中的蛋白质二硫键进行检测、以及定位定量分析。
由于二硫键容易还原而断裂,因此在提取分离蛋白质时要严格控制实验条件,避免原有的二硫键断裂或发生错配。
百泰派克生物科技提供基于质谱的蛋白质质谱鉴定服务,包括蛋白二硫键分析、蛋白质串联质谱鉴定、蛋白质组学定性分析、基于质谱的序列分析、蛋白与蛋白互作分析等。
欢迎免费咨询152-****7680。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
学进展
第20卷
链内二硫键,而且包含一对邻位的半胱氨酸(Cys
A6,Cys
A7)。1960年,Moore等¨引完成牛胰核糖核
酸酶(RNase)全序及二硫键分析。该酶含有124个氨基酸,4个链内二硫键。这些早期的研究确立了如今仍在使用的二硫键定位研究的基本思路,包括:(1)将样品蛋白在避免二硫键重排或交换的条件下,尽可能地在其所有半胱氨酸残基之间断裂而形成二硫键相连的肽段;(2)分离这些肽段混合物;(3)鉴定分离所得的各个肽段;(4)断开肽段中的二硫键;(5)分析断开二硫键后的肽段,与整个氨基酸序列比较,推断二硫键的位置。同时这些早期的研究也提供了很多相关实验条件的经验¨7_21|。比如强酸的环境会促进二硫键的重排,在弱碱性条件下进行酶切时也会产生二硫键的交换,因此要小心地控制裂解实验条件。后来又有许多关于二硫键在碱性pH条件下交换反应增强的报道m一划。但是在酸性条件下蛋白构象趋于展开从而更容易在半胱氨酸残基之间断裂,所以提议采用酸水解或胃蛋白酶(pepsin)酶解h9’死训。酸水解法特异性不强,对较大蛋白和肽不合适。胃蛋白酶可以在酸性条件下使用,其专一性较低,断裂位点多,所以也更容易在半胱氨酸残基之间断裂,生成的含二硫键肽段比较小,有利于后面的分离和鉴定。
(1.ChangchunCenterofMassSpectrometry,ChangchunInstituteofAppliedChemistry,ChineseAcademyofSciences,
Changchun130022,China;2.GraduateSchooloftheChineseAcademyof
收稿:2007年7月,收修改稿:2007年9月
*国家自然科学基金项目(No.30672600,20675079)资助
**通讯联系人e.衄il:syliul9@yahoo.tom.ca
硫键还将有助于我们进一步揭示蛋白的高级结构及其生物功能¨“,指导定向化学合成和审评基因工程重组蛋白的折叠¨2叫引,便于X射线晶体衍射法(x.
第20卷第6期2008年6月
化
学进展
PROGRESSINCHEMISTRY
V01.20No.6June,2008
蛋白质中二硫键的定位及其质谱分析*
仇晓燕1’2
崔
勐1
(1.中国科学院长春应用化学研究所长春质谱中心
刘志强1
刘淑莹H‘
长春130022;2.中国科学院研究生院
北京100039)
摘
要
二硫键是一种常见的蛋白质翻译后修饰,对稳定蛋白质的空间结构,保持及调节其生物活性有
ray
crystallography)的三维结构研究¨纠以及为通过核
磁共振波谱法(NMR)正确解析溶液中的构象奠定基础㈨。
当蛋白质分子中存在二硫键时,在完成其氨基酸测序分析后,需要对二硫键的位置加以确定。1955年Ryle等【17’坞3对胰岛素二硫键结构的分析是蛋白质化学研究史中的里程碑。胰岛素分子的A、B两链通过两个链间二硫键连在一起,A链还有一个
中图分类号:0657.63;Q51
文献标识码:A文章编号:1005.281X(2008)06.0975—09
ProteinDisulfideBondDeterminationandItsAnalysisbyMassSpectrometry
Qiu
Xiaoyanl'2
CuiMen91Liu劢iqian91LiuShu乒n91‘‘
advantagesofbeingsimple,rapidandsensitive.Someusefulmethodsforassignmentofdisulfide
bondsinproteins
are
introduced.thedevelopmentsandapplicationsofrnass
spectrometryinthis
着非常重要的作用。因此,确定二硫键在蛋白质中的位置是全面了解含二硫键蛋白化学结构的重要方面。在众多实验方法中,现代质谱技术因其操作简单、快速、灵敏等优点而成为分析二硫键的重要手段。本文介绍了目前主要的定位二硫键的方法以及质谱在二硫键定位分析中的应用与进展。
关键词
二硫键定位质谱串联质谱三羧乙基膦稳定同位素标记
ofthechemicalstructureof
a
protein.Numerousexperimentalmethodshavebeendevelopedforthe
determinationof
disulfidebondsinproteins.Modernmassspectrometryhasdevelopedas锄importanttoolfortheanalysisofdisulfidebondpatternsduetoits
the
three-dimensionalstructures
ofproteins
and
theirbiological
activities.
Therefore.thedeterminationofdisulfidebondsbecomesanimportantaspectforobtaininga
comprehensiveunderstanding
areaare
reviewed.
Keywords
assignmentofdisulfideboБайду номын сангаасd;lll越Sspectrometry;MS/MS;TCEP;stable
isotopelabeling
1
引言
二硫键广泛存在于原核和真核生物的激素、酶、
免疫球蛋白、血浆、抑制剂和毒液等蛋白质中,是一种常见的蛋白质翻译后修饰。二硫键作为共价键交联多肽链内或链间的两个半胱氨酸,对稳定蛋白质的空间结构¨-5】、维持正确的折叠构象№’7]、保持及调节其生物活性¨-1训等都有着举足轻重的作用。因此,确定二硫键在蛋白质中的位置对于鉴定蛋白质一级结构有着重要的意义,是研究含有二硫键结构的活性多肽/蛋白质化学结构的重要方面。定位二
Sciences,Beijing100039,China)
AbstractDisulfidebonds
areone
ofthemostcommoncovalentposttranslationalmodificationsofproteins.Theyplay
an
importantrole
in
maintaining
