高中化学离子反应知识点总结材料精讲精练
高中化学辅导离子反应

高中化学辅导离子反应
高中化学辅导离子反应
知识点总结
1、学习离子反应之前要了解电解质和非电解质:在水溶液里或熔融状态下能够导电的化合物叫做电解质;在水溶液里或熔融状态下都不能电离的化合物叫非电解质;常见的电解质和非电解质:电解质一般包含:酸、碱、盐、活泼金属氧化物等;非电解质:非金属氧化物(CO
2、SO2等)、某些非金属氢化物(如NH3)、绝大多数有机物。
2、电解质又分强、弱电解质:强电解质是指在水分子作用下,能完全电离为离子的电解质。
包括大多数盐类、强酸、强碱、部分碱性氧化物等。
弱电解质是指在水分子作用下,只有部分分子电离的电解质。
包括弱酸(如HAc、H2S)、弱碱(如NH3H2O) 、Al(OH)
3、H2O等。
因此强弱电解质的电离程度大不相同。
3、离子反应:有离子参加的反应,知道常见的离子反应的类型,离子反应发生的条件,离子共存的条件。
4、离子方程式:用实际参加反应的离子符号表示离子反应的式子。
通过书写离子方程式,我们知道多个具体的反应写出的离子方程式是一样的。
这说明:离子方程式不仅可以表示某一具体的化学反应,而且还可以表示同一类型的离子反应。
离子方程式的意义:表示了反应的实质,代表了同一类型的离子反应。
板:Fe++Cu=Fe2++Cu2+电荷不等,故D错。
答案:C。
高三化学 离子反应 知识精讲

高三化学离子反应知识精讲一. 离子反应1. 概念:有离子参加的反应称之为离子反应(无论是反应物中还是产物中有离子都可以)2. 表示:离子方程式(既满足质量守恒,又满足电荷守恒。
如果是氧化还原反应还满足电子转移守恒)3. 本质:离子之间发生的反应(主要是氧化还原反应和复分解反应)二.电荷守恒式在溶液中,正电荷总量等于负电荷总量三.如何判断离子方程式的正误常见错误:(1)拆分错误例:.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑Ca(HCO3)2是易溶于水的盐,应该拆分。
(2)守恒错误例:向FeCl2溶液中通入Cl2: Fe2++Cl2=Fe3++2Cl-不符合电荷守恒(3)不符合反应原理例:铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑稀盐酸的氧化性弱,只能将铁氧化成亚铁离子。
(4)不符合量的关系(较难)例:过量的氯气通入溴化亚铁溶液中2Cl2+2Fe2++2Br-==4Cl-+2Fe3++Br2过量的氯气,溶液中不可能还有大量溴离子,而方程式显示溴离子有剩余,“2Fe2++2Br-”应改为“2Fe2++4Br-”。
四.离子共存离子不能共存知识归纳:(1)复分解反应:H+和(OH-弱酸根离子:CO32-HCO3-ClO-SO32-HSO3-S2- HS-等)OH-和(H+和弱碱对应的阳离子:NH4+Fe2+Fe3+Al3+等)形成沉淀(2)氧化还原反应:氧化性离子(Fe3+NO3-[H+] MnO4-)还原性离子(I-S2-SO32-)例1.(90-全国)下列离子方程式不正确的是:(B)铜片插入硝酸银溶液:Cu+Ag+=Cu2++Ag(D)硫氰化钾溶液加入三氯化铁溶液:Fe3++SCN-=[Fe(SCN)]2+[解析]醋酸和氨水都是弱电解质,在离子方程式中不能拆分(B)中电荷不守恒碳酸钙是沉淀,不能拆分答案:BC例2.(90-全国)下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是:[解析]离子不能共存,是因为之间会发生化学反应,一般情况下,主要考虑阴离子和阳离子之间的反应(例外:氢氧根离子和多元弱酸酸式阴离子之间也会反应)。
高一化学 知识点精析精练 离子反应 精品

第二节离子反应知识归纳1.强弱电解质的概念及物质分类在水溶液或熔融状态下完全电离成离子的电解质称为强电解质。
主要有强酸,如H2SO4、HCI、HNO3等;强碱,如NaOH、KOH、Ba(OH)2等;大多数盐,如NH4Cl、BaSO4等。
在水溶液或熔融状态下只有部分电离成离子的电解质称为弱电解质。
主要有弱酸,如H2CO3、H2S等;弱碱,如NH3·H2O、Cu(OH)2等;少数盐,如(CH3COO)2Pb以及水等。
2.离子反应的实质离子反应的实质是溶液中的离子浓度发生了改变。
复分解反应发生的条件(即生成气体、沉淀或水)实际上就是离子反应发生的实质原因。
如NaOH和H2SO4中和,即溶液中H+和OH-离子浓度减小。
有时虽然反应未生成气体、沉淀或水,但因生成了其他弱电解质而导致离子浓度改变,反应同样能发生(如Ag3PO4溶于HN03,Ag3PO4+3H+3Ag+H3PO4,溶液中Ag+浓度增大,而H+浓度减小)。
3.离子反应可表示相同类型的一类反应如:H+-H2O可表示为HCI+NaOH NaCI+H2O或H2SO4+2KOH K2SO4+2H2O或2HNO3+Ba(OH)2Ba(NO3)2+2H2O学法建议本节内容学习要抓住离子反应的本质,明确离子反应的表示方法,并将知识延伸迁移应用,解决某些实际问题,如离子共存、溶液导电性等。
1.离子反应表示方法——离子方程式书写规则(1)中学所讲的离子反应一般是溶液中进行的反应。
(2)可溶的强电解质写成离子形式,难溶的或弱电解质则写化学式。
(3)固体间反应或固体和一种特定的浓溶液(如Cu和浓H2SO4)反应不能写成离子反应方程式。
(4)氧化物或气体或其他非电解质一律写化学式。
2.离子方程式的书写方法与正误判断(1)离子方程式的书写方法:①写出化学方程式;②改写离子符号(哪些能改?);③移项抵消相同的离子符号;④检查原子、电荷是否守恒。
(2)离子方程式正误判断(其他以后会学到):①分子式与离子符号混写(错);②原子不守恒(错);③电荷不守恒(错);④不符合实验事实(错)。
高一化学必修一《离子反应》知识点总结

高一化学必修一《离子反应》知识点总结第1篇:高一化学必修一《离子反应》知识点总结高一化学必修一《离子反应》知识点梳理一、离子反应的概念离子反应是指有离子参加的反应。
也就是说,反应物中有离子或生成物中有离子的反应,均为离子反应。
由于中学阶段涉及的问题多数是指水溶液中的变化,所以水溶液中电解质间的相互反应便成了离子反应的常见问题。
但须注意的是,凡是离子化合物,就含有离子,有时固体状态的物质之间(如实验室判氨)或固体与气体之间(如碱石灰与*化*)发生的反应,也可以是离子反应,只是通常不书写类似这样过程的离子反应方程式。
在水溶液中发生离子反应的条件即复分解反应的三个条件(有难电离、难溶及易挥发物质生成)和氧化还原反应(比如置换反应等)。
二、离子共存问题水溶液中所有能反应或相互促进水解的离子都不能大量共存(注意不能完全共存,而是大量共存)。
一般规则是:1、凡相互结合生成难溶或微溶*盐的离子(熟记常见的难溶、微溶盐);2、与h+不能大量共存的离子(生成水或弱)*及*式弱*根离子:1氧族有:oh-、s2-、hs-、so32-、hso3-2氮族有:h2po4-、hpo42-、po43-3卤族有:f-、clo-4碳族有:ch3coo-、co32-、hco3-、sio32-5含金属*根离子:alo2-3、与oh-不能大量共存的离子有:nh4+和hs-、hso3-、hco3-、h2po4-、hpo42-等弱*的*式*根离子以及弱碱的简单阳离子(比如:cu2+、al3+、fe3+、fe2+、mg2+等等)4、能相互发生氧化还原反应的离子不能大量共存:1常见还原*较强的离子有:fe2+、s2-、i-、so32-。
2氧化*较强的离子有:fe3+、clo-、mno4-、cr2o72-、no3-、此外,s2o32-与h+也不能共存(发生歧化反应)。
例1:下列各组离子:①i-、clo-、no3-、h+②+、nh4+、hco3-、oh-3so32-、so42-、cl-、oh-④fe3+、cu2+、so42-、cl-⑤h+、+、alo2-、hso3-⑥ca2+、na+、so42-、co32-在水溶液中能大量共存的是a、①b、③④c、②⑤d、①④[解题分析]本题全面考查离子共存知识,在题给的六组离子中,第①组clo-与h+、i-不能大量共存,第②组中nh4+与oh-、hco3-与oh-不能大量共存,第③④组中各离子可以共存,第⑤组h+与alo2-、hso3-不能大量共存,第⑥组中ca2+与co32-甚至so42-不能大量共存。
离子反应知识点总结

离子反应知识点总结离子反应是化学反应中常见的一种类型,它是指化学反应中发生的电子转移现象。
在离子反应中,通常涉及离子的生成、消失和转化。
离子反应的基本特征是在反应中产生离子,因此它在化学反应中具有重要的地位。
下面将对离子反应的知识点进行总结。
1. 离子的概念。
离子是指在化学反应中失去或获得了一个或多个电子的原子或分子。
根据失去或获得电子的情况,离子可分为阳离子和阴离子。
阳离子是指失去了一个或多个电子的离子,带有正电荷;阴离子是指获得了一个或多个电子的离子,带有负电荷。
离子的生成通常发生在化学反应中。
2. 离子反应的基本过程。
离子反应的基本过程包括离子的生成、消失和转化。
在化学反应中,原子或分子失去或获得电子,从而生成离子。
生成的离子可以与其他离子或分子发生进一步的反应,产生新的化合物。
在反应过程中,原有的离子可能会消失,转化为其他离子或分子。
离子反应是化学反应中的重要环节,它决定了反应的进行和结果。
3. 离子反应的表示方法。
离子反应可以用离子方程式来表示。
离子方程式是指将反应物和生成物中的离子分别写出来,并按照它们在反应中的实际参与情况排列,以表示反应过程中离子的生成、消失和转化。
离子方程式能够清晰地展现离子反应的全貌,有助于理解反应过程和预测产物。
4. 离子反应的应用。
离子反应在生活和工业中有着广泛的应用。
例如,在水处理过程中,离子反应可以去除水中的杂质离子,使水达到清洁的标准。
在金属提取和精炼过程中,离子反应可以帮助分离和纯化金属离子,提高金属的纯度和质量。
此外,离子反应还在化学合成、药物制备和环境保护等领域发挥着重要作用。
综上所述,离子反应是化学反应中的重要类型,它涉及离子的生成、消失和转化。
离子反应的理解对于理解化学反应的机理和规律具有重要意义。
通过学习离子反应的知识点,可以更好地理解化学反应的本质,为相关领域的应用提供理论支持。
希望本文对离子反应的理解有所帮助。
离子反应知识点详解加强化训练

板块四离子反应一、离子反应的概念及意义1.概念:用实际参加反应的离子的符号来表示离子反应的式子。
例:Ba(OH)2+H2SO4=BaSO4↓+2H2O Ba2++SO42-+2H++2OH-=2H2O+BaSO4↓BaCl2+K2SO4=BaSO4↓+2KCl Ba2++SO42-=BaSO4↓2.意义:⑴揭示反应的实质;⑵表示同一类型的反应;⑶能避免同一反应写出多个化学反应方程式的现象例:FeS+12HNO3=Fe(NO3)3+H2SO4+9NO2↑+5H2O3FeS+30HNO3=Fe2(SO4)3+Fe(NO3)3+27NO2↑+15H2O二者离子方程式均为:FeS+10H++9NO3-=Fe3++SO42-+9NO2↑+5H2O二、离子反应的书写方法1.步骤:⑴“写”-基础;⑵“改”-关键;⑶“删”-细致;⑷“查”-保证(查:质量守恒、电荷守恒、得失电子总数相等)2.原则:记住不“改(或称拆)”的物质:⑴不溶物、难溶物、微溶物(掌握溶解性表);⑵单质及氧化物;⑶气体;⑷弱电解质(弱酸、弱碱、水)。
3.注意事项:⑴只有在溶液中进行的离子反应才能书写离子反应方程式例:2NH4Cl(s)+Ca(OH)2(s)=CaCl2(s)+2NH3(g)+2H2O(l)Cu+2H2SO4(浓)=CuSO4+SO2+2H2O(均不能改写成离子方程式)⑵对微溶物(如氢氧化钙)的处理:作生成物时不“拆”;作反应物时,若为澄清石灰水,则应“拆”;若为石灰乳、石灰浆,则“不拆”。
⑶酸式盐的处理:多元弱酸的酸式盐的阴离子不拆(如HCO3-);多元强酸的酸式盐的阴离子要拆(如HSO4-)4.针对练习:⑴写出下列反应的离子方程式①过氧化钠与水反应;②向澄清石灰水中加纯碱;③高锰酸钾溶液与盐酸反应;④硫酸氢钠与碳酸氢钠反应;⑤氯气通入氢氧化钠溶液中;⑥碳酸氢钙与盐酸反应;⑵写出两个符合下列离子反应的化学反应方程式①HCO3-+OH-=CO32-+H2O ②Cu2++2OH-=Cu(OH)2三、离子定量反应的问题1.限量反应:例1:①硫酸氢钠恰好中和氢氧化钡的碱性分析:实为向硫酸氢钠溶液中加入少量氢氧化钡,硫酸氢钠过量答案:①2H++SO42-+ Ba2++2OH- = BaSO4↓+2H2O②硫酸氢钠恰好沉淀氢氧化钡溶液中的钡离子分析:实为向氢氧化钡溶液中加入少量硫酸氢钠,氢氧化钡过量答案:②H++SO42-+ Ba2++OH- = BaSO4↓+H2O规律:谁少就将谁令为“1”,谁就按其组成比例电离。
高中化学离子反应知识点总结精讲精练
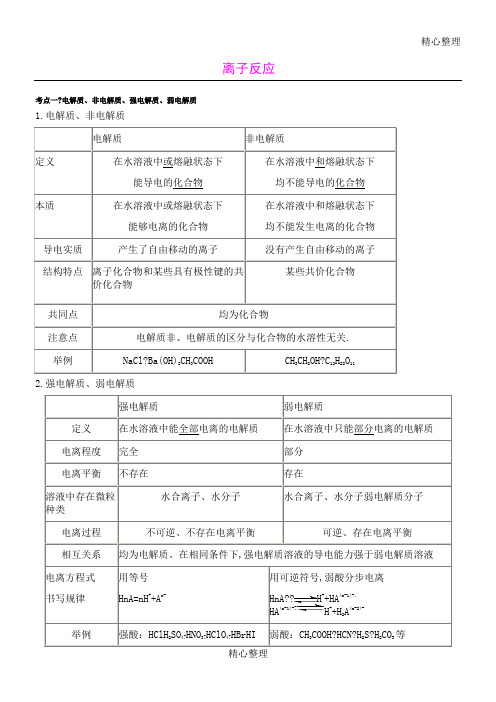
精心整理离子反应考点一?电解质、非电解质、强电解质、弱电解质1.电解质、非电解质电解质非电解质定义在水溶液中或熔融状态下能导电的化合物在水溶液中和熔融状态下均不能导电的化合物本质在水溶液中或熔融状态下能够电离的化合物在水溶液中和熔融状态下均不能发生电离的化合物导电实质产生了自由移动的离子没有产生自由移动的离子结构特点离子化合物和某些具有极性键的共价化合物某些共价化合物共同点均为化合物注意点电解质非、电解质的区分与化合物的水溶性无关.举例NaCl?Ba(OH)2CH3COOH CH3CH2OH?C12H22O112.强电解质、弱电解质强电解质弱电解质定义在水溶液中能全部电离的电解质在水溶液中只能部分电离的电解质电离程度完全部分电离平衡不存在存在溶液中存在微粒种类水合离子、水分子水合离子、水分子弱电解质分子电离过程不可逆、不存在电离平衡可逆、存在电离平衡相互关系均为电解质。
在相同条件下,强电解质溶液的导电能力强于弱电解质溶液电离方程式书写规律用等号HnA=nH++A n-用可逆符号,弱酸分步电离HnA??H++HA(n-1)-,HA(n-1)-???H++H2A(n-2)-举例强酸:HClH2SO4?HNO3?HClO4?HBrHI 弱酸:CH3COOH?HCN?H2S?H2CO3等强碱:KOH?NaOH?Ba(OH)2等.绝大部分盐:BaSO4?BaCl2.等弱碱:NH3H2O?Cu(OH)2等.H2O及小部分盐:(CH3COO)2Pb等.[例1]下列物质属于电解质的是(???)A.Na2O????????????B.SO3??????????????????????C.Cu????????????D.NaCl 溶液[解析]Na2O为离子化合物,在熔融条件下能导电,为电解质,故A正确;SO3为共价化合物,在熔融条件下不能导电,其水溶液能导电是SO3与水反应生成的H2SO4导电,故SO3为非电解质,B不正确;Cu是单质,NaCl溶液为混合物,它们既不是电解质,也不是非电解质,故C、D都不正确。
离子反应笔记整理

离子反应笔记整理
一、离子反应的定义
离子反应是指在水溶液中或熔融状态下,电解质发生电离成自由移动的离子,在一定的条件下,离子之间发生相互作用,形成沉淀、气体、水或其它化合物,从而使离子的浓度发生变化的一种反应。
二、离子反应的类型
酸碱反应:酸碱溶液混合,酸碱中和生成盐和水。
氧化还原反应:氧化剂和还原剂的相互作用,生成新的物质。
络合反应:络合剂与金属离子发生相互作用,生成络合物。
双水解反应:弱酸根离子和弱碱阳离子相互作用,生成气体、沉淀或水。
三、离子反应的规律
同种物质相互反应时,其反应规律为:强酸+强碱=弱酸+弱碱;强酸+弱碱=强酸+弱碱;弱酸+弱碱=强酸+强碱。
不同物质相互反应时,其反应规律为:氧化性强物质+还原性强物质=还原性较弱物质+氧化性较弱物质。
离子反应总是向着离子浓度减小的方向进行。
四、离子反应的应用
在化学实验中,离子反应可以用来检测溶液中离子的存在和含量。
在工业生产中,离子反应可以用来制备新的物质,如酸碱中和制备盐和水。
在环保领域,离子反应可以用来处理废水、废气等污染物。
在医疗领域,离子反应可以用来制备药物和治疗疾病。
五、离子反应的注意事项
在进行离子反应时,要注意安全问题,如避免产生有毒气体或腐蚀性物质。
在进行离子反应时,要注意实验仪器的清洗和干燥,确保实验的准确性。
在进行离子反应时,要注意实验温度和浓度的控制,避免产生不必要的副产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子反应考点一电解质、非电解质、强电解质、弱电解质1.电解质、非电解质电解质非电解质定义在水溶液中或熔融状态下能导电的化合物在水溶液中和熔融状态下均不能导电的化合物本质在水溶液中或熔融状态下能够电离的化合物在水溶液中和熔融状态下均不能发生电离的化合物导电实质产生了自由移动的离子没有产生自由移动的离子结构特点离子化合物和某些具有极性键的共价化合物某些共价化合物共同点均为化合物注意点电解质非、电解质的区分与化合物的水溶性无关.举例NaCl Ba(OH)2 CH3COOH CH3CH2OH C12H22O112.强电解质、弱电解质强电解质弱电解质定义在水溶液中能全部电离的电解质在水溶液中只能部分电离的电解质电离程度完全部分电离平衡不存在存在溶液中存在微粒种类水合离子、水分子水合离子、水分子弱电解质分子电离过程不可逆、不存在电离平衡可逆、存在电离平衡相互关系均为电解质。
在相同条件下,强电解质溶液的导电能力强于弱电解质溶液电离方程式书写规律用等号HnA=nH++A n-用可逆符号,弱酸分步电离HnA H+ +HA(n-1)-,HA(n-1)- H++H2A(n-2)-举例强酸:HCl H2SO4 HNO3 HClO4 HBr HI 强碱:KOH NaOH Ba(OH)2等. 弱酸:CH3COOH HCN H2S H2CO3等弱碱:NH3H2O Cu(OH)2等.绝大部分盐:BaSO4 BaCl2. 等H2O及小部分盐:(CH3COO)2Pb等.[例1]下列物质属于电解质的是()A.Na2OB.SO3C.CuD.NaCl 溶液[解析] Na2O为离子化合物,在熔融条件下能导电,为电解质,故A正确;SO3为共价化合物,在熔融条件下不能导电,其水溶液能导电是SO3与水反应生成的H2SO4导电,故SO3为非电解质,B不正确;Cu是单质,NaCl 溶液为混合物,它们既不是电解质,也不是非电解质,故C、D都不正确。
[答案]A特别提醒:1.电解质是指在水溶液中或熔融状态下能够导电的化合物。
水溶液中或熔融状态下,这两者之间只需满足一者就行了,但必须强调的是其本身能够导电,而不是反应的生成物。
如SO2、SO3的水溶液虽然能导电,但它们都不是电解质,原因是在溶液中真正起到导电作用的是它们与水反应的生成物H2SO3、H2SO4,而不是它们自己本身。
Na2O的水溶液的导电虽然也是它与水反应生成的NaOH导电,但因为其在熔融状态下本身能够导电,所以Na2O是电解质。
2.电解质和非电解质都是化合物,单质它既不是电解质,也不是非电解质。
3.判断某电解质是强电解质还是弱电解质关键是看它在水溶液中电离时是完全电离还是部分电离,与其溶解度大小、导电能力强弱等因素无关。
考点二离子方程式的书写1.离子反应:指在溶液中(或熔化状态下)有离子参加或离子生成的反应。
2.离子方程式:用实际参加反应的离子符号表示化学反应的式子。
3.离子方程式的书写:(1)书写规则:①单质、氧化物、不溶物、难电离的物质(弱酸、弱碱及水等)不能拆开来写。
如Cl2、Na2O等不可以拆开写成Cl-、Na+、O2-;BaSO4不可以拆开写成Ba2+、SO42-形式。
②易溶于水,易电离的物质的离子符号的改写同电离方程式中的离子形式。
如NaHCO3改写Na+、HCO3-;NaHSO4应改写Na+,H+,SO42-③微溶物,若出现在反应物中一般改写成离子符号(悬浊液除外);若出现在生成物中一般不改写。
④固体与固体物质反应不写离子方程式。
如实验室制取NH3的离子方程式为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O⑤浓H2SO4、浓H3PO4一般不拆开写成离子形式;HCl、HNO3无论浓稀,均应改写成离子符号。
如Cu片与浓H2SO4反应的离子方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O(2)书写步骤(以CuSO4溶液与BaCl2溶液反应为)①写出反应的化学方程式:CuSO4+BaCl2==CuCl2+BaSO4↓②把易溶于水、易电离的物质拆开写成离子形式,难溶的物质或难电离的物质以及气体等仍用化学式来表示。
上述化学方程式可改写成:Cu2++SO42-+Ba2+ +2Cl- =Cu2++2Cl-+BaSO4↓③删去方程式两边不参加反应的离子符号:Ba2+ + SO42- =BaSO4↓④检查离子方程式两边各元素的原子个数和电荷总数是否相等。
特别提醒:常见离子方程式的书写错误(1)不配平(一般表现为等式两边原子不守恒或电荷数不守恒)。
如Fe3++Cu =Cu2++Fe2+;Na+H2O=Na++OH-+H2↑(2)该改的不改或不该改的改了。
如Na2O溶于水:O2- + H2O = 2OH-;石和稀盐酸反应:CO32-+2H+=CO2↑+H2O;醋酸铵溶液与烧碱溶液共热:CH3COONH4+OH-=CH3COO-+ NH3↑+H2O;乙醛做银镜反应:CH3CHO+2[Ag(NH3)2]OH→CH3COO-+NH4++2Ag↓+3NH3+H2O等等……(3)与反应事实不相符合。
如铁片溶于稀HCl:2Fe+6H+ =2Fe3++ 3H2↑;铝条溶于稀HNO3:2Al+6H+ = 2Al3++3H2↑(4)不是离子反应的写离子方程式。
离子反应发生在水溶液中或熔融状态下,否则就不能写离子方程式。
如浓硫酸与食盐共热制HCl;浓硫酸与Cu共热制SO2;实验室制CH4和NH3等都无离子方程式。
(5)乱用↑、↓、== 、符号。
如FeCl3溶液的水解:Fe3++ 3H2O = Fe(OH)3↓+ 3H+;F2通入水中:2F2+2H2O=4HF+O2↑;Na2CO3的水解:CO32-+H2O=HCO3-+OH-(6)多步水解或电离的方程式一步完成或水解与电离方程式分不清楚。
如Na2S溶于水:S2-+2H2O H2S +2OH-;H2S溶于水:H2S 2H+ + S2-。
(7)漏写一种产物。
如CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓;Ba(OH)2溶液中滴加稀H2SO4:H+ + OH- = H2O。
(8)随便约简或不约简。
如Ba(OH)2溶液不断滴加稀H2SO4:Ba2++H++OH-+SO42-=BaSO4↓+ H2O;Al2(SO4)3溶液中加氨水:2Al3+ +6NH3·H2O=2Al(OH)3↓+6NH4+[例2](2008·)下列离子方程式书写正确的是()A.AgNO3溶液中滴入少量的Na2S溶液 2Ag+ + S2-==Ag2S↓B.过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O==HCO3-+HClOC.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+==CO2↑+H2OD.向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-==BaSO3↓+SO32-+2H2O[解析]CH3COOH为弱电解质,不可拆开写成离子形式,故C不正确;因加入的NaHSO3溶液少量,则在反应中Ba(OH)2过量,书写离子方程式时应以少量的NaHSO3为主,其离子方程式应为:HSO3-+Ba2++OH-==BaSO3↓+ H2O,故D不正确。
[答案]A B考点三 溶液中的离子共存 1.离子共存条件:同一溶液中若离子间符合下列任意一个条件就会发生离子反应,它们之间便不能在溶液量共存。
⑴生成难溶物或微溶物:如:Ba 2+与CO 32-,Ag +与Br -,Ca 2+与SO 42-等不能大量共存。
⑵生成气体或挥发性物质:如:NH 4+与OH -,H +与CO 32-、HCO 3-、S 2-、HS -、SO 32-、HSO 3-等不能大量共存。
⑶生成难电离物质:如:H +与CH 3COO -、CO 32-、S 2-、SO 32-等因生成弱酸不能大量共存;OH -与NH 4+因生成的弱碱不能大量共存;H +与OH -生成水不能大量共存。
⑷发生氧化还原反应:氧化性离子(如Fe 3+、NO 3-、ClO -、MnO 4-(H +)等)与还原性离子(如S 2-、I -、Fe 2+、SO 32-等)不能大量共存。
2.附加隐含条件的应用规律:⑴溶液无色透明时,则溶液中一定没有有色离子,如Cu 2+、Fe 3+、Fe 2+、MnO 4- ⑵强碱性溶液中肯定不存在与OH -反应的离子,如Fe 3+、 Fe 2+、HCO 3-、NH 4+、Al 3+⑶强酸性溶液中肯定不存在与H +反应的离子,如HCO 3-、CO 32-、S 2-、CH 3COO -、AlO 2- [例3](2008·全国理综)在溶液中加入少量Na 2O 2后仍能大量共存的离子组是( ) A.NH 4+、Ba 2+、Cl -、NO 3- B.K +、AlO 2-、Cl -、SO 42- C.Ca 2+、Mg 2+、NO 3-、HCO 3- D.Na +、Cl -、CO 32-、SO 32-[解析]由题意知,往溶液中加入少量Na 2O 2后,①Na 2O 2会与原溶液中的水反应生成NaOH ,使溶液呈碱性,故NH 4+、Mg 2+、HCO 3-不能与其大量共存,A 、C 不正确;②Na 2O 2有强氧化性,会氧化溶液中的一些还原性离子,如Fe 2+、SO 32-等,故D 不正确。
引:为什么会有离子反应?什么样的反应是离子反应?像这样,由于电解质溶于水后电离成为离子,在反应的实质上是离子间的反应,这样的反应属于离子反应,有关概念的说明:1. 离子反应中,并不一定所有的反应物都以自由移动的离子参加反应,至少有一种即可,如第3个反应。
2. 在中学阶段,离子反应研究的主要是电解质在溶液......中的行为,像+)(42固Cl NH 2)(OH Ca )(固∆===2232CaCl O H NH ++这样的反应,虽然反应物Cl NH 4和2)(OH Ca 都是由离子构成的,但由于反应时参加的离子不能自由移动,因此对这样的反应不研究。
3. 离子反应、非离子反应是以化学反应中实际参加反应的微粒中是否有离子为标准而划分的反应类型;若以电子转移、化合价升降的观点来看,离子反应既可能是氧化还原反应,又可能是非氧化还原反应。
4. 同种物质之间的化学反应,在一种条件下是离子反应,在另一种条件下就不一定是离子反应。
例如:)(气HCl )(3气NH +==)(4固Cl NH 非离子反应)(溶液HCl )(3气NH +==)(4溶液Cl NH 离子反应 (二)离子方程式当4CuSO 与NaCl 混合时,没有发生化学反应,只是4CuSO 电离出来的+2Cu、-24SO 和NaCl 电离出来的+Na 、-Cl 等的混合。
