酒石酸吉他霉素可溶性粉工艺规程
酒石酸吉他霉素可溶性粉
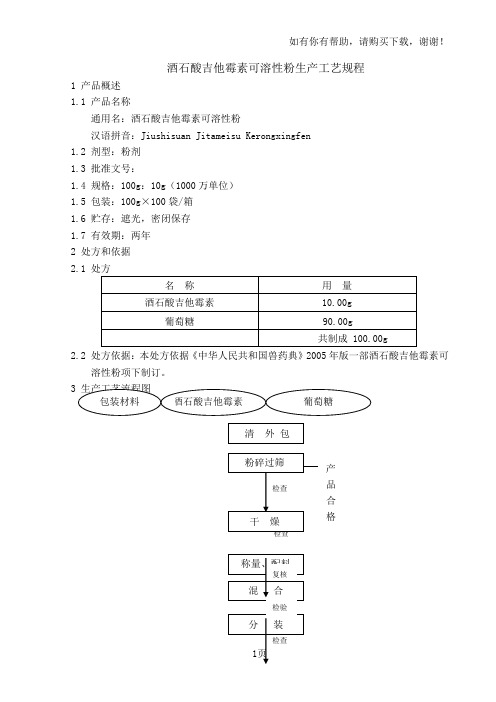
酒石酸吉他霉素可溶性粉生产工艺规程1 产品概述1.1 产品名称通用名:酒石酸吉他霉素可溶性粉汉语拼音:Jiushisuan Jitameisu Kerongxingfen1.2 剂型:粉剂1.3 批准文号:1.4 规格:100g :10g (1000万单位)1.5 包装:100g ×100袋/箱1.6 贮存:遮光,密闭保存1.7 有效期:两年2 处方和依据2.1 处方2.2 处方依据:本处方依据《中华人民共和国兽药典》2005年版一部酒石酸吉他霉素可溶性粉项下制订。
产品 合格4 操作过程及工艺条件4.1 粉碎过筛 4.1.1 如酒石酸吉他霉素和葡萄糖不能通过五号筛,应进行粉碎。
4.1.2 操作人员按本岗位的操作规程将酒石酸吉他霉素和葡萄糖分别粉碎,药粉应通过五号筛。
4.1.3 车间质量监督员对粉碎过筛岗位进行检查,符合要求后即可生产。
4.1.4 粉碎过筛后的药粉装入洁净容器中,容器外挂物料状态卡,注明名称、规格、批号、数量、日期、操作者和复核人。
4.1.5 操作人员填写粉碎过筛批记录,并将记录随物料传入称量配料工序。
4.2 称量配料4.2.1 酒石酸吉他霉素和葡萄糖使用前应再次检查外观情况,确保质量合格。
称量前操作人员应先核对原料的名称、批号、数量、生产单位等。
确认无误后,进行称量配料。
处方计算和称量过程必须由双人操作,一人称量、一人复核,并由质量监督员监督。
操作过程中,操作人员应及时填写称量记录。
4.2.2 称好的物料置于清洁干燥的周转容器内,容器外应挂物料状态卡,注明物料名称、批号、数量、规格、日期、操作人和复核人。
4.3 混合,确认无误后进行下一步操作。
4.3.2 检查各准备工作无误后,将称量好的原料与辅料依次倒入V 型混合机开始混合,混合30分钟。
并保证混合机的装量不超过该机总量的2/3。
4.3.3 经过混合具有均一性的物料为一个批量,编为一个批号。
4.3.4 混合好的物料装入洁净的容器内,容器外应挂物料状态卡,写明物料品名、规格、批号、数量、日期﹑操作者和复核人,传入中间站。
酒石酸吉他霉素检验记录
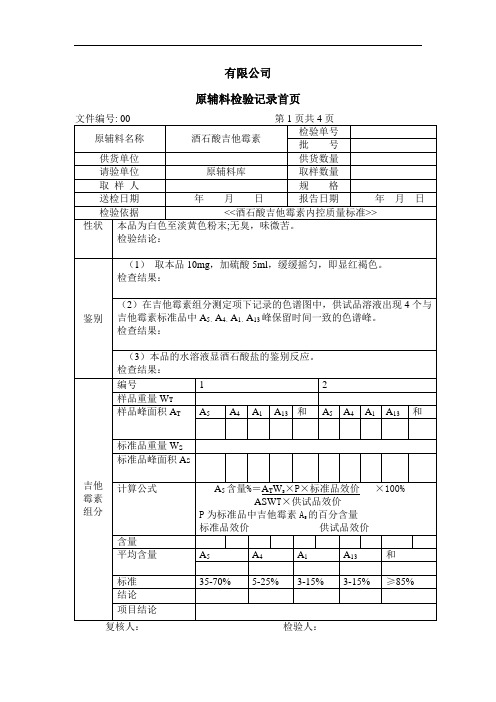
检验结论:
水分
取本品,照水分测定法测定,含水分不得过5.0%。
检验结果:
炽灼
残渣
样品号
1
2
供试品质量(m0)
炽灼前坩埚的重量(m1)
炽灼后坩埚和残渣的重量(m2)
计算公式: m2-m1
炽灼残渣= *100%
m0
炽灼残渣
平均值
标准规定: 残渣的重量不得过0.5%
有限公司
原辅料检验记录首页
文件编号: 00第1页共4页
原辅料名称
酒石酸吉他霉素
检验单号
批号
供货单位
供货数量
请验单位
原辅料库
取样数量
取样人
规格
送检日期
年月日
报告日期
年月日
检验依据
<<酒石酸吉他霉素内控质量标准>>
性状
本品为白色至淡黄色粉末;无臭,味微苦。
检验结论:
鉴别
(1)取本品10mg,加硫酸5ml,缓缓摇匀,即显红褐色。
有限公司
原辅料检验记录附页
文件编号:00第3页共4页
样品制备:
精密称取本品适量,加灭菌水定量稀释成每1ml约含1000单位的溶液,照抗生素微生物鉴定法测定。
对照品制备:
精密称取红霉素对照品适量,加灭菌水制成每毫升中约含1000单位的溶液。
培养条件:
标准品效价:标准品取量(g):
标准品稀释:
样品估计效价:样品取量(g):(1) (2)
项目结论
含量测定:酒石酸吉他霉素室温:℃湿度:%
效价测定:酒石酸吉他霉素
主要分析仪器
注射用酒石酸吉他霉素无菌检查方法验证

注射用酒石酸吉他霉素无菌检查方法验证作者:李严来源:《中国科技博览》2013年第21期[摘要]本文以注射用酒石酸吉他霉素(20万单位)为例,系统阐述了注射剂无菌检查法方法验证的过程及相关注意事项。
[关键词]注射剂无菌检查法方法验证中图分类号:R245.9+5文献标识码:A文章编号:1009-914X(2013)21-0259-01供试品:注射用酒石酸吉他霉素规格:20万单位生产厂家:略检验依据:《中国药典》2010年版二部附录XI H【无菌】(1)供试品溶液制备:取供试品30支,每支加0.9%无菌氯化钠溶液5ml使溶解,全部量转移至500ml 0.9%无菌氯化钠溶液中,摇匀,制成约12mg/ml的供试溶液;(2)薄膜过滤:注射用酒石酸吉他霉素(20万单位)无菌检查法采用薄膜过滤法,供试品用量30支,每支加0.9%无菌氯化钠溶液5 ml溶解后,全部量转移至500ml 0.9%无菌氯化钠溶液中,制成约12mg/ml的供试液;置3个滤筒中同时过滤,每筒过滤供试液约170ml;以0.9%无菌氯化钠为冲洗液,分次冲洗,冲洗量不少于300ml/筒,以金黄色葡萄球菌为阳性对照菌,依法检查(《中国药典》2010年版二部附录XI H),应符合规定。
验证目的:依据《中国药典》2010年版,通过一系列验证,确认所采用方法适合于该药品的无菌检查。
验证要求:按供试品无菌检查规定对各试验菌逐一进行验证;验证用具:1 供试品注射用酒石酸吉他霉素20万单位(批号X08006、X08007、X08008)2 培养基由北京陆桥技术有限责任公司及奥博星生物技术有限责任公司提供2.1 硫乙醇酸盐流体培养基批号:1001292.2 改良马丁培养基批号:1006112.3 营养肉汤培养基批号:200910102.4 玫瑰红钠琼脂培养基批号:1003222.5 营养琼脂培养基批号:1002253 验证试验用菌种名称及其编号:由中检所提供3.1 金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B) 26003];3.2 枯草芽孢杆菌(Bacillus subtilis)[CMCC(B) 63501];3.3 大肠埃希菌(Escherichia coli) [CMCC(B) 44102];3.4 生孢梭菌(Clostridium sporogenes)[CMCC(B) 64941];3.5 白色念珠菌(Candida albicans)[CMCC(F) 98001];3.6 黑曲霉(Aspergillus niger)[CMCC(F) 98003]。
酒石酸吉他霉素可溶性粉(成品)检验记录
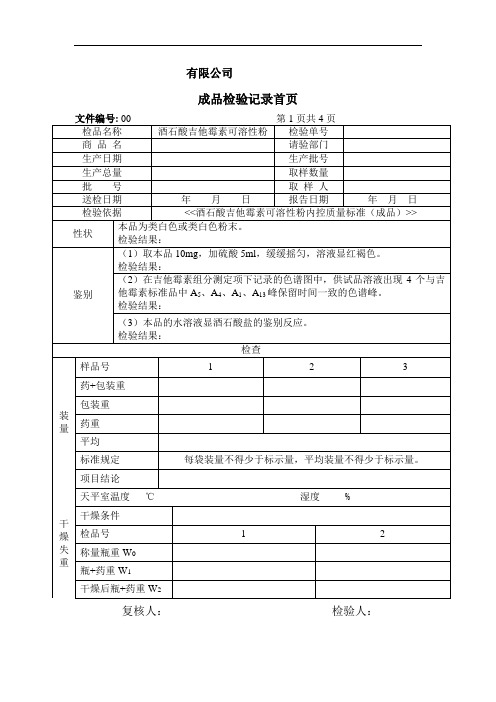
检验结论:
粒度
取本品,通过筛孔为0.45毫米(40目)的颗粒不得少于99%。
检验结论:
含量测定:酒石酸吉他霉素可溶性粉室温:℃湿度:%
效价测定:酒石酸吉他霉素可溶性粉
主要分析仪器
名称
型号
精度
编号
分析天平
0.0001
电热恒温培养箱
高压蒸汽灭菌锅
试验菌:枯草芽孢杆菌
培养基:胨6g
有限公司
成品检验记录首页
文件编号:00第1页共4页
检品名称
酒石酸吉他霉素可溶性粉
检验单号
商品名
请验部门
生产日期
生产批号
生产总量
取样数量
批号
取样人
送检日期
年月日
报告日期
年月日
检验依据
<<酒石酸吉他霉素可溶性粉内控质量标准(成品)>>
性状
本品为类白色或类白色粉末。
检验结果:
鉴别
(1)取本品10mg,加硫酸5ml,缓缓摇匀,溶液显红褐色。
(3)检查
1、外观均匀度应色泽均匀规定
2、干燥失重不得过10.0%规定
3、装量应符合规定规定
4、粒度应符合规定规定
(4)含量测定:
含吉他霉素应为标
示量的92.0%~108.0%。。规定
检验结论:
本品按<酒石酸吉他霉素可溶性粉内控质量标准(成品)>>检验,结果
规定。
备注:
负责人:复核人:检验人:
有限公司
成品检验报告单
文件编号:00第4页共4页
检品名称
酒石酸吉他霉素可溶性粉
检验单号
商品名
请验部门
酒石酸泰乐菌素可溶性粉

酒石酸泰乐菌素可溶性粉生产工艺规程1 产品概述1.1 产品名称通用名:酒石酸泰乐菌素可溶性粉汉语拼音:Jiushisuan Tailejunsu Kerongxingfen1.2 剂型:粉剂1.3 批准文号:1.4 规格:100g:20g(2000万单位)1.5 包装:100g×100袋/箱1.6 贮存:遮光,密闭保存1.7 有效期:两年2 处方和依据2.1 处方2.2 处方依据:本处方依据《中华人民共和国兽药典》2005年版一部酒石酸泰乐菌素可溶性粉项下制订。
3 生产工艺流程图4 操作过程及工艺条件4.1 粉碎过筛4.1.1 如酒石酸泰乐菌素和葡萄糖不能通过五号筛,应进行粉碎。
4.1.2 操作人员按本岗位的操作规程将酒石酸泰乐菌素和葡萄糖分别粉碎,药粉应通过五号筛。
4.1.3 车间质量监督员对粉碎过筛岗位进行检查,符合要求后即可生产。
4.1.4 粉碎过筛后的药粉装入洁净容器中,容器外挂物料状态卡,注明名称、规格、批号、数量、日期、操作者和复核人。
4.1.5 操作人员填写粉碎过筛批记录,并将记录随物料传入称量配料工序。
4.2 称量配料4.2.1 酒石酸泰乐菌素和葡萄糖使用前应再次检查外观情况,确保质量合格。
称量前操作人员应先核对原料的名称、批号、数量、生产单位等。
确认无误后,进行称量配料。
处方计算和称量过程必须由双人操作,一人称量、一人复核,并由质量监督员监督。
操作过程中,操作人员应及时填写称量记录。
4.2.2 称好的物料置于清洁干燥的周转容器内,容器外应挂物料状态卡,注明物料名称、批号、数量、规格、日期、操作人和复核人。
4.3 混合4.3.1混合前操作人员应先核对物料的名称、批号、数量等,确认无误后进行下一步操作。
4.3.2 检查各准备工作无误后,将称量好的原料与辅料依次倒入V型混合机开始混合,混合30分钟。
并保证混合机的装量不超过该机总量的2/3。
4.3.3 经过混合具有均一性的物料为一个批量,编为一个批号。
酒石酸吉他霉素可溶性粉(半成品)内控质量标准
GMP管理文件
一.目的:制定酒石酸吉他霉素可溶性粉半成品的内控质量标准,对生产的产品实施中间控制。
二.适用范围:适用于酒石酸吉他霉素可溶性粉的生产和质量控制。
三.责任者:生产人员、质量监督员、质量检验员。
四.正文:
【物料名称】酒石酸吉他霉素可溶性粉
【质量指标】本品为酒石酸吉他霉素与适宜的辅料配制而成,含吉他霉素应为标示量的93.0%-106.0%.
性状本品为白色或类白色粉末。
鉴别照酒石酸吉他霉素项下的鉴别1、2、3项试验,显相同结果。
【检查】
水分取本品,照水分测定法测定,含水分不得过5.0%。
吉他霉素组分取本品适量,精密称定,加流动相制成每1ml中约含吉他霉素2500单位的溶液,摇匀,滤过,照吉他霉素项下的方法检查,计算,吉他霉素A5应为35%-70%,A4应为5%-25%,A1A13均应为3%-15%。
其他应符合可容性粉剂项下的有关各项规定。
【规格】 100g: 50g。
【贮藏】密闭,在干燥处保存。
酒石酸吉他霉素原料药生产工艺

酒石酸吉他霉素原料药生产工艺酒石酸吉他霉素是一种广泛应用于医疗领域的抗生素,可用于治疗多种细菌感染病,如肺炎、中耳炎、猩红热等。
以酒石酸为原料生产酒石酸吉他霉素是传统工艺,其生产过程涉及发酵、提取、纯化等环节。
一、发酵酒石酸吉他霉素的生产主要是通过罗氏噬菌体培养制备,罗氏噬菌体是一种高等真菌,能够生产吉他霉素。
发酵是整个生产过程的第一步,其目的是通过采用适宜的培养基环境、培养条件、培养时间等方式,促进罗氏噬菌体的快速繁殖和积累。
发酵的基础是选定适宜的培养基。
常见的培养基主要由碳源、氮源、无机盐等组成,同时还添加有维生素、生长因子等营养成分。
适宜的培养基可以满足罗氏噬菌体生长所需的需要,提高其繁殖和积累的速度。
对于罗氏噬菌体的培养条件,首先是温度和酸碱度的控制。
罗氏噬菌体是一种好氧菌,温度在28-30℃时生长最快,而其最适生长的pH值在5-7间。
其次是氧气的供应,罗氏噬菌体需要充足的氧气来进行有氧呼吸,从而获得生长所需的能量。
在罗氏噬菌体的生长过程中,产生了吉他霉素,但其生产量很低。
因此,为了提高吉他霉素的产量,通常需要采用类似旁通式发酵的方法,即在罗氏噬菌体发酵过程中再引入丝点酵母等微生物,使得罗氏噬菌体与丝点酵母之间存在互惠共生的关系,从而促进吉他霉素的生产。
二、提取发酵后,罗氏噬菌体含有吉他霉素等生物分子。
提取的目的是将这些分子从培养基中分离出来,从而得到酒石酸吉他霉素的产物。
提取的基本原则是以有机溶剂为介质,将吉他霉素等生物分子从出发体内抽出,然后通过过滤、浓缩、结晶等方法来得到纯度较高的吉他霉素晶体。
提取时,一般采用甲醇/甲酸双溶剂进行反应,较好的提取效果可以毒蕈碱结合物的浓度增加和硫酸铵沉淀物减少来判断。
三、纯化提取出来的酒石酸吉他霉素仍然含有不少杂质。
纯化的目的是去除杂质,提高酒石酸吉他霉素的纯度。
纯化过程主要采用层析技术,包括凝胶层析、离子交换层析、逆相层析等方法,将不同性质的杂质和酒石酸吉他霉素分离出来。
酒石酸泰乐菌素可溶性粉生产工艺规程

酒石酸泰乐菌素可溶性粉生产工艺规程目录1 产品概述2 处方和依据3 工艺流程图4 制剂工艺过程及工艺条件5 原材料的预处理6 原材料质量标准和检查方法7 中间产品质量标准和检查方法8 成品质量标准和检查方法9 包装规格、包装材料质量标准10 说明书、产品文字说明和标志11 工艺要求12 设备一览表和主要设备生产能力13 技术安全与劳动保护14 劳动组织15 原料消耗定额16 包装材料消耗定额17 动力消耗定额18 综合利用与环境保护目的:制定本标准的目的是规范酒石酸泰乐菌素可溶性粉生产过程,对一定数量的成品所需的起始原料和包装材料,以及工艺、加工说明、技术参数、注意事项等进一步标准化。
适用范围:适用于酒石酸泰乐菌素可溶性粉生产全过程。
责任人:质量部部长、生产部部长、车间主任。
内容:1 产品概述:本品为酒石酸泰乐菌素可溶性粉。
1.1 产品特点:1.1.1性状:本品为白色至淡黄色粉末。
1.1.2规格:10%1.1.3贮藏:密闭,在干燥处保存。
1.1.4有效期:二年1.1.5批准文号:2 处方和依据2.1处方:100g酒石酸泰乐菌素: 10g(泰乐菌素)无水葡萄糖加至100g2.2处方依据:3生产工艺流程图及环境区域划分示意图4 制剂工艺过程及工艺条件4.1总述:按生产指令领取原料药酒石酸泰乐菌素和预处理过的无水葡萄糖,将酒石酸泰乐菌素与无水葡萄糖用等量递增法混合均匀,定量分装即可。
4.2分述:4.2.1投料量:为处方量的整数倍。
5 原材料的预处理5.1称量配料:按生产指令单称取酒石酸泰乐菌素与无水葡萄糖5.2混合:将上述称量好的药粉置V型混合机中,按等量递增法充分混合,每次预混10分钟,总混30分钟,检验含量均匀度合格后,装入洁净不锈钢桶密封并标明名称、规格、批量(或数量)等,填写中间产品交接单,转入中间站。
进行物料平衡计算,收率98.0%~99.9%。
5.3分装:包装用药用铝箔袋除去外包后,进入内包间,按托盘天平、塑料薄膜连续封口机的操作规程操作,分装封口后,经质监员检验合格后移交外包岗位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酒石酸吉他霉素可溶性粉工艺规程制订人审核人批准人制订日期批准日期执行日期烟台金海药业有限公司目录2、处方和依据3、粉剂生产工艺流程及环境区域划分示意图4、工艺过程及条件4.1生产前准备:a.专人检查确认该品种的批生产指令及相应的配套文件,如批记录等是否准备齐全,并是现行文件b.设备器具和现场是否有“清场合格证”c.对设备状况进行检查,挂有“合格”、“已清洁”、“已消毒”标志的设备方可使用。
4.2粉碎工序4.2.1工艺过程4.2.1.1认真核对酒石酸吉他霉素和无水葡萄糖品名、批号等是否与生产指令相符,并有检验合格报告单,确认无误后经清洁或脱去外包装提入暂存室。
将内容物连同内包装一起取出放在干净的容器内,并正确填写盛装单放在该容器内(可扎在袋口上)。
4.2.1.2对酒石酸吉他霉素和无水葡萄糖进行检查,用五号筛试筛,应全部通过五号筛,如不符合要求,则按生产工艺要求,粉碎至规定细度,并用振荡筛进行过筛。
如符合要求,则可不粉碎。
4.2.1.3 粉碎后的物料装入洁净容器中,贴上标志,注明名称、规格、批号、数量、日期、操作者等。
4.2.1.4. 每批物料粉碎结束后,须对粉碎机进行清洗,以防止改变品种时相互污染。
4.2.2工艺条件及质量控制点4.2.2.1粉碎岗位应有除尘设施,并控制尾气排放中粉尘不得超标。
4.2.2.2当水分过高时,要先干燥后再粉碎4.2.2.3.粉碎后药粉应全部通过五号筛。
4.3 干燥4.3.1酒石酸吉他霉素原料药原料水分小于4.0%,无须进行干燥,可直接投料。
4.3.2因辅料为无水葡萄糖,无需烘干。
4.4称量、配料工序4.4.1 工艺过程4.4.1.1直接使用的酒石酸吉他霉素和无水葡萄糖须清洁或除去外包装。
4.4.1.2.称量人认真校对物料名称、批号、数量等,确认无误后按规定的方法和生产指令定额称量,记录并签名。
需要进行计算后称量的物料,计算结果先经复核无误后再称量。
4.4.1.3 称量必须复核,复核人校对称量后的物料的名称、重量,确认无误后记录、签名。
4.4.1.4 称好的酒石酸吉他霉素和无水葡萄糖分别装于洁净容器中,备用。
并附上标志,注明品名、批号、规格、数量、称量人、日期等。
4.4.1.5 剩余物料包装好后,及时退回仓库。
4.4.2工艺条件及质量控制点4.4.2.1 称量前要对称重用的磅称和电子台秤进行校零,电子台秤的量程要符合称量的重量要求,1Kg以下的物料的称量,要用电子台秤。
4.5 混合工序4.5.1 工艺过程4.5.1.1 混合前核对确认物料的品名、批号、数量等。
4.5.1.2 按照处方要求,先称取大约一半无水葡萄糖放到V型混合机的混料罐中,然后加入已称量好的100Kg酒石酸吉他霉素原料,再加入剩余无水葡萄糖后搅拌30分钟,从混合机出料口放出已搅匀的均一性的物料作为一个批次。
4.5.1.3 将混合好的药粉装在清洁加盖的容器内(容器上应贴有半成品标签,标明品名、批号、重量、日期、操作者姓名),及时送入待检室并进行半成品检验。
4.5.1.4每批物料混合结束后,须对混合机进行清洗,以防止改变品种时相互污染4.5.2 工艺条件及质量控制点4.5.2.1混合岗位应有除尘设施,并控制尾气排放中粉尘不得超标。
4.5.2.2混合机的装量一般不超过该机容量的2/3。
4.5.2.3混合机的均匀性效能、产品的投料顺序、混合时间,经过验证,符合要求。
4.5.2.4混合好的半成品通知质保部抽样检测含量及其外观均匀度,快速目视法检查混合后的药粉均匀度,应呈均匀的色泽、无花纹与色斑。
4.6 包装4.6.1工艺过程4.6.1.1 根据包装指令和半成品检验合格单,核对物料的品名、批号、数量、规格等。
4.6.1.2 将自动分装机按《自动分装机标准操作规程》要求换好料杯。
4.6.1.3 调节好打码机的生产批号、有效期至及生产日期的号码,在标签上打印号码。
并将第一张标签纳入批包装记录中。
4.6.1.4从包装物暂存室中提出消毒后的包装袋并检查是否合格。
然后将标签根据规定位置贴于包装袋上,贴标签时应随时检查批号清晰与否,贴签端正与否。
4.6.1.5放料、分装。
分装过程中应随时抽查装量4.6.1.6连续式塑料封口机封口,并随时检查封口是否严密。
封好口后计数通过传递窗到外包间。
4.6.2 外包装4.6.2.1检查装箱的数量与装箱规格是否相符,装合格证,封箱,贴箱签。
装箱过程中应随时抽查品名、规格、批号是否正确和内外相符。
4.6.2.2贴箱签时应注意将箱签贴于包装箱规定位置,并检查贴签端正与否。
4.6.2.3包装结束后交库待验区存放,并挂待检标志,化验合格后方可入库。
4.6.2.4包装结束后,要清点、校对包装材料,按包材规定处理,并做好记录。
4.6.3工艺条件及质量控制点4.6.3.1分装过程中随时抽查装量,并作好记录,应符合该制剂半成品质量标准装量检查项下的要求:装量控制在标示量的98-102%,即98.0-102.0g/袋。
平均装量不少于标示装量。
4.6.3.2 要定期对计量分装机的分装速度、分装量差异等性能进行验证。
4.7 清场与清洁4.7.1 每批产品每一个生产阶段完成后,必须由生产操作人员按清洁规程对厂房、设备、容器具等进行清场、清洁,并填写清场记录。
4.7.2 生产部进行复查、QA监督员进行清场检查,合格后由质保部签发《清场合格证》。
4.7.3 各工序接到清场合格证后,方可准备下一批次的生产。
5、生产过程质量控制点6、酒石酸吉他霉素和无水葡萄糖、半成品、成品的质量标准及检查方法酒石酸吉他霉素质量标准 JH-ZJ-02-Y049-01酒石酸吉他霉素检验操作规程 JH-ZJ-03-Y049-01无水葡萄糖质量标准 JH-ZJ-02-F001-01无水葡萄糖检验操作规程 JH-ZJ-03-F001-01酒石酸吉他霉素可溶性粉半成品质量标准 JH-ZJ-02-Z029-01酒石酸吉他霉素可溶性粉半成品检验操作规程 JH-ZJ-03-Z029-01酒石酸吉他霉素可溶性粉成品质量标准 JH-ZJ-02-C029-01酒石酸吉他霉素可溶性粉成品检验操作规程 JH-ZJ-03-C029-01酒石酸吉他霉素可溶性粉半成品质量标准及成品质量标准酒石酸吉他霉素可溶性粉半成品质量标准标准依据:酒石酸吉他霉素可溶性粉成品质量标准酒石酸吉他霉素可溶性粉成品质量标准标准依据:农业部704号公告有效期:7、包装要求与质量标准:7.1 生产部专人按包装指令单定额领取包装袋及标签,办理领料手续,领、发料人均应在领料单上签名。
7.2 生产部专人领取标签后,应按企业标准样本,核对内容、数量或批号,并检查印刷质量,按品种、规格、批号分类存放在包装车间暂存专柜内上锁保管,做好出入数量记录。
7.3 包装时,按包装岗位SOP操作。
7.4包装工序剩余的印有批号及残损的包装,不得退回仓库,应在质保部监督下,指定两人负责销毁,并做好销毁记录。
7.5 标签实用数、残损数及剩余数之和与领用数发生差额时,应查明原因,写出偏差报告。
7.6 内外包装质量标准与规格100g铝箔袋质量标准 JH-ZJ-02-B009-00JH013箱纸箱质量标准 JH-ZJ-02-B005-00酒石酸吉他霉素可溶性粉标签质量标准 JH-ZJ-02-B004-00装箱单质量标准 JH-ZJ-02-B008-00胶带内控标准 JH-ZJ-02-B003-007.7 贮存方法及要求;包装材料必须贮存于专门的仓库,并分类存放,专人管理,不得露天存放。
印有品名、商标等标记的印刷包装材料应专库或专柜存放,应视同标签管理。
所附产品的包装袋样本,见后附页:8、技术经济指标的计算和消耗定额8.1 计算方法8.1.1 成品率:成品量与理论产量之比。
成品率%=成品入库数(袋)/理论产量(袋)×100%,要求:98%-100%理论产量(袋)=原料总投料量(折纯)/标示装量规定装量:100g/袋8.1.2包装袋利用率包装袋利用率%=成品入库数(袋)/包装袋领用数(个)×100%要求:≥98%8.1.3标签利用率标签利用率%=标签实际使用数(个)/标签领用数(个)×100%要求:≥98%8.1.4装箱单利用率装箱单利用率%=成品入库箱数/装箱单领用数(个)×100%要求:≥98%8.1.5每袋粉剂主要原料消耗量单耗=总投料量(不折纯)/成品入库数8.2 消耗定额(以成品率计算)(以每2000袋计算)9、技术安全、工艺卫生及劳动保护9.1技术安全9.1.1机器操作者必须了解机器性能、结构,并能正确使用与维护机器。
9.1.2操作者的身体不得与运行中的机器接触,以免造成人身事故,滚动设备,操作者的衣袖、大襟应收紧,以免被搅入。
9.1.3不允许检修正在运行中机器的任何部位,机器发生故障要停车检修。
9.1.4操作者必须熟练本机器各种可调部分,特别是开关按钮,以随时调节并停车, 防止错开和错调,停车。
9.1.5机器上的一切运转与传动部分应有防护罩。
9.1.6定期检查和校正仪表、衡器、阀门等,避免跑、冒、滴、漏现象的发生。
9.1.7水不能直接冲电器设备、电线,马达要接好地线,不得自行拆卸电器开关等。
9.1.8控制区未经许可不得动火,并严禁吸烟。
9.1.9掌握常规灭火方法,并了解控制区防火设施及逃离通道。
9.1.10生产中如发现设备不能正常工作,应立即停止作业,在未找到故障原因又未修好前,不得强行使用。
9.1.11使用前检查设备运行是否正常。
9.1.12不得随意启动各种机器开关,启动时必须由单人操作,其他人员不得随意操作。
9.1.13不得用湿手触动电源开关或用湿物擦电源开关。
9.1.14不得阻碍、移动防火设施。
9.2 工艺卫生9.2.1人净化程序9.2.1.1进出30万洁净区更衣程序 9.2.1.2人净标准区域30万级区用白色分体防静电洁净服,一般区采用棉工作服。
9.2.2物流程序9.2.3洁净区消毒利用O 3对空间消毒;用75%乙醇, 0.2%新洁尔灭对地面、物品和设备表面消毒。
9.2.4洁净度要求为30万级,尘粒最大允许数/m 3:≥0.5μm ,尘粒≤10500000个微生物最大允许数:沉降菌≤5个/皿。
9.3劳动保护9.3.1生产操作时,严格按各岗位标准操作规程进行操作,穿戴好劳动保护用品。
9.3.2工作服要求9.3.2.1洁净区白色衣裤、帽、布鞋、手套。
9.3.2.2一般生产区浅灰色衣裤、帽、布鞋,视岗位需要戴手套。
10、劳动组织与岗位定员:11、生产设备及主要设备生产能力:粉散剂片剂车间生产设备一览表及主要设备生产能力.。
