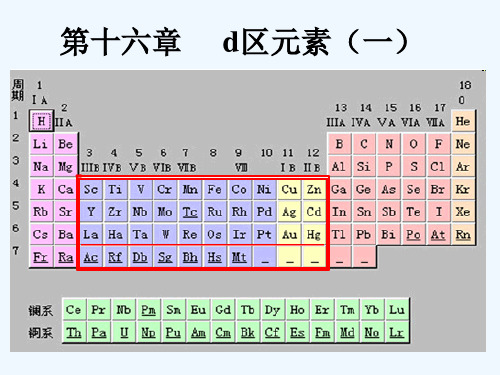
d区元素(一)知识学习
无机化学课件16-d区元素(一)

4
Cr2O72 H2O (橙)
pH<2:Cr2O72-为主,pH>6:CrO42-为主。 编辑ppt
(4) Cr(Ⅵ) 的难溶盐
铬酸盐比相应的重铬酸盐溶解度小。 K sp (Ag2CrO4) 1.1×1012 K sp (Ag2Cr2O7 )2.0×107
(3) Cr(Ⅵ) 含氧酸及其离子在溶液中的转化
•H2Cr2O7, H2CrO4均为强酸,仅存在于稀溶液
HC2rO7 H Cr2O72 Ka2 0.85
H2CrO4 H HCrO4 Ka1 9.55
HCrO4 H CrO24 •pH的影响
Ka2 3.2×107
2CrO
2 4
2H
(黄)
2HCrO
2. d区元素原子的价电子层构型
(n-1)d1-10ns1-2 (Pd为5s0)
编辑ppt
3. d区元素的3原. 同六子族周半元期径素(除从Ⅲ上B往)外下由原于子镧半系径收增缩大使,其但同五、
Cs 250 Rb
过族 性渡元质元素相素原似的子。半原径子十半分接径近,导致其元素
原子半径/pm
K 200
编辑ppt
16.1.3 d区元素的化学性质
元素
M2/M
EV
可溶该 金属的
酸 元素
E M2/M V 可溶该 金属的 酸
Sc ---
各种酸
Fe -0.409 稀 HCl H2SO4
等
Ti
-1.63
热 HCl HF Co
-0.282 缓慢溶解 在 HCl 等
酸中
V -1.2 (估算值) HNO3, HF 浓 H2SO4 Ni
同多酸和杂多酸及其盐
编辑ppt
第十六章 d区元素复习提纲,及试题

第十六章d区元素(一)预习提纲1、d区元素性质变化的一般规律,包括原子半径,电离能,物理性质,化学性质,氧化态及颜色。
2、钛,钒及其化合物。
3、铬的化合物,铬离子的反应,多酸型配合物结构。
4、锰的重要化合物性质。
水溶液中锰离子的反应。
5、铁,钴,镍重要化合物性质及相应反应。
第十六章复习题一、是非题:1、从元素钪开始,原子轨道上填3d电子,因此第一过渡系列元素原子序数的个位数等于3d上的电子数。
2、除ⅢB外,所有过渡元素在化合物中的氧化态都是可变的,这个结论也符合与ⅠB族元素。
3、ⅢB族是副族元素中最活泼的元素,它们的氧化物碱性最强,接近于对应的碱土金属氧化物。
4、第一过渡系列的稳定氧化态变化,自左向右,先是逐渐升高,而后又有所下降,这是由于d轨道半充满以后倾向于稳定而产生的现象。
5、元素的金属性愈强,则其相应氧化物水合物的碱性就愈强;元素的非金属性愈强,则其相应氧化物水合物的酸性就愈强。
6、低自旋型配合物的磁性一般来说比高自旋型配合物的磁性相当要弱一些。
二、选择题:1、过渡元素原子的电子能级往往是(n-1)d > ns,但氧化后首先失去电子的是ns 轨道上的,这是因为:A、能量最低原理仅适合于单质原子的电子排布。
B、次外层d上的电子是一个整体,不能部分丢失。
C、只有最外层的电子或轨道才能成键。
D、生成离子或化合物,各轨道的能级顺序可以变化。
2、下列哪一种元素的(Ⅴ)氧化态在通常条件下都不稳定A、Cr(Ⅴ)B、Mn(Ⅴ)C、Fe(Ⅴ)D、都不稳定3、Cr2O3,MnO2,Fe2O3在碱性条件下都可以氧化到(Ⅵ)的酸根,完成各自的氧化过程所要求的氧化剂和碱性条件上A、三者基本相同B、对于铬要求最苛刻C、对于锰要求最苛刻D、对于铁要求最苛刻4、下列哪一体系可以自发发生同化反应而产生中间氧化态离子?A、Cu(s) + Cu2+(aq)B、Fe(s) + Fe3+(aq)C、Mn2+(aq) + MnO42-(aq)D、Hg(l) + HgCl2(饱和)5、下列哪一种关于FeCl3在酸性水溶液的说法是不妥的?A、浓度小时可以是水合离子的真溶液B、可以形成以氯为桥基的多聚体C、可以形成暗红色的胶体溶液D、可以形成分子状态的分子溶液。
无机化学大连理工第十六章-d区元素(一)-习题解

第十六章 d区元素(一) 习题解1.完成并配平下列反应方程式。
(1)2TiO2+ + Zn + 4H+→2Ti3+ + Zn2+ + 2H2O(2)2Ti3+ + 3CO32- + 3H2O →2Ti(OH)3(s) + 3CO2(g)(3)TiO2 + H2SO4(浓) →TiOSO4 + H2O(4)TiCl4 + 3H2O →H2TiO3(s) + 4HCl(5)TiCl4 + 2Mg →2MgCl2 + Ti(s)2.完成并配平下列反应方程式。
(1)V2O5 + 2Cl- + 6H+→2VO2+ + Cl2(g) + 3H2O(2)2NH4VO3→V2O5 + 2NH3(g) + H2O (加热)(3)2VO2+ + SO32- + 2H+→ 2VO2+ + SO42- + H2O(4)5VO2+ + MnO4- + H2O →5VO2+ + Mn2+ + 2H+3.已知下列电对的标准电极电势:VO2+ + 2H++ e-→VO2+ + H2O φθ = 0.9994VVO2+ + 2H++ e-→V3+ + H2O φθ = 0.337VV3+ + e-→V2+φθ = -0.255VV2+ + 2e-→V φθ = -1.2V在酸性溶液中分别用1mol·L-1Fe2+,1mol·L-1Sn2+和Zn还原1mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?解:查附表六可知:Fe3+ + e-→Fe2+φθ(Fe3+/ Fe2+) = 0.769VSn4+ + 2e-→Sn2+φθ(Sn4+/ Sn2+) = 0.1539VZn2+ + 2e-→Zn φθ(Zn2+/ Zn) = -0.7621V当用1mol·L-1 Fe2+还原1mol·L-1的VO2+时,只能得到VO2+离子;当用1mol·L-1 Sn2+Z 在酸性溶液中还原1mol·L-1的VO2+时,首先被还原为VO2+离子,可继续被被还原为V3+离子。
d区元素一(相关知识

d区元素一(相关知识d区元素是指周期表中4d及5d轨道上的元素,通常也被称作过渡金属。
它们在化学性质上表现出中等电负性、高离子化能、高化合价、易氧化以及形成带有镍白色或银白色的亮泽金属外观等特点。
这些元素的最外层电子组态为ns2(n-1)d,在化学反应中,它们借助着这些d轨道上的电子来提高反应速率、稳定物种的结构以及调节电荷分布。
这些元素在生命过程中扮演着很重要的角色,同时也是一些基础材料和高科技产业的重要组成部分,例如高温合金、电池、合成纤维以及电子器件等。
d区元素从第四周期开始,元素逐渐变得稀有,其中的超过一半元素被定性为稀有金属元素。
这些元素的多项化学性质受到它们的外层d轨道上电子的影响。
这些d轨道上的电子数量众多,容易形成配合物,因此它们具有强的络合能力和催化活性。
另外,d区元素之间的相互作用也属于d-d键,因此它们的反应机理也具有研究价值。
d区元素的原子半径比p区的元素要大,因为它们拥有更多的电子,同时原子序数越大,原子半径也会越来越小。
在同一周期内,d区元素的离子半径比p区元素要小,这是因为它们已经失去了一部分电子,离子半径因此变小。
在化学反应中,d区元素通常会表现出它们的多价性,这是因为d轨道上电子的容易发生氧化还原反应,进而形成不同价态的离子。
在配位化学中,d区元素能够形成大量的稠合配合物,因为它们的d轨道可以用来接受配体的配位键,从而形成稳定的配合物。
d区元素中金属的环境共价能力有时候很强,这也是它们常被用来作为催化剂的主要原因。
例如,在氧化反应中,d区元素可以很容易地释放出氧分子,进而形成氧化物。
在还原反应中,d区元素则可以发生电子传递,将电子传递到其他离子或者分子上。
在这些反应中,p区元素通常没有这样的作用。
从原始形态到纯粹化学物质,d区元素产生了众多的应用。
在纯净状态下,它们被用来制造带有镍白色或银白色的亮泽金属外观,这些金属被广泛应用在制造飞机、汽车和高速列车等交通设施中。
大学无机化学d区元素介绍
3.物理性质
(1) 熔点、沸点高
熔点最高的单质:钨(W)
(2) 硬度大 (3) 密度大
熔点: 3410℃ 沸点: 5900℃
硬度最大的金属:铬(Cr)
以金刚石为10,铬为9
密度最大的单质:锇(Os)
(4) 导电性,导热性,延展性好
22.7gcm-3
4.离子呈现多种颜色
物质显色的原因是由于可见光作用到物质上以后物质
12.2.3(2)钒的化学性质
•价电子层结构3d34s2,主要氧化态+5,也能形成氧化态为 +4,+3,+2的化合物。化学性质相当复杂。
VO2+ 1.0 VO2+ 0.36 V3+
-0.25
-0.25
V2+ -1.2 V
17
12.2.3(3)钒的氧化物(V2O5)
•酸碱性: VO碱O2+ 2C +2Cl2 = TiCl4 +2CO 四氯化钛是无色液体,有剌鼻的气味,极易水解, 在潮湿的空气中由于水解而发烟——利用此反应可 制造烟幕:
•TiCl4高温氧化制备优质钛白——氩气氛保护下得Ti: TiCl4(l) +Mg = Ti +2MgCl2
16
12.2.3(1) 钒
•钒在地壳中的含量比锌、铜、铅等普通元素还要多,但分 布很分散,属稀有元素。 •钒被广泛用于制造特种钢和催化剂。
在钛的化合物中,以+4氧 化态的化合物最稳定。二 氧化钛在自然界中有三种 晶型:金红石、锐钛矿和 板钛矿。其中最重要的是 金红石,天然金红石中因 含少量杂质而呈红色或橙 色。
金红石的结构
13
12.2.1(3) 化学性质
•室温下金属钛较稳定,但受热时,钛可与许多非金属,如: 氧、氮、碳、卤素等反应。 •钛在室温下不能与水或稀酸反应,但可溶于浓盐酸或热的 稀盐中形成三价钛离子:
湖南理工学院无机化学习题库第16章d 区元素(一)

第16章 d 区元素(一)一是非题1.按照酸碱质子理论,[Fe(H2O)5(OH)]2+的共轭酸是[Fe(H2O)6]3+, 其共轭碱是[Fe(H2O)4(OH)2]+。
()2. 由Fe3+能氧化I-,而[Fe(CN)6]3-不能氧化 I-,可知[Fe(CN)6]3-的稳定常熟小于[Fe(CN)6]4-的稳定常数。
()3. 某溶液中共存有NO− , Cr O 2− , K + , Fe3+ , Cl −I 和I-,并无任何反应。
()GAGGAGAGGAFFFFAFAF4. 在[Ti(H2O)6]3+配离子中,Ti3+的d轨道在H2O的影响下发生能级分裂,d 电子可吸收可见光中的绿色光而发生d-d 跃迁,散射出紫红色光。
()5. 在 M n+ +ne ====M 电极反应中,加入M n+的沉淀剂,可使标准电极电势Eθ的代数值增大,同类型的难溶盐的K sp值越小,其Eθ的代数值越大。
()二选择题1. 下列过渡元素中能呈现最高氧化数的化合物是()⑴ Fe⑵ CoGAGGAGAGGAFFFFAFAF⑶ Ni⑷ Mn2. Fe3O4与盐酸作用的产物为()⑴ FeCl3+H2O ⑵ FeCl2+H2O⑶ FeCl3+FeCl2+H2O ⑷ FeCl3+Cl2GAGGAGAGGAFFFFAFAF3. Co3O4与盐酸作用的产物为()⑴ CoCl2+H2O ⑵ CoCl3+CoCl2+H2O ⑶CoCl2+Cl2+H2O ⑷ CoCl3+ H2O4. 欲除去 FeCI3中含有的少量杂质 FeCI2,应加入的物质是()⑴通 CI2⑵KMnO4⑶HNO3⑷ K2C r2O75. 下列哪个溶液中,当加入 NaOH 溶液后,仅有颜色发生变化而无沉淀生成的是()⑴ FeSO4⑵KMnO4⑶GAGGAGAGGAFFFFAFAFNiSO4⑷ K2 Cr2O76. 欲制备Fe2+的标准溶液,应选择的最合适的试剂是()⑴ FeCI2溶于水⑵硫酸亚铁铵溶于水⑶ FeCI3溶液中加铁屑⑷铁屑溶于稀酸7. 用来检验 Fe2+离子的试剂为()GAGGAGAGGAFFFFAFAF⑴ NH4SCN ⑵ K3[Fe(CN)6]⑶ K4[Fe(CN)6]⑷ H2S8. 用来检验 Fe3+离子的试剂为()⑴ KI ⑵NH4SCN ⑶ NaOH⑷ NH3·H2O9. [Co(CN)6]4-与[Co(NH3)6]2+的还原性相比较()⑴ [Co(NH3)6]2+还原性强⑵ [Co(CN)6]4-还原性强GAGGAGAGGAFFFFAFAF⑶两者都强⑷两者都不强10 CoCl3·4NH3用H2SO4溶液处理再结晶, SO 可取代化合物中的 Cl-,但NH3的含量不变,用过量AgNO3处理该化合物溶液,每摩尔可得到1mol的AgCl沉淀这种化合物应该是()⑴ [Co(NH3)4]Cl3⑵ [Co(NH3)4Cl]Cl2⑶ [Co(NH3)4Cl2]Cl⑷ [Co(NH3)4Cl3]GAGGAGAGGAFFFFAFAF11. 由 Cr2O3出发制备铬酸盐应选用的试剂是()⑴浓 HNO3⑵ KOH(s) +KCIO3(s) ⑶CI2⑷H2O212. 下列哪一种元素的氧化数为+ IV 的氧化物,通常是不稳定的()⑴ Ti ( IV ) ⑵V( IV ) ⑶Cr( IV ) ⑷ Mn ( IV ) 13. 镧系收缩的后果之一,是使下列哪些元素的性质相似()GAGGAGAGGAFFFFAFAF⑴ Sc 和 La ⑵Cr 和Mo ⑶ Fe、Co 和Ni ⑷ Nb 和 Ta14. 下列各组元素中最难分离的是()⑴ Li 和 Na ⑵ K 和Ca ⑶ Cu 和Zn ⑷ Zr 和 Hf15. 在酸性介质中,欲使 Mn2+氧化为 MnO4,采用的氧化剂应为()⑴ H2O2⑵王水⑶ K2C r2O7+ H2SO4⑷ NaBiO3GAGGAGAGGAFFFFAFAF16 . 向 FeCl3溶液中加入氨水生成的产物之一是()⑴Fe(NH)⑵Fe(OH)Cl2⑶Fe(OH)2Cl ⑷ Fe(OH)317. 下列物质不能在溶液中大量共存的是()⑴ Fe(CN)和OH-⑵Fe(CN)和I-⑶ Fe(CN)和I-⑷Fe3+和Br18. 下列新制出的沉淀在空气中放置,颜色不发生变化的是()GAGGAGAGGAFFFFAFAF⑴ Mg (OH)2⑵Fe(OH)2⑶Co(OH)2⑷ Ni(OH)219. 下列化合物中与浓盐酸作用没有氯气放出的是()⑴ Pb2O3⑵Fe2O3⑶ C o2O3⑷ Ni2O320. 酸性条件下 H2O2与 Fe2+作用的主要产物是()GAGGAGAGGAFFFFAFAF⑴ Fe, O2 和 H+⑵ Fe3+和H2O ⑶ Fe 和H2O ⑷ Fe3+和O2三填空题1. 在地壳中储量居前十位的元素中属于过渡金属的有2. 向 FeCl3溶液中加入KSCN溶液后,溶液变为色,再加入过量的NH4F溶液后,溶液又变为色,最后滴加NaOH溶液时,又有生成。
d区金属
后果
(1) Y3+半径88pm落在Er3+88.1pm附近,Y进入稀土元素。 Sc半径接近Lu3+,常与Y3+共生,Sc也成为稀土元素。 (2) Zr与Hf、Nb与Ta、Mo与W三对元素半径十分接近、化 学性质十分相近,常伴生在一起,难以分离。 Zr(IV) Nb(V) Mo(VI)
80pm
Hf(IV) 79pm
度大,是宇航、航海、化工设备等的
理想材料。
• 强度好: Al的2-3倍,Mg的5倍 耐热合金用于飞机发动机 • 刚性大 : 约为钢的一半,比AlMg大 钛能与骨骼肌肉生长在一 • 质轻: 4.54g/ml钢的一半 起,称为“生物金属”。 时 间 强度/重量比: 1957 1968 1948 1952 金属中最大 1978 1990 2000 • • 抗腐蚀: 960 2000 钛关节 104005 21000 420000 年产量/T 3 与不锈钢相同,对海水与铂同 45053
所以第五和第六周期的同副族 元素及其化合物,性质相似, 结构相似,以致给分离工作带 来了困难。
ý É ª Ø Ó ë ¶ ¹ ¶ Ô Ë Ô ×°¾ 200 190 180 170 160 150 140 130 120 110 100 20 30
六
五 四
同 族 从 上 到 下 原 子 半 径 略 增 加
Cr -0.90 稀 HCl H2 SO4 Cu +0.339 HNO3 , 浓 热 H2 SO4
Mn -1.18 稀 HCl H2 SO4 等 Zn -0.762 稀 HCl H2 SO4 等
可溶该 金属的 酸 元素
各种酸 Fe -0.409 稀 HCl H2 SO4 等
M
2
d区元素课件

d区元素
§16.1 铜族元素
一.铜族元素的单质 1.存在 单质:Cu, Ag, Au 矿物:孔雀石:Cu2(OH)2CO3
辉银矿:Ag2S 碲金矿:AuTe2 砂金
2.物理性质 (1) 特征颜色:Cu,Ag, Au (2) 溶、沸点较其它过渡金属低 (3)导电性、导热性好,金属中居首位
Ag>Cu>Au
电解铜,99.9%;电解铝,99.5%。
(4) 金属光泽,延展性好
金可作首饰,编织成各 种形状。一克金能抽成 3公里长的丝,金箔可做 成0.0001 mm的薄片。
3.化学性质 (1) 与O2作用
碱式碳酸铜 Au Ag不与O2发生反应, 当有沉淀剂或配合剂存在时,可反应。
Cu,Ag,Au单质活性依次下降, Cu,Ag可溶 于氧化性酸, Au只溶于王水。
§16.2 锌族元素
一、锌族元素的单质
存在 闪锌矿:ZnS,
(1) 低熔点
物 理
Zn:419℃
性
Cd:321℃
辰砂:HgS 富山事件
质
Hg:-39℃ 日本九州水俣事件
(2) 易形成合金
黄铜:Cu-Zn
汞齐:Na-Hg、Au-Hg、Ag-Hg
化学性质 (1) 与O2的作用:(在干燥空气中稳定) 潮湿:
二、 铜族元素的化合物
1价铜离子d10结构,其化合物难溶于水,固 态时比2价铜的化合物稳定。
难溶物:
CuCl CuBr CuI CuSCN CuCN Cu2S
K
sp
大
小
铜的配合物
Cu(I)的配合物多为2配位
配合物:CuCl2-,CuBr2-,CuI2-,Cu(SCN)2-,Cu(CN)2-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cu(Ⅱ)
• 过渡元素的配离子通常具有颜色。其颜色 是由于配离子吸收了一部分可见光 (400nm~ 800nm)而发生d—d跃迁所造成。
[Ti(H2O)6]3+ 的吸收光谱
• 某些具有颜色的含氧酸根离子,如 CrO42-(黄
色), MnO4- (紫色)等,其颜色是由电荷迁移
引起的。 2021/2/6
Cr3+(aq)
• 铬元素的电势图
EA /V
Cr
2
O
2 7
1.33
Cr 3 -0.41 Cr 2 -0.91 Cr
-0.74
EB /V
CrO
2 4
-0.12
Cr(OH)
4
-1.1
Cr(OH) 2
-1.4
Cr
-1.3
2021/2/6
20
1.铬(Ⅵ)的化合物
(1) Cr(Ⅵ) 化合物的制备:碱熔法
14
§23.2 钛 钒
2021/2/6
15
§23.3 铬 钼 钨 多酸型配合物
23.3.1 铬、钼、钨的单质 23.3.2 铬的化合物 *23.3.3 钼、钨的化合物 *23.3.4 多酸型配合物
同多酸和杂多酸及其盐
23.3.1 铬、钼、钨的单质
铬分族(VIB):Cr, Mo, W, Sg
价层电子构型:(n-1)d 4-5ns1-2
灰白色金属,熔沸点高,硬度大。 表面易形成氧化膜。
室温时纯铬溶于稀HCl,H2SO4,在浓 HNO3中钝化。高温下与活泼的非金属及 C,B,N反应。
2021/2/6
17
23.3.2 铬的化合物
Cr2O3 (铬绿)
2021/2/6
18
水溶液中铬的各种离子
Cr2+(aq)
Cr2O
27
CrO
24
Cr(OH)-4
稀 HCl H2SO4
Cu +0.339
HNO3,浓 热 H2SO4
Mn
-1.18
稀 HCl H2SO4
等 Zn
-0.762
稀 HCl H2SO4
等
2021/2/6
8
1. 第一过渡系的单质比第二过渡系的单质
活泼;
例:第一过渡系除Cu外均能与稀酸作用,
第二、三过渡系仅能溶于王水、
氢氟酸,而Ru,Rh,Os,Ir不溶于王水。
V
可溶该
金属的 各种酸
酸
元素
Fe
E M2/M -0.409 V
可溶该 稀 HCl
金属的 酸
H2SO4 等
Ti
-1.63
热 HCl HF Co
-0.282 缓慢溶解 在 HCl 等
酸中
V -1.2 (估算值) HNO3, HF 浓 H2SO4 Ni
-0.236
稀 HCl H2SO4 等
Cr -0.90
2021/2/6
Cr Mn Fe Co Ni
+2 +2 +2 +2 +2
+3 +3 +3 +3 +3
+4
+4 +4
+6 +6 +7
+6
(划横线表示常见氧化态)
左 氧化态先升高后降低 右 上 同族
高氧
化态
趋向
下 稳定
11
关于第一过渡系元素(广义)的氧化态分布,可以归
纳为两条规律:
●第一过渡系元素的氧化态呈现两头少,中间多,
23.1.1 d区元素的原子半径和电离能
1.d区元素在周期表中的位置
2021/2/6
3
2. d区元素原子的价电子层构型
(n-1)d1-10ns1-2 (Pd为5s0)
3. d区元素的原子半径
2021/2/6
4
4.d区元素的第一电离能
总趋势:同周期 左右由小大,幅度不大。
同副族 不规律。
2021/2/6
5
23.1.2 d区元素的物理性质
•熔点、沸点高 熔点最高的单质:钨(W)
•硬度大
硬度最大的金属:铬(Cr)
•密度大
密度最大的单质:锇(Os)
•导电性,导热性,延展性好。
2021/2/6
6
2021/2/6
熔 点 变 化 示 意 图
7
23.1.3Biblioteka d区元素的化学性质元素Sc
E M2/M
---
E Zn2/Zn 0.762V E Cd2/Cd 0.402V E Hg2/Hg 0.852V
总趋势:从上到下活泼性降低。
2021/2/6
10
23.1.4 d区元素的氧化态
元 素 Sc Ti V
+2 +2
+3 +3 +3
氧化态
+4 +4
+5
Fe +2、+3 Ru +4 Os +4、+6、+8
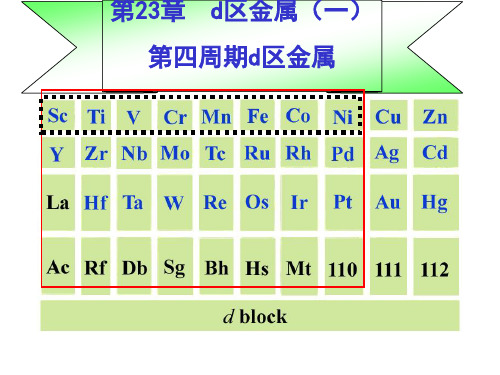
第二十三章 d区元素(一)
§23.1 d区元素概述
§23.2 钛 钒 §23.3 铬 钼 钨 多酸型配合物 §23.4 锰 §23.5 铁 钴 镍
§23.1 d区元素概述
23.1.1 d区元素的原子半径和 电离能
23.1.2 d区元素的物理性质 23.1.3 d区元素的化学性质 23.1.4 d区元素的氧化态 23.1.5 d区元素离子的颜色
两头低,中间高的趋势。
这是由于过渡系元素前面的d电子数少,而后面的
元素d电子虽然多,但由于有效核电荷从左到右增加使d
轨道能量降低,电子被原子核束缚较牢,不易参与成键
的缘故。相反,中间元素d电子较多,有效核电荷不大
也不太小,因而其氧化态多。
●假如在元素的氧化态分布表中划两条直线:一条
是从Sc(+3)到Mn(+7)的直线,处于这条直线的氧化态
② 2021/2/6 2Na 2CrO 4 H 2SO 4
Na 2Cr2O7 Na 2SO 4H221O
(2) 以K2Cr2O7为原料制备其他含铬化合物
浓H2SO4
CrO3(铬酐)
NH3 冷却
Fe(CrO2)2(s) 1000 ℃ ~1300℃ Na2CrO4(s) H2O
Na2CO3 (s)
①
Fe2O3 (s) 浸取
Na2CrO4 H2SO4 Na2Cr2O7 KCl Na2Cr2O7
(aq) 酸化 (aq)
②
K2Cr2O7
① 4Fe(CrO 2 )2 8Na 2CO 3 7O 2 2Fe 2O3 8Na 2CrO 4 8CO 2
2. 与活泼非金属(卤素和氧)直接形成化合物。
3. 与氢形成金属型氢化物:
如:VH18,TaH0.76,LaNiH5.7 。 4. 与硼、碳、氮形成间充型化合物。
2021/2/6
9
E (Ni2+/Ni) =-0.2363V
E (Pd2+/Pd) = +0.92V E (Pt2+/Pt) = +1.2V(估计值)
都是元素较稳定的最高氧化态,它相当于从Sc到Mn各元
素的价电子数的总和。第二条直线是从Mn(+2)到Zn(+
2),处于这条直线的氧化态是各元素的较稳定的低氧化
态,相应于元素的原子失去4s电子。
2021/2/6
12
23.1.5 d区元素离子的颜色
Mn (Ⅱ) Fe(Ⅱ) Co(Ⅱ) Ni(Ⅱ) Fe(Ⅲ)
