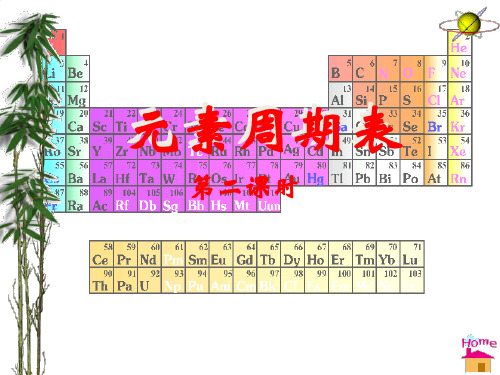
碱金属和卤族元素 ppt课件
合集下载
4.1.2碱金属和卤族课件高一上学期化学人教版

置是
AC
A.第三周期 B.第二周期
C.第Ⅳ主族 D.第Ⅴ主族
6.下列各氢化物中,稳定性由强到弱的顺序正确的是( C )
A. AsH3>NH3>PH3 B. PH3>AsH3 >NH3 C. NH3>PH3>AsH3 D. NH3>AsH3 >PH3
元素的非金属性的判断依据
1.根据元素周期表判断:同一主族从上到下非金属性减弱 2.根据元素单质与氢气反应的难易(易~强)
3.根据氢化物的稳定性 (稳定~强) 4.根据元素最高价氧化物的水化物(含氧酸) 的酸性强弱 (强~强) 5.根据置换反应 6、对应阴离子的还原性强弱判断。非金属阴离子还原性越弱, 则元素非金属性越强。
Li
3
Na 11
K
19
Rb 37
Cs 55
原子半径增大 电子层数递增
核电荷数增大
1
2
1
3
1
4
1
5
1
6
相似性: 最外层都有1个电子,都易失电子,化学性质 相似,表现金属性(单质:还原性)。 随着核电荷数递增,原子电子层数递增,原子半径
逐渐增大,原子核对最外层电子的引力逐渐减 弱,金属性逐渐增强。
(1实)钠验、现钾象与:O2金的属反钾应被加热后熔成金属小球,并且剧 烈燃烧,发出紫色火焰。生成黄色固体 只是其中一个反应
(2)钠、钾与H20的反应
实验现象: 金属钾浮在水面上, 剧烈反应,听到微弱 的爆鸣声,并且出现 紫色的火光。
比钠剧烈
碱金属与氧气、水反应比较
单质
与O2反应
与水反应
Li
Li2O
剧烈 产生氢气
Na Na2O、Na2O2 更剧烈 产生氢气
K K2O、K2O2、KO2 轻微爆炸
元素周期表――(碱金属卤素核素)PPT课件

钠
钾
与氧气 剧烈燃烧,
剧烈燃烧,火
反应 火焰呈 黄 色, 焰呈 紫 色
生成 淡黄 色的 固体
①与非金属的反应(以O2为例)
元素 条件 现象 产物 结论
Li 加热 Na 加热
燃烧,较 Li2O 不剧烈
燃烧,剧 Na2O2 烈
从Li— Cs,随 电子层 数的递
稍加热 燃烧,更 更复杂的 增,单
K
剧烈
氧化物K02 质还原
是 KF、 AlCl3
。
(2) 能跟溴水混合而共存的
是 KF、AlCl3、MgBr2
。
(3) 能跟碘水混合而共存的
是 都可
。
2、X、Y是元素周期表第ⅦA族中的两种元 素,下列叙述能说明非金属性X比Y强的是
( C)
A、X原子的电子层数比Y原子的电子层数多 B、Y的单质能将X从NaX的溶液中置换出来 C、X的单质比Y的单质更容易与氢气反应 D、同浓度下,X的氢化物水溶液比Y的氢化 物水溶液的酸性强
⑵、卤素单质物理性质的比较
Ⅰ、相似性 ①均有颜色 ②均有毒 ③在水中的溶解性不大(F2除外) ④均易溶于苯、汽油、CCl4等有机溶剂 (F2除外) (苯、汽油的密度比水小, CCl4的密度比水大)。
Ⅱ、递变性
按F2、Cl2、Br2、I2的顺序,随分子量的增大 ①从气态→液态→固态 ②颜色依次变深 ③密度依次增大 ④熔、沸点依次升高 ⑤溶解度( F2除外)逐渐减小。
②卤素单质间的置换反应 P9 实验1-1
实验
现象
离子方程式
1、饱和氯水 分层,下层呈橙 与NaBr溶液 红色
2、饱和氯水 分层,下层呈现 与KI溶液 紫红色
3、溴水与KI溶 分层,下层呈现
碱金属与卤素 全 1PPT课件
卤素单质与氢气反应
卤素单质与氢气反应 剧烈程度:F2>Cl2>Br2>I2 生成氢化物稳定性:HF>HCl>HBr>HI
同一主族中,随原子核外电子层数增加, 得电子能力逐渐减弱失电子能力逐渐增强, 非金属性逐渐减弱,金属性逐渐增强。
为什么卤族单质与氢气反应的条件不同,生 成物的稳定程度也不同呢?与性质有关系吗?
总结: 碱金属的原子结构 Li Na K Rb Cs
1. 最外层上 相 都只有一 似 个电子 性:
化学性 质相似
1) 都易失电子表现强 还原性
2) 化合物中均为+1价
2. 递
核电荷数
变 电子层数
性:
原子 半径
核对 失 最外 电 层电 子 子的 能
还 原 性
金 属 性
引力 力
(电子层数的影响大于核电荷数的影响)
A、同位素的相对原子质量:
如:816O的相对原子质量 = 2.657*10-26 kg/[(1/12)*1.993*10-26 kg]
= 16.00
B、核素的近似原子质量: 如: 816O的近似相对原子质量为16。
C、元素的相对原子质量:
如:氯元素的同位素有:1735Cl 1737Cl 两种, 相对原子质量为 34.969 36.966
重水反应堆
以重水堆为热源的核电站。重水堆是以重水作慢化剂的 反应堆,可以直接利用天然铀作为核燃料。重水堆可用轻 水或重水作冷却剂,重水堆分压力容器式和压力管式类。 重水堆核电站是发展较早的核电站,有各种类别,但已实 现工业规模推广的只有加拿大发展起来的坎杜型压力管式重 水堆核电站。
放射性C-14射线测定装置
Na 11 银白色, 柔 0.97 97.81 软
4.1.2碱金属元素、卤族元素课件高一上学期人教版化学必修第一册

4Li + O2 2Li2O
R
NaCl / KCl
2Na + O2 Na2O2
2Na + 2H2O =2NaOH + H2↑ 2K + 2H2O = 2KOH + H2↑ 2Na + 2H+ =2Na+ + H2↑
填写下表(课本93页),并回答相应问题
元素 名称
元素符号
核电荷数
原子结构示意图
最外层电 子数
④砹的原子序数大于碘,根据同族元素性质的递变规律可以推测,At2 与氢气化合较难,砹
化银也难溶于水,故④ 正确; ⑤元素的非金属性强弱与其对应氢化物的酸性强弱无关,因此由Cl 、Br 、I 的非金属性逐 渐减弱,无法推出 HCl 、 HBr 、 HI 的酸性强弱,故⑤错误; ⑥ Li 的密度比煤油小,不能保存在煤油中,应该保存在石蜡中,故⑥错误; ⑦F、Cl 、Br 、 I 位于同一主族,原子序数逐渐增大,电子层数增多,原子半径增大,原子 核对最外层电子的吸引 力减小,得电子的能力逐渐降低 ,故非金属性逐渐减弱 ,故 ⑦正确; ⑧氧化铯是活泼金属氧化物,易和二氧化碳发生反应,所以碳酸铯不易发生分解反应生成 氧化铯和二氧化碳,故⑧正确。
同主族元素由上到下原子核 外电子层数依次增加, 原子半径逐渐增大; 失电子能力逐渐增强, 得电子能力逐渐减弱; 所以金属性逐渐增强, 非金属性逐渐减弱。
上面我们研究了两个具有代表性的主族:碱金属和卤素。 可以看出元素的性质主要与原子核外电子排布,特别是最外层电子数有关。 原子结构相似的一族元素,他们在化学性质上表现出相似性和递变性。
应该表现相似的化学性质,
所以锂、钾与氧气、水应该都能发生反应
实验探究:碱金属元素的化学性质的比较
碱金属元素PPT精品课件

2. 纸的发明 西汉前期,人们从“积漂絮成絮 片”中得到启示,发明了纸
西汉早期麻纸(甘肃放马滩出土) (质脆、书写不流畅)
二、医学
张仲景 东汉末年
著名的医学家。著有 《伤寒杂病论》,全面 阐述了中医理论和治病 原则,奠定了我国中医 治疗的基础。后世尊称 他为“医圣”。
《伤寒杂病论》书影
医圣——张仲景
轻微的爆炸,遇水立即燃烧,遇水立即燃烧,
生成H2
爆炸
爆炸
递变性 反应由剧烈到更剧烈,生成的氧化物由简单到复杂
结论
金属性逐渐增强
化学性质
碱金属原子最外层电子数都为1, 容易失去电子被氧化,具有较 强的还原性。并且,从Li到Cs, 随着核电荷数的逐渐增多,电 子层数逐渐增多,原子半径逐 渐增大,核对外层电子的引力 逐渐减弱,失电子的能力逐渐 增强,金属性逐渐增强。
3. 蔡伦改进造纸术
公元105年,蔡 伦改进造纸术。他用 树皮、麻头、破布和 旧鱼网做造纸原料, 扩大了原料来源,降 低了造纸的成本,同 时又提高了纸的产量 和质量。从此,纸逐 步取代竹木简和帛。 为纪念蔡伦的功绩, 人们把这种纸叫作 “蔡侯纸”。
科技领域 代表人物 时 期
主要成就
造纸术
劳动人民
按从Li到Cs的顺序
核电荷数逐渐增大 核外电子层数逐渐增多 原子半径逐渐增大
碱金属原子半径与离子半
径有何关系?
以钠为例:
Na
Na+
图示:
结论:原子半径大于相应 的阳离子半径
原子结构
Li Na K Rb Cs
相同点 递 变 性
最外层都有1个电子 核电荷数逐渐增大
电子层数逐渐增大 原子半径逐渐增大
碱金属元素物理性质有哪 些相同点?
元素周期律及卤素与碱金属的性质递变规律ppt实用资料
___M__g_A__l__S_i__P__S___C_l__A_r_______________
同周期元素原子结构上的相同点为
___电__子__层__数__相__同_________ 不同点为
原子结 构包括:
质__子__数__不__同__,___最__外__层__电__子__数_ 不同 质子数、
与钠同主族的元素有
Cs 泽固体
越越 来来 越越 剧剧 烈烈
实验内容
1、将少量 氯水分别加 入NaBr、KI 溶液中,后 加CCl4 2、将少量 溴水加入KI 溶液中,后 加淀粉溶液
实验现象
CCl4层分 别呈橙红 色、紫色
溶液变 蓝色
实验结论 Cl2可置换出 Br2 、 Ⅰ2, Cl2的氧化性 比Br2 、 Ⅰ2 强
正确,周期数=电子层数 Cl2可置换出Br2 、 I2 ,Br2可置换出 I2
H Li K Rb Cs Fr 5、同主族元素原子的最外层电子数一定相同
7、IA族元素称为碱金属元素,VIIA族元素称 CCl4层分别呈橙红色、紫色
钠、钾分别与水反应 钾与O2反应更剧烈,发出紫色火焰
为卤族元素 同主族元素原子结构上的相同点为_____________________ 不同点为_________________________
得电子能力__增__强______, 失电子能力
原子结构包_括减_:质_子弱数_、_电子_层_数、;最外同层电子主数 族元素从上到下,
原子半径___增_大________, 得电子能力 _____________相似的一族元素,它们在化学性质上表现
________________________
___减__弱_____,失电子能力__增__强________。 钾与O2反应更剧烈,发出紫色火焰
元素周期表、碱金属、卤素.ppt

碱金属的物理性质
颜色和状态 密度 熔点 (g/cm3) (。C) 沸点 (。C)
银白色,柔软 银白色,柔软 银白色,柔软 银白色,柔软 略带金色光 泽,柔软
0.534 0.97 0.86 1.532 1.879
180.5 1347 97.81 882.9 63.65 774 38.89 688 28.40 678.4
返回
课 前 自 主 学 案 课 堂 互 动 讲 练 探 究 整 合 应 用 知 能 优 化 训 练
专题1 微观结构与物质的多样性
课 前 自 主 学 案 课 堂 互 动 讲 练 探 究 整 合 应 用 知 能 优 化 训 练
2.应用 原子 (1)根据元素在周期表中的位置,推测元素的____ ______,预测其主要_________。 结构 性质 (2)研究合成新物质
项目 得失电 子能力 单质的氧化 性、还原性
同周期(从左到右) 得电子能力增强, 失电子能力减弱 还原性减弱、氧化 性增强
同主族(从上到下) 得电子能力减弱, 失电子能力增强 氧化性减弱,还原 性增强
课 前 自 主 学 案 课 堂 互 动 讲 练 探 究 整 合 应 用 知 能 优 化 训 练
最高价氧化 碱性减弱,酸性增 酸性减弱,碱性增 物对应水化 强 强 物的酸碱性 非金属氢化 生成由难到易, 物的生成难 稳定性由弱到强 易和稳定性
生成由易到难,稳 定性由强到弱
返回
专题1 微观结构与物质的多样性
项目 得失电 子能力 单质的氧化 性、还原性
同周期(从左到右) 得电子能力增强, 失电子能力减弱 还原性减弱、氧化 性增强
同主族(从上到下) 得电子能力减弱, 失电子能力增强 氧化性减弱,还原 性增强
课 前 自 主 学 案 课 堂 互 动 讲 练 探 究 整 合 应 用 知 能 优 化 训 练
元素周期表碱金属和卤素课精选PPT

3、卤素单质化学性质
(1)与H2反应 阅读教材P8:“卤素单质与氢气反应”归 纳 通式: X2 + H2 = 2HX
F2
Cl2
Br2
I2
剧烈程度: 反应越来越难
生成的氢化物的稳定性:
HF > HCl > HBr > HI
(2)卤素单质之间的置换反应
2NaBr + Cl2 = 2NaCl + Br2 (溶液由无色变成红棕色)
密度
质
状态
/g·cm-3
Li 银白色,柔软 0.534
Na 银白色,柔软 0.97
K 银白色,柔软 0.86
Rb 银白色,柔软 1.532
Cs 略带金属光泽, 1.879 柔软
熔点 /0C 180.5 97.81 63.65 38.89 28.40
沸点 /0C 1347 882.9 774 688 678.4
(溶液由无色变成紫红色)
6、氟、氯、溴、碘四种元素,它们的下列性质的递变规律不正确的是( )
有颜色,密度小,熔沸点都较低。 2NaBr + Cl2 = 2NaCl + Br2
碱金属元素的性质与结构 7、砹(At)是核电荷数最大的卤族元素,推测砹或砹的化合物最不可能具有的性质是( )
氟(F)、氯(Cl)、溴(Br)、碘(I)
卤族元素原子结构示意图
F
+9 2 7
Cl +17 2 8 7
Br +35 2 8 18 7
I
+53 2 8 18 18 7
卤族元素
1、卤族元素是元素周期表中的第_1_7__纵行, 卤族元素周期表从上到下(F、Cl、Br、I),随着核电荷数的增加,元素原子的电子层数逐渐
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碱金属和卤族元素
碱金属和卤族元素
碱金属
结论
• 碱金属元素最外层电子数均为1;随着 核电荷数的增加碱金属元素原子的最 外层电子数逐渐增加
钾、钠性质实验对比
பைடு நூலகம்意
• 保存在煤油中 • 钠取黄豆大小,钾取绿豆大小,用滤纸擦干表面的煤油,
用小刀切取后立即投入到水中 • 用于加热的坩埚必须干燥,因为二者都会与水反应
华,遇淀粉变蓝。 • 卤素单质在有机溶剂中的溶解度大于在水中的溶解度,颜
色深
• 原子结构相同点:最外层电子是7 • 原子结构不同点(递变性):从F到I,随着核电
荷数的增加,卤族元素原子的电子层数逐渐增多 ,原子半径逐渐增大
卤素单质的化学性质
• 卤素单质与氢气反应的比较
卤素单质间的置换反应实验
卤素单质的物理性质
注意
• 溴是常温下唯一的液态非金属单质 • 卤素单质都有毒,溴在保存时加一些水进行水封,碘易升
• 锂在空气中燃烧只生成Li2O,钠在空 气中生成Na2O2,钾在空气中生成 KO2,铷、铯产物更为复杂
③物理性质特点
注意
• 锂、钠、钾的密度比水小,铷、铯的密度比水大。 • 锂的密度小于煤油,故它只保存在液态石蜡中。 • 钠、钾常温下为固态,而钠钾合金常温下为液态,它是原
子反应堆的导热剂
卤族元素
碱金属元素的原子结构与性质的关系
• ①原子结构特点: • 相同点:最外层都有一个电子 • 不同点:从锂到铯,随核电荷数增加,电子层数增多,原
子半径增大 • ②化学性质特点: • 相似性:碱金属表现出强还原性,都能与氧气等非金属单
质发生反应 • 递变性:从锂到铯失电子能力增强,还原性逐渐增强,即
金属性逐渐增强
碱金属和卤族元素
碱金属
结论
• 碱金属元素最外层电子数均为1;随着 核电荷数的增加碱金属元素原子的最 外层电子数逐渐增加
钾、钠性质实验对比
பைடு நூலகம்意
• 保存在煤油中 • 钠取黄豆大小,钾取绿豆大小,用滤纸擦干表面的煤油,
用小刀切取后立即投入到水中 • 用于加热的坩埚必须干燥,因为二者都会与水反应
华,遇淀粉变蓝。 • 卤素单质在有机溶剂中的溶解度大于在水中的溶解度,颜
色深
• 原子结构相同点:最外层电子是7 • 原子结构不同点(递变性):从F到I,随着核电
荷数的增加,卤族元素原子的电子层数逐渐增多 ,原子半径逐渐增大
卤素单质的化学性质
• 卤素单质与氢气反应的比较
卤素单质间的置换反应实验
卤素单质的物理性质
注意
• 溴是常温下唯一的液态非金属单质 • 卤素单质都有毒,溴在保存时加一些水进行水封,碘易升
• 锂在空气中燃烧只生成Li2O,钠在空 气中生成Na2O2,钾在空气中生成 KO2,铷、铯产物更为复杂
③物理性质特点
注意
• 锂、钠、钾的密度比水小,铷、铯的密度比水大。 • 锂的密度小于煤油,故它只保存在液态石蜡中。 • 钠、钾常温下为固态,而钠钾合金常温下为液态,它是原
子反应堆的导热剂
卤族元素
碱金属元素的原子结构与性质的关系
• ①原子结构特点: • 相同点:最外层都有一个电子 • 不同点:从锂到铯,随核电荷数增加,电子层数增多,原
子半径增大 • ②化学性质特点: • 相似性:碱金属表现出强还原性,都能与氧气等非金属单
质发生反应 • 递变性:从锂到铯失电子能力增强,还原性逐渐增强,即
金属性逐渐增强
