D-Hanks配方
Dhank's液配制
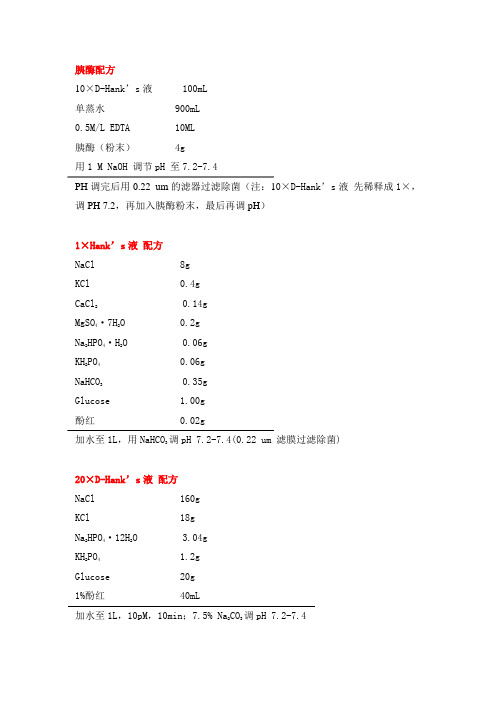
胰酶配方10×D-Hank’s液 100mL单蒸水 900mL0.5M/L EDTA 10ML胰酶(粉末) 4g用1 M NaOH 调节pH 至7.2-7.4PH调完后用0.22 um的滤器过滤除菌(注:10×D-Hank’s液先稀释成1×,调PH 7.2,再加入胰酶粉末,最后再调pH)1×Hank’s液配方NaCl 8gKCl 0.4gCaCl20.14gMgSO4·7H2O 0.2gNa2HPO4·H2O 0.06gKH2PO40.06gNaHCO30.35gGlucose 1.00g酚红 0.02g加水至1L,用NaHCO3调pH 7.2-7.4(0.22 um 滤膜过滤除菌)20×D-Hank’s液配方NaCl 160gKCl 18gNa2HPO4·12H2O 3.04gKH2PO41.2gGlucose 20g 1%酚红 40mL加水至1L,10pM,10min;7.5% Na2CO3调pH 7.2-7.4RPMI1640 配方RPMI1640粉末 10.4gHEPES 4.67gL-G 2 m mol/L,0.292g2-ME(2-巯基乙醇) 1×10-5 mol/L丙酮酸钠 1 m mol/L(0.11g/L)PNC(青霉素) 100IUSM(链霉素) 100IUO 约800mLDH2磁力搅拌3-4小时,充分溶解;用NaHCO约2g,调pH至7.2-7.43DHO加至1000 mL混匀,0.22 um滤器过滤除菌,分装,-20度保存2附:0.01mol/L 2-ME配制:取7 mL 2-ME加入93mL双蒸水(1mol/L),再取1mol/L O至50mL,即成(即:万分之七)。
即70uL至100mL,临时用2-ME0.5mL加ddH2每1L 1640取1mL。
DMEM 配方DMEM粉末 10.4gHEPES 4.67gL-G 2 m mol/L,0.292g2-ME(2-巯基乙醇) 1×10-5 mol/L丙酮酸钠 1 m mol/L(0.11g/L)PNC(青霉素) 100IUSM(链霉素) 100IUDHO 约800mL2磁力搅拌3-4小时,充分溶解;用NaHCO约2g,调pH至7.2-7.43DHO加至1000 mL混匀,0.22 um滤器过滤除菌,分装,-20度保存2。
神经元原代培养 丁香园

(丁香园protocol 2008)一、常规的试剂配制:1、培养基:选用高糖型DMEM/F12 (1:1)培养基干粉(含15 mmol Hepes),每升培养液中加入碳酸氢钠1.8 g,调节pH值7.0,0.22 μm的微孔滤膜过滤除菌后,加入谷氨酰胺、无菌的青霉素和链霉素液,使其终浓度分别为0.5 mmol/L 、100 U/ml和100 μg /ml,分装后置于4℃保存,临用前加入2%的B27。
神经细胞代谢旺盛,选用高糖型培养基;谷胱甘肽可保持培养基还原状态,营养成分稳定;B27是公认的刺激神经元生长的营养因子,不过价格挺贵;PH值很关键,Hepes是优秀的缓冲系统,pH值调好后能保持很长时间;2、多聚赖氨酸溶液的配制:称取1.5 mg L-多聚赖氨酸溶于100 ml PBS,0.22 μm的微孔滤膜过滤除菌,密封后置于4 ℃保存,可长期使用;3、磷酸盐缓冲液(PBS)的配制:称取8.0 g NaCl、0.2 g KCl、2.85 g Na2HPO4•12H2O 和0.2 g KH2PO4充分溶于900 ml dd H2O,调节pH值为7.2,补dd H2O至1000 ml并分装,高压灭菌(121~126 ℃),4 ℃备用;4、D-Hanks液的配制:称取KCl 0.4 g,KH2PO4 0.06 g,NaCl 8.0 g,NaHCO3 0.35 g,Na2HPO4•12H2O 0.08 g,溶于dd H2O中,调节PH值为7.2,定容至1000 ml,高压蒸汽灭菌(121~126 ℃),4℃备用;5、0.25%胰蛋白酶的配制:称取0.25 g胰蛋白酶粉末,少许D-Hanks溶液调成糊状,用D-Hanks定容至100 ml,混匀,冰箱内放置过夜,滤纸过滤后,0.22 m微孔滤膜过滤,分装,-20 ℃保存。
二、试验操作过程:1、包被:培养前晚上将培养瓶(板)用多聚赖氨酸包被10 min,吸除,无菌操作台上15min 自然晾干,置于培养箱中备用;2、取脑:选取新生24 h的SD大鼠数只,雌雄不限,75%酒精全身消毒,断头处死,无菌条件下分层剪开头皮、颅骨,用弯镊拉开脑区视野,小心取出全脑,D-hanks液洗数次;(预先准备至少4把眼科剪刀,分别用于断头、剪头皮和剪颅骨及第3步的剪组织这4个操作)3、分离:以脑中线为起点,小心拨开大脑颞叶皮层,暴露出新月状海马回,小心夹出海马组织,置于冰浴的D-hanks液中,仔细剔除微血管,用充分剪碎组织;4、消化:加入同体积0.125%的胰蛋白酶,瓶口用锡箔纸盖上,37 ℃培养箱内消化20 min 左右,期间轻摇数次;过滤:加入数滴胎牛血清终止消化,用尖头吸管轻轻吹打细胞数分钟,至液体成米糊状即停止吹打,动作要轻柔,用150目网筛过滤,收集细胞悬液;5、接种:以1100 rpm离心5 min,倾去上清,用DMEM/F12培养液重悬细胞,轻轻吹打,台盼蓝染色快速计数,根据计数结果,调整细胞终浓度为1 00000个/ml,加入终浓度为10%胎牛血清后接种于培养瓶(板)中,置于37 ℃、含5% CO2培养箱中培养;12小时内禁止晃动6、换液:接种后24 h将培养液全量换成无血清DMEM/F12培养液,第48 h时加入终浓度为10 μmol/L的阿糖胞苷,以抑制非神经元细胞的过度生长,随后每3 d半量换液。
D-hank's液配制

胰酶配方10×D-Hank’s液 100mL单蒸水 900mL0.5M/L EDTA 10ML胰酶(粉末) 4g用1 M NaOH 调节pH 至7.2-7.4PH调完后用0.22 um的滤器过滤除菌(注:10×D-Hank’s液先稀释成1×,调PH 7.2,再加入胰酶粉末,最后再调pH)1×Hank’s液配方NaCl 8gKCl 0.4gCaCl20.14gMgSO4·7H2O 0.2gNa2HPO4·H2O 0.06gKH2PO40.06gNaHCO30.35gGlucose 1.00g酚红 0.02g加水至1L,用NaHCO3调pH 7.2-7.4(0.22 um 滤膜过滤除菌)20×D-Hank’s液配方NaCl 160gKCl 18gNa2HPO4·12H2O 3.04gKH2PO41.2gGlucose 20g 1%酚红 40mL加水至1L,10pM,10min;7.5% Na2CO3调pH 7.2-7.4RPMI1640 配方RPMI1640粉末 10.4gHEPES 4.67gL-G 2 m mol/L,0.292g2-ME(2-巯基乙醇) 1×10-5 mol/L丙酮酸钠 1 m mol/L(0.11g/L)PNC(青霉素) 100IUSM(链霉素) 100IUO 约800mLDH2磁力搅拌3-4小时,充分溶解;用NaHCO约2g,调pH至7.2-7.43DHO加至1000 mL混匀,0.22 um滤器过滤除菌,分装,-20度保存2附:0.01mol/L 2-ME配制:取7 mL 2-ME加入93mL双蒸水(1mol/L),再取1mol/L O至50mL,即成(即:万分之七)。
即70uL至100mL,临时用2-ME0.5mL加ddH2每1L 1640取1mL。
DMEM 配方DMEM粉末 10.4gHEPES 4.67gL-G 2 m mol/L,0.292g2-ME(2-巯基乙醇) 1×10-5 mol/L丙酮酸钠 1 m mol/L(0.11g/L)PNC(青霉素) 100IUSM(链霉素) 100IUDHO 约800mL2磁力搅拌3-4小时,充分溶解;用NaHCO约2g,调pH至7.2-7.43DHO加至1000 mL混匀,0.22 um滤器过滤除菌,分装,-20度保存2。
D-Hanks溶液说明书-北京华越洋生物科技有限公司

D-Hanks溶液简介:D-hanks液是一种平衡盐溶液,是无钙镁离子的Hanks液。
主要用于洗涤细胞和组织的,也是合成培养基的基础液。
如果含有钙镁离子的话,当用消化液消化细胞时钙镁离子会破坏消化液的活力,影响消化作用.配方:Hank\'s配方:NaCl 8.01;KCl 0.4;CaCl2 0.14; NaHCO3 0.35;KH2PO 4 0.06;Glucose 0.34(g/l); 而D-Hank`s 则不含有Ca2+、Mg2+,D-Hanks液则是无钙镁离子的Hanks液。
BSS与细胞生长状态下的pH值、渗透压及无菌状态一致,且配方简单,是组织培养基本用液,常用于配制培养基及其他用液,或洗细胞等,细胞在BSS中可生存几个小时。
胰蛋白酶(胰酸)溶液是一种常用的细胞消化液,原代培养时用于处理组织块,使细胞分离下来。
传代时用胰蛋白酶使培养细胞离开所贴附的培养瓶表面,并分散成单个细胞。
胰蛋白酶主要采自牛或猪的胰脏,呈白色粉末状,易潮解,应在低温干燥处保存。
胰酶的活力常用一份胰酶解离酪蛋白的份数表示,常用胰酶活力为1:125或1:250。
本实验室一般用1:250(GRC公司生产)。
胰蛋白酶对细胞的分离效果与细胞的类型、特性和瓶壁表面特性有关。
一般来说浓度大、温度高(勿高于37℃)、作用时间长,则对细胞分离能力大。
但超过一定程度会损伤细胞,导致细胞传代后不能贴壁或死亡。
胰酶在pH 8.0、37℃时消化能力最强。
溶液中的Ca2+、Mg2+和血清会降低胰酶活力,所以配制胰酶时须用无Ca2+、Mg2+的D-Hanks液。
当消化结束时,可加入少量血清或含血清的培养基以终止胰酶作用。
细胞传代使用的胰酶浓度是0.25%或0.2%。
用于原代细胞培养消化组织块则为0.1%或0.125%。
运输及保存:常温运输,4℃保存,有效期一年。
D-Hanks平衡盐溶液(含酚红)

D-Hanks平衡盐溶液(1×,含酚红)产品简介:平衡盐溶液(Balanced Salt Solution,BSS)与细胞生长状态下的pH值、渗透压等环境状态一致,具有维持渗透压、控制酸碱平衡、供给细胞生存代谢所必需的能量和无机盐成分等作用,可满足体外实验中,细胞生存并维持一定的代谢的基本需要。
平衡盐溶液(BSS)主要由无机离子组成,有时含有碳酸氢钠、葡萄糖、酚红等,如果有必要还可以加入HEPES,加入少量的HEPES后,可以减少氯化钠的加入量,以维持渗透压的平衡。
平衡盐溶液可以作为完全培养基的基液,亦可以用于稀释浓缩的氨基酸、维生素溶液以配制完全培养基。
BBS配方常有改动,如Hank’s BBS由不含钙镁或酚红的,也有含钙镁含酚红的等等, Dulbecco’s PBS由不含钙镁或含钙镁的等。
HBSS、EBSS、PBS等都是与较弱的磷酸盐缓冲液相关的盐溶液。
常见的平衡盐溶液有Eargle液,Hanks’液、低钙镁和无钙、镁平衡盐溶液及磷酸盐缓冲液 (PBS)等。
D-Hanks平衡盐溶液是最常用的磷酸盐缓冲溶液之一,又称CMF-Hanks' Balanced Salt Solution、CMF-HBSS溶液或D-Hanks’ BSS, 主要由氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾、碳酸氢钠、葡萄糖等组成,不含钙离子和镁离子,pH值一般为7.2~7.4。
Leagene D-Hanks平衡盐溶液(1×,含酚红),不含钙离子和镁离子,含酚红,用重蒸超纯水配制,pH值7.4,经严格过滤除菌处理,内毒素含量低,可用于胰蛋白酶和EDTA 细胞消化液等各种无或低钙镁细胞培养用液的配制,组织和细胞的漂洗等。
主要成分:主要由 KCl、KH2PO4、NaCl、NaHCO3、Na2HPO4、葡萄糖等组成,含少量酚红。
操作步骤(仅供参考):1、无需配制,直接使用。
注意事项:1、在进行细胞培养过程中细胞的洗涤时,应注意无菌操作,避免被微生物污染。
hanks液配制细胞培养技术

Hanks液的配制:①NaCl 8克、KCl 0.4克、MgSO47H2O 0.1克、MgCl·6H2O 0.1克溶于800毫升重蒸馏水中;②CaCl2(无水)0.14克溶于100毫升重蒸馏水中;③葡萄糖1.0毫克、NaHPO4 0.154克、KH2PO4 0.06克、0.4%酚红液5毫升溶于100毫升重蒸馏水中。
将上述3种溶液混和,8磅30分钟灭活菌,或用玻璃滤器过滤。
保存在5℃备用,用前以5%NaCO3调pH。
细胞培养技术(一)一.细胞培养的基本原理细胞培养是用酶消化法将组织碎块分离成单个细胞,用培养基制成细胞悬液,在体外适宜条件下,使细胞生长繁殖,并保留其一定的结构和功能特性。
细胞培养与组织培养、器官培养主要不同点在于原始培养的对象不同。
细胞培养使用的是单个细胞悬液,组织培养使用的是组织块(0.5~1立方毫米)或薄片(厚0.2毫米),而器官培养使用的是器官原基或器官的一部分或整个器官。
在组织培养中,细胞自组织块周围移出并生长,细胞在生长过程中总有移动(运动)或其它变动,这样就使被培养的组织难以长期维持其原有的结构和功能。
培养时间越长,发生变化的可能性越大,结果常使单一类型的细胞保存下来,最终成了细胞培养。
在细胞培养中,细胞生命活动和体内细胞一样,仍然是相互依存的,呈现一定的组织特异性,所以组织培养和细胞培养实际上无严格区别。
细胞培养技术是生命科学中常用的研究手段,该方法能排除神经体液因素的影响及肝、肾解毒功能的干扰,观察某些因素或药物对培养细胞的直接作用。
通过实验可获得某一类型细胞的纯培养。
如心肌组织中心肌细胞约占50%,非心肌细胞占50%;而经纯化分离的心肌细胞悬液中,心肌细胞可达95%以上,这样,心肌细胞原代培养实验基本不受其它细胞的干扰。
在细胞培养实验中能直接观察到培养细胞生命活动的动态过程;用定时显微摄影记录可发现一些肉眼观察不到的生命现象;还可利用电镜手段、同位素标记、放免法和免疫组化法等来研究细胞形态结构及细胞内化学物质的分布。
hanks液的配制细胞培养技术

Hanks液的配制:①NaCl 8克、KCl 0.4克、MgSO47H2O 0.1克、MgCl·6H2O 0.1克溶于800毫升重蒸馏水中;②CaCl2(无水)0.14克溶于100毫升重蒸馏水中;③葡萄糖1.0毫克、NaHPO4 0.154克、KH2PO4 0.06克、0.4%酚红液5毫升溶于100毫升重蒸馏水中。
将上述3种溶液混和,8磅30分钟灭活菌,或用玻璃滤器过滤。
保存在5℃备用,用前以5%NaCO3调pH。
细胞培养技术(一)一.细胞培养的基本原理细胞培养是用酶消化法将组织碎块分离成单个细胞,用培养基制成细胞悬液,在体外适宜条件下,使细胞生长繁殖,并保留其一定的结构和功能特性。
细胞培养与组织培养、器官培养主要不同点在于原始培养的对象不同。
细胞培养使用的是单个细胞悬液,组织培养使用的是组织块(0.5~1立方毫米)或薄片(厚0.2毫米),而器官培养使用的是器官原基或器官的一部分或整个器官。
在组织培养中,细胞自组织块周围移出并生长,细胞在生长过程中总有移动(运动)或其它变动,这样就使被培养的组织难以长期维持其原有的结构和功能。
培养时间越长,发生变化的可能性越大,结果常使单一类型的细胞保存下来,最终成了细胞培养。
在细胞培养中,细胞生命活动和体内细胞一样,仍然是相互依存的,呈现一定的组织特异性,所以组织培养和细胞培养实际上无严格区别。
细胞培养技术是生命科学中常用的研究手段,该方法能排除神经体液因素的影响及肝、肾解毒功能的干扰,观察某些因素或药物对培养细胞的直接作用。
通过实验可获得某一类型细胞的纯培养。
如心肌组织中心肌细胞约占50%,非心肌细胞占50%;而经纯化分离的心肌细胞悬液中,心肌细胞可达95%以上,这样,心肌细胞原代培养实验基本不受其它细胞的干扰。
在细胞培养实验中能直接观察到培养细胞生命活动的动态过程;用定时显微摄影记录可发现一些肉眼观察不到的生命现象;还可利用电镜手段、同位素标记、放免法和免疫组化法等来研究细胞形态结构及细胞内化学物质的分布。
软骨细胞培养

实验方法各种溶液的配制1、配制D-Hanks液(无钙镁)1L,PH8-9(1)称量Nacl8.0g,kcl0.4g,Na2Hpo4.H2o 0.06g, kH2po40.06g,NaHco30.35g,酚红0.02g(2)依次将各成分逐个溶解于800ml水中。
(3)用5.6% NaHco3溶解酚红0.02克。
(4)将酚红液(3)加入(2)中。
(5)补加水至1000ml,混匀。
(6)将Hanks液分装盐水瓶内,110℃、8镑高压蒸汽消毒灭菌20分钟,4℃冰箱保存备用。
2、配制0.25%胰蛋白酶溶液75ml(1)称取胰蛋白酶187.5mg,用少量D-Hanks液先将胰蛋白酶粉末调成糊状。
(2)补足Hanks液至75ml,搅拌混匀,置40℃水浴搅拌帮助溶解。
(3)冷却至室温后,置4℃冰箱过夜。
(4)用滤纸粗滤,再用0.22μm微孔过滤膜过滤除菌。
(5)分装小瓶,低温冰箱冰冻保存备用。
3、配制0.3%Ⅱ型胶原酶溶液49.5ml(1)称取Ⅱ型胶原酶150mg,用D-Hanks液溶解。
(2)补足Hanks液至49.5ml,搅拌混匀。
(3)用0.22μm微孔滤膜过滤除菌。
(4)分装小瓶,低温冰箱保存备用。
4、配制闪烁液(1)用电子天平称取POPOP 0.2g,PPO 2.0g。
(2)将上二者溶解在500ml二甲苯中,避光保存,备用。
取材与培养(1)取3kg重6月龄青紫蓝兔一只(购自首都医科大学动物房),兔耳静脉注射5ml空气致死。
(2)无菌条件下取双侧下肢膝,髋关节面软骨,置于D-Hanks液中漂洗2次,并用眼科剪将软骨剪碎至1mm3大小,继续用D-Hanks液漂洗2次。
(3)吸去漂洗液,加入0.25%胰蛋白酶溶液,并置入37℃、5%CO2孵箱中消化30分钟,中途不时摇晃。
(4)吸出胰蛋白酶溶液,加入0.3%Ⅱ型胶原酶溶液,置入37℃、5%CO2孵箱中继续消化3小时。
每1小时更换Ⅱ型胶原酶溶液1次。
用离心管留取各次消化液,离心2000rpmX10min,去除上清液。
